2007年中科院福建物质结构研究所无机化学考研试题
- 格式:pdf
- 大小:164.72 KB
- 文档页数:6

无机化学考研真题答案题目:正文:1. 题目一答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...2. 题目二答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...3. 题目三答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...4. 题目四答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...5. 题目五答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...6. 题目六答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...7. 题目七答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...8. 题目八答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...9. 题目九答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...10. 题目十答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...11. 题目十一答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...12. 题目十二答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...13. 题目十三答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...14. 题目十四答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...15. 题目十五答案:...(根据实际考察内容进行解答,这里只是示例,无实际参考价值) ...根据题目要求,以上是无机化学考研真题的答案,每道题目按照给定的格式进行解答。
请根据实际考察内容进行答题,以上答案仅为示例,并无实际参考价值。
希望能对您的学习有所帮助。

得分评卷人一、填空题(每空1分,共20K4[Fe(CN)6]化学系200 7级化学教育专业2009年秋学期《中级无机化学》试题(A )班级 学号 姓名—•总分核分人(试卷说明:本试卷共有三道大题,24道小题,考试时间90分钟,开卷考试)1. 近代酸碱理论有-理论,理论,溶剂体系理论,理论,鲁克斯的氧负离子理论和AG 理论。
2. 金属活动顺序表有 和 o3. 中心金属离子和配位体构成的络合型体称作 __________ ,配位体中直接与中心金属离子连接的原子叫作 o4. 分子或离子的化学组成相同而结构不同的现象称为 o 配合物的这种现象有,,电离异构,,O5. 金属水合配离^[C O (H 2O )6]3+属于 自旋构型。
6. 配合物中的非键轨道和反键轨道称为 o7. _____________ 地壳主要有 ,硅, ,钠,铁,钙,镁和钾八种元素构成。
8. 内过渡元素指 和 o9. 第六周期元素的S 电子失去比较困难,S 电子不易参与形成化学物,所以把S 电子称为10. 超分子结构是主客体间通过 缔合作用形成的。
得分 评卷人二、简答题(每题5分,共60分。
11.命名下列配合物:[Pt(NH 2)(NO 2)(NH 3)2]K 2[C O (SO 4)2](NH 4)3[SbCl 6] [CrCl 2(H 2O)4]Cl12. 指出下列各物种的共貌酸或共辗碱:NH 3 NHZ HCN HzPOj C5H5NH13. 什么是硬软酸碱原理?硬软酸碱原理在实际中有哪些应用价值?14. 试用Ellingham 图说明为什么碳可作为各种金属氧化物的“万能还原剂”,而皂不行? 15. Z n,Cd,Hg 的活泼性一定大于Cu,Ag,Au 吗?为什么?16. 为什么金属钠在水溶液中极不稳定,金属铜在水溶液中的稳定性乂如何,原因是什么? 17. 什么叫晶体场?晶体场包括哪些类型的场? 18. 晶体场理论的应用有哪些方面?试简述之。

普化无机试卷(10)班级 姓名 分数一、选择题 ( 共13题 23分 )1. 2 分 (4523) 黄色HgO 低于573 K 加热时可以转化成红色HgO ,这是因为………………………( )(A) 加热改变了结构类型 (B) 加热使晶体出现了缺陷(C) 结构相同,仅仅由于晶粒大小不同 (D) 加热增强了Hg 2+ 对O 2-的极化作用2. 2 分 (1349) 下列化合物与水反应放出 HCl 的是………………………………………………… ( )(A) CCl 4 (B) NCl 3 (C) POCl 3 (D) Cl 2O 73. 2 分 (2098) 在下列物质中,具有顺磁性的有:(1) (NH 4)2Re 2Cl 8; (2) (NH 4)3Tc 2Cl 8; (3) 氧合血红蛋白; (4) 维生素B 12。
4. 2 分 (1515) 在下列反应中:① Cu 2+ + I -−→−② Cu 2+ + CN - −→− ③ Cu 2+ +-24MnO + H 2O −→− ④+22Hg + I - (适量) −→− ⑤+22Hg + NH 3·H 2O −→−金属离子氧化态发生变化的是………………………………………………………………( )(A) ①②③④ (B) ①②③⑤ (C) ①②④⑤ (D) ②③④⑤5. 2 分 (3677) 在下列溶液中,HCN 电离度最大的是………………………………………………( )(A) 0.1 mol ·dm -3 NaCN (B) 0.1 mol ·dm -3 KCl 与0.2 mol ·dm -3 NaCl 混合液(C) 0.2 mol ·dm -3 NaCl (D) 0.1 mol ·dm -3 NaCN 和0.1 mol ·dm -3 KCl 混合液6. 2 分 (3879) 对于一个确定的化学反应来说,下列说法中正确的是………………………………( )(A) mr G ∆越负,反应速率越快 (B) m r H ∆越负,反应速率越快 (C) 活化能越大,反应速率越快 (D) 活化能越小,反应速率越快7. 2 分 (0401) H 2(g) +21O 2(g)H 2O(l) 的Q p 与Q V 之差(kJ ·mol -1)是………………………( )(A) -3.7 (B) 3.7 (C) 1.2 (D) -1.28. 2 分 (0909) 原子轨道角度分布图中,从原点到曲面的距离表示…………………………………( )(A) ψ值的大小 (B) r 值的大小 (C) Y 值的大小 (D) 4πr 2d r 值的大小9. 2 分 (1766) 已知Y 2O 2S : Eu 3+是目前彩色电视中广泛应用的一种稀土荧光粉 ,它显示的颜色是…………………………………………………………………………………………… ( )(A) 绿色 (B) 红色 (C) 黄色 (D) 蓝色10. 2 分 (3936) 关于原子结构的叙述中:①所有原子核均由中子和质子构成;②原子处于基态时,次外层电子不一定是8个;③稀有气体元素,其基态原子最外层有8电子;④最外层电子数为2的原子一定是金属原子。

结构化学习题集习题1:1.1 某同步加速器,可把质子加速至具有100×109eV的动能,试问此时质子速度多大?1.2 计算波长为600nm(红光),550nm(黄光),400nm(蓝光)和200nm(紫光)光子的能量。
1.3 在黑体辐射中,对一个电热容器加热到不同温度,从一个针孔辐射出不同波长的极大值,试从其推导Planck常数的数值:T/℃1000 1500 2000 2500 3000 3500l max/nm 2181 1600 1240 1035 878 7631.4 计算下列粒子的德布洛意波长(1) 动能为100eV的电子;(2) 动能为10eV的中子;(3) 速度为1000m/s的氢原子.1.5 质量0.004kg子弹以500ms-1速度运动,原子中的电子以1000ms-1速度运动,试估计它们位置的不确定度, 证明子弹有确定的运动轨道, 可用经典力学处理, 而电子运动需量子力学处理。
1.6 用测不准原理说明普通光学光栅(间隙约10-6m)观察不到10000V电压加速的电子衍射。
1.7 小球的质量为2mg,重心位置可准确到2μm,在确定小球运动速度时,讨论测不准关系有否实际意义?1.8 判断下列算符是否是线性\厄米算符:(1)(2)(3)x1+x2(4)1.9 下列函数是否是的本征函数?若是,求其本征值:(1)exp(ikx)(2)coskx (3)k (4)kx1.10 氢原子1s态本征函数为(a0为玻尔半径),试求1s态归一化波函数。
1.11 已知一维谐振子的本征函数为其中a n和α都是常数,证明n=0与n=1时两个本征函数正交。
1.12 若是算符的本征函数(B为常数), 试求α值,并求其本征值。
1.13 计算Poisson 方括,1.14 证明Poisson 方括的下列性质:(1)(2)1.15 角动量算符定义为:, ,证明: (1) (2)1.16 在什么条件下?1.17 设体系处于状态中,角动量和M Z有无定值。

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:高分子化学与物理考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
高分子化学部分一、 名词解释(共10分,每小题2分)1遥爪聚合物2悬浮聚合3聚合物立构规整度4活性聚合反应5. 接枝反应效率二.选择题(每题选一最佳答案,每小题2分,共20分)1.下列烯烃能通过自由基聚合获得高分子量聚合物的是。
a. CH3CH=C(CN)COORb. CH2=CH-CH3c. CF2=CF2d. CH2=C(C6H5)22. 甲基丙烯酸甲酯在25℃进行本体自由基聚合当转化率达到20%时出现了自动加速现象这主要是由于所致。
a. 链段扩散速度增大因而增长速率常数kp值增大b. 长链自由基运动受阻使终止速率常数k值明显减小c. 增长速率常数kp值的增加大于终止速率常数k值的减小d. 时间的延长3. 聚苯乙烯具有的特点。
a. 不透明b. 抗冲性能差c. 加工困难d. 不易着色4. 乳液聚合中,如果选用软脂酸钠(C15H31COONa)为乳化剂,其三相平衡点为62℃则聚合反应应该选择条件下进行。
a. 低于62℃b. 62℃c. 高于62℃5. 茂金属催化剂催化烯烃聚合具有的特点。
a. 多活性中心催化活性高b. 单活性中心聚合产品具有很好的均一性c. 多活性中心催化共聚能力优异d. 单活性中心对极性单体具有较好的催化活性科目名称:高分子化学与物理第1页共4页6. 在适当引发剂存在的条件下,引发下列单体的自由基聚合反应属于非均相聚合的是a. 水相中丙烯腈的溶液聚合b. 苯乙烯的本体聚合c. 二甲基甲酰胺中丙烯腈的溶液聚合d. 苯中苯乙烯的溶液聚合7.以C 4H 9Li 为引发剂分别选用THF 和甲苯为溶剂引发苯乙烯聚合实验发现,在THF 中苯乙烯聚合反应速率要大为了提高甲苯中苯乙烯的聚合速率,可加入a. BF 3b. SnCl 4c. TiCl 4d. 18-冠醚-68. 下列环状单体中容易进行开环聚合的是a.环戊烷b. 四氢呋喃c. 1,4-二氧六环d. 八甲基环四硅氧烷9. 在-78℃条件下以三氟化硼-乙醚引发体系使乙烯基丁基醚聚合最为合适的溶剂是a. 丙酮b. 乙酸乙酯c. 乙醚d. 氯甲烷10. 当线性聚酯化反应进行到95%以后若继续进行反应则会是 a. 分子量分布变窄 b. 聚合度迅速增大c. 反应程度迅速增大d. 产生大量低分子量副产物三、问答题(共25分)1.试述传统自由基聚合反应的主要优点与主要缺点写出一种目前较为成功的活性/可控自由基聚合方法的名称。
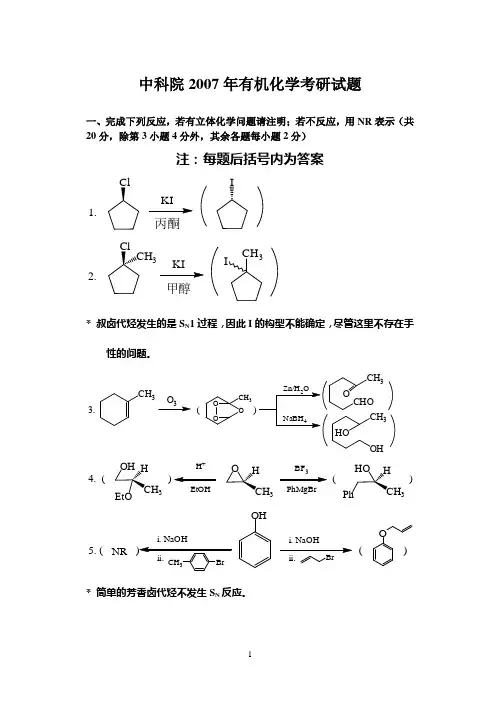
中科院2007年有机化学考研试题一、完成下列反应,若有立体化学问题请注明;若不反应,用NR 表示(共20分,除第3小题4分外,其余各题每小题2分)注:每题后括号内为答案1.丙酮I2.甲醇3CH 3I* 叔卤代烃发生的是S N 1过程,因此I 的构型不能确定,尽管这里不存在手性的问题。
3.()3CH3CH 3OO O334.()()H +EtOHBF PhMgBr3335.(()i.NaOHOHi.NaOHONR* 简单的芳香卤代烃不发生S N 反应。
6.+ClAlCl 37.OH OH CH 3CH 324O8.EtOHO OOEtOO* 逆Dieckmann 缩合。
9.Br 2H 2O二、为下列转变提供所需的试剂,必要时注明用量。
有的转变可能需要不止一步反应,请分别写出每步反应所需的试剂(20分,每小题2分)1.Br解:1 NaCN ; 2 H 3O +或 1 Mg/乙醚;2 CO 2;3 H 3O +2.OHOH O解:1 SOCl 2; 2 LiAlH(t-BuO)3; 3 H 3O + 或1 LiAlH 4;2 H 3O +; 3 CrO 3/Py3.()n -BuOHO-Bu3O解:1 SOCl 2;2 Me 2Cd 或 与过量的MeLi 反应后水解4.()NHOO解:1 NH 2OH/H +;2 H 2SO 4或PCl 5,Beckmann 重排。
5.()HO2O解:NaNO 2/HCl6.PhOPhO()解:1 LDA (1mol );2 MeI ;必须用强碱,否则易导致自身缩合。
7.O OBr解:Br 2(1mol )/HAc8.解:1 B 2H 6;2 H 2O 2/OH -9.()n -Bu2On -Bu CN解:P 2O 5或POCl 310.EtBrEt-NH 2解:1 NaN 3;2 LiAlH 4; 3 H 3O +三、判断题(共28分。
1、2两个小题各5分;3、4两个小题各9分) 1.指定下列各化合物手性中心的绝对构型(R/S )。

无机化学考研真题及答案在考研备考过程中,无机化学一科无疑是备考难点之一。
掌握真题并熟练解答是备考过程中的重要环节。
本文将给大家介绍一些无机化学考研真题及答案,并提供一些备考建议。
真题一:XXX这是一道关于XXX的选择题。
答案为B。
解析:XXX是指XXX的内容。
XXX的特点是XXX。
根据题目的要求,我们可以推断出答案为B。
这是因为XXX。
因此,选择B是正确的答案。
备考建议:掌握题目中关键字,了解各个选项的含义。
在解答选择题时,可以通过排除法确定最佳答案。
此外,平时要多做真题练习,提高解题速度和准确度。
真题二:XXX这是一道关于XXX的填空题。
答案为XXX。
解析:根据题目的提示,我们可以推断出填空处应该是XXX。
这是因为XXX。
因此,答案为XXX。
备考建议:填空题是对知识的灵活应用和推理能力的考察。
平时应该多做类似的题目,掌握常见的填空题模式,培养敏捷的思维反应能力。
真题三:XXX这是一道关于XXX的计算题。
答案为XXX。
解析:根据题目中给出的条件,我们可以利用公式/方法来计算出答案。
进行计算的过程是XXX。
因此,答案为XXX。
备考建议:计算题是对公式运用能力和计算能力的考察。
备考时需熟练掌握重要的公式和方法,并多做相关题目练习,提高计算的准确度和效率。
真题四:XXX这是一道关于XXX的判断题。
答案为XXX。
解析:对于判断题,我们需要全面理解题目的要求,并结合自己对知识的掌握进行判断。
根据题目的提示和我们的知识,我们可以判断出答案为XXX。
这是因为XXX。
因此,答案为XXX。
备考建议:对于判断题,要理解题目的要求,结合自身的知识进行判断,避免主观意见干扰判断。
平时要多做类似的题目,培养正确判断的能力。
总结:无机化学考研真题及答案的掌握对于备考非常重要。
在备考过程中,要注重理解题目的要求,积累并灵活运用相关的知识点、公式和推理能力。
此外,多做真题练习,培养解题思维和提高解题效率。
相信通过认真备考和熟练解答真题,大家一定能取得优异的考研成绩。

一、单项选择题 第 2 章 热化学 1、在以下反响中, Q p =Q v 的反响为( ) ( A ) CaCO 3(s) →CaO(s)+CO 2(g) ( B ) N 2(g)+3H 2(g) →2NH 3(g) ( C ) C(s)+O 2(g) →CO 2(g) ( D ) 2H(g)+O 2(g) →2H 2O (l ) 2、以下各反响的( 298)值中,恰为化合物标准摩尔生成焓的是( )( A ) 2H(g)+ O 2(g) →H 2O ( l ) (B ) 2H 2(g)+O 2(g) →2H 2 O ( l )2232 2 (g )3( C ) N (g)+3H(g) →2NH (g)( D )N (g) +H→NH(g)3、由以下数据确定4CH(g) 的为( )C(石墨 )+O 2(g)=CO 2(g) = ·mol -1H 2(g)+ O 2(g)=H 2O(l) =·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O ( l ) =·mol -1( A )211 kJ ·mol -1; (B )· mol -1;( C ) kJ ·mol -1; ( D )缺条件,没法算。
4、已知:( 1) C(s)+O 2(g) →CO(g), (1)= ·mol - 1( 2)C(s)+O 2(g) →CO 2(g), (2)= ·mol - 1 则在标准状态下 25℃时, 1000L 的 CO 的发热量是( )( A ) 504 k J ·mol - 1 (B )383 k J ·mol - 1 (C )22500 k J ·mol -1 ( D )× 104k J ·mol - 1 5、某系统由 A 态沿门路Ⅰ到 B 态放热 100J ,同时获取 50J 的功;当系统由 A 态沿门路Ⅱ到 B 态做功80J 时, Q 为 ( ) ( A ) 70J (B ) 30J (C )- 30J (D )- 70J 6、环境对系统作 10kJ 的功,而系统失掉 5kJ 的热量给环境,则系统的内能变化为 ( ) ( A )- 15kJ ( B ) 5kJ (C ) -5kJ (D ) 15kJ 7、表示 CO 2生成热的反响是( )( A ) CO (g )+ 1/2O 2( g ) =CO 2(g ) rHm θ=( B ) C (金刚石) + O 2(g )=CO 2( g ) rHm θ=( C )2C(金刚石) + 2O 2(g )=2CO (g ) rHm θ=(D )C (石墨) + O 2(g )=CO 2(g ) rHm θ=二、填空题1、25℃下在恒容量热计中测得: 1mol 液态 C 6H 6 完整焚烧生成液态 H 2O 随和态 CO 2时,放热,则△U 为,若在恒压条件下, 1mol 液态 C 6H 6 完整焚烧时的热效应为。

2007无机化学试题及答案_2007无机化学期末试题A第 - 1 - 页共 3 页西北第二民族学院试卷说明:学生可携带计算器一、单项选择题(每题 1.5分共15分)()1、已知298K 时,H 2(g)+Br 2(1)=2HBr(g),△rH θm =-72.6kJ ·mol -1N 2(g)+3H 2(g)=2NH 3(g),△rH θm=-91.8kJ ·mol-1NH 3(g)+HBr(g)=NH 4Br(s),△rH θm=-187.7kJ ·mol-1则△f H θm (NH 4Br,s)为:(A )269.9kJ ·mol -1 (B )-539.8kJ ·mol -1 (C )-269.9kJ ·mol -1 (D )539.8kJ ·mol -1()2、如果有一化学反应在任何温度下都不能自发进行,则必须符合:(A )△H <0,△S <0 (B )△H >0,△S >0 (C )△H >0,△S <0 (D )△H <0,△S >0()3、反应速率的质量作用定律,适用于:(A )一步完成的简单反应(B )气相反应(C )液相反应(D )反应方程中化学计量数为1的反应()4、已知反应3O 2(g)→2O 3(g),△rH θm =285.4kJ ·mol -1 ,下列条件中有助于该反应进行的是:(A )高温低压(B )高温高压(C )低温低压(D )低温高压()5、298K 时K (PbCl 2)=16×10-5,则饱和PbCl 2溶液中c (Cl - )为:(A)3.2×10-2 mol·L -1 (B)2.5×10-2 mol·L -1;(C)1.6×10-2 mol·L -1 (D)4.1×10-2mol·L -1()6、NCl 3分子的几何构型是三角锥形,这是由于N 原子采用的轨道杂化方式是:(A)sp (B)不等性sp 3 (C)sp 2 (D)dsp 2(A)Fe 3+/Fe 2+ (B)Cu 2+/Cu (C) MnO 4-/Mn 2+ (D)无法判断()8、按照量子力学模型,下列各组量子数(n,l,m 和m s )的组合不可能存在的是:(A )5,2,0,+1/2 (B )3,1,1,-1/2 (C )3,2,-2,+1/2 (D )4,4,2,+1/2()9、下列离子对中,用NaOH 溶液处理后能进行分离的是哪一对离子:(A)Al 3+ , Fe 3+ (B)Fe 3+ , Fe 2+ (C)Al 3+ , Zn 2+ (D)Pb 2+ , Zn 2+()10、下列物质的氧化性与惰性电子对效应无关的是:(A)Pb(IV) (B) Bi(V) (C)Cr(VI) (D)Tl(III)二、根据题目要求,解答下列各题(共23分)1、离子电子法配平(碱性介质):CrO 2-+Br 2→CrO 42-+Br-(5分)2、基态Co 原子的价层电子构型为3d 74s 2,实验测定[Co(NH 3)6]3+的μ=0B.M.,试分析中心离子的杂化类型及配合物的空间构型。