中科院《无机化学》2005-2012考研真题及答案(很清晰)
- 格式:pdf
- 大小:18.98 MB
- 文档页数:52

无机化学试题与答案集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]无机化学试题一、选择题(20分,每题2分)1.已知:298K时,反应C(石墨)+ O2(g)→ CO2(g)⊿r H mΘ=-393.5kJ ·mol-1CO(g)+ 1/2O2(g)→ CO2(g)⊿r H mΘ=-283.0kJ ·mol-1则反应C(石墨)+ 1/2O2(g)→ CO(g)的⊿r H mΘ等于()。
A.110.5 kJ ·mol-1B.- 110.5 kJ ·mol-1C.-676.5 kJ ·mol-1D. 676.5 kJ ·mol-12.已知反应A(g)+ 2B(l) 4C(g)的平衡常数kθ=0.123,则反应4C(g)A(g)+2B(l)的平衡常数为()A.0.123 B. -0.123 C. 8.31 D. 6.473.根据下列反应:2Fe3++ Fe →3Fe2+2FeCl3 + Cu →2FeCl2+ CuCl22KMnO4 + 10FeSO4+ 8H2SO4→2MnSO4+ 5Fe2(SO)3+ K2SO4+ 8H2O判断电极电势最大的电对是()A.MnO4-/Mn2+ B.Fe3+/Fe2+ C.Fe2+/Fe D.Cu2+/Cu4. BCl3分子中,B以SP2杂化轨道成键,则该分子的空间构型是()A.三角形B.平面三角形C.直线形D.四面体5. 对于主量子数n=3的电子层,可以容纳的轨道数n2和电子数是()A.3和6B.3和9C.9和18D.3和186. 在配合物K3[C O C13(NO2)3]中,中心离子的电荷是()A. +5B. +4C. +3D.+27.下列氧化物中, 熔点最高的是()A. CaOB. MgOC. SO3 D. P2O58.原电池符号为:(-)Zn∣ZnS04(c1)‖Fe2(S04)3(c2), FeS04(c3)∣Pt(+)若加氨水于锌电极溶液中,使Zn2+生成锌氨配离子[Zn(NH3)4]2+,这时电池电动势将()。

青岛科技大学2005年硕士研究生入学考试试卷考试科目 无机化学(A 卷)(答案全部写在答题纸上)一、选择题(每题2分,共40分)1、当基态原子的第六电子层中只有1个电子时,则该原子的第五电子层中的电子数是A. 8电子;B. 18电子;C. 8~18电子;D. 8~32电子;2、某原子轨道中的一个电子用波函数表示时,下列表示正确的是 A. n ψ; B. ,n lψ;C. ,,n l m ψ;D.,,,ψn l m ms;3、在下列各种电子构型的正离子中,极化力和变形性均较小的是 A. 8电子; B. 9~17电子; C. 18电子; D. 18~32电子4、下列分子和离子中,呈逆磁性的是 A. O 2+; B. N 22-; C. NO ; D. CO ;5、下列分子和离子中,键角最小的是 A. NH 3 ; B. NC13 ; C. BF 3 ; D. NF 3 ;6、据VSEPR 理论,I 3-的几何结构是 A. 直线 B. 三角锥 C. 三角双锥体D. T 形7、已知[C o F 6]3-与C o 3+的磁矩相同,则配离子的中心离子杂化轨道类型及空间构型为:A . d2SP3正八面体;B.d2SP3正四面体;C. SP3d2正八面体;D.SP3d2正四面体;8、下列配合物中,磁矩最小的是A. [Cr(H2O)6]2+B. [Mn(CN)6]4-C. [Co(H2O)6]2+D. [Co(NH3)6]3+9、任意温度下都是“非自发过程”的是A. △H<0, △S<0 ;B. △H>0, △S<0 ;C. △H>0, △S>0 ;D. △H<0, △S>0 ;10、根据“酸碱质子理论”,都属于“两性物质”的是A . HF,F-,HSO4-;B. NaB4O7.10H2O,H2O,HPO4-;C.HCO3-,CO32-,HS-;D.OH-,H2PO4-,NH4+ ;11、酸性强弱关系正确的是A. H2SeO4>H2SO4;B.H2SO4<H2S2O7;C.H4SiO4>H3PO4;D.HClO>HClO3;12、氧化性强弱关系正确是A. HClO4<HBrO4<H5IO6;B. H2SO4<H2SeO4>H6TeO6;C. HClO4<H2SO4<H3PO4;D. HNO3<H3PO4<H3AsO4;13、某化学反应的速率常数2⨯=k min-1,0.10mol.L-1反应物的半衰期为.4-1062A. 15min ;B. 30min;C. 216min;D. 无法计算;14、下列物质中,熔点最低的是A. ZnCl2;B. FeCl2;C. CaCl2;D. HgCl2;15、已知5k,欲配制1.0L pH=10.00,C NH3.H2O=0.10 mol.L-1的缓冲溶液,需用(NH4)2SO4 =10⨯8.1-b的物质的量为A. 2100.9-⨯mol.L-1;B. 3108.1-⨯mol.L-1;C. 3100.9-⨯mol.L-1;D. 2108.1-⨯mol.L-1;16、实验测得0.01 mol.L-1MOH溶液的pH=10.00,则该碱的θbK为A. 2100.1-⨯;B. 6100.1-⨯;C. 18100.1-⨯;D. 12100.1-⨯;17、下列电对中Φθ,最小的是A. Ag+/Ag;B. AgBr/Ag;C. Ag(NH3)2+/Ag;D. Ag(CN)2-/Ag;18、下列各组离子的混合溶液中,加入Na2S溶液时没有黑色沉淀生成的是A.. Cd2+,Mn2+;B. Sb3+,Bi3+;C. A g+,Cu2+ ;D. Pb2+,H g2+;19、下列各组离子在酸性溶液中不能共存的是A . Cr2O72-, MnO4-, Fe3+;B . Co2+, Cu2+,Sb3+ ;C . Fe2+, I-,Mn2+ ;D . Cr3+,Sn2+ ,Fe3+;20、下列离子在水溶液中不发生歧化反应的是A. Mn3+;B. Fe2+;C. MnO42-;D. Cu+;二、填空题(每空1分,共35分)1、已知某元素在Kr以前,(指周期表中的位置)。

⽆机化学考研试题(含答案,已经整理好的)⼀、单选题第2章热化学1、在下列反应中,Q p =Q v 的反应为()(A )CaCO 3(s) →CaO(s)+CO 2(g) (B )N 2(g)+3H 2(g) →2NH 3(g)(C )C(s)+O 2(g) →CO 2(g) (D )2H 2(g)+O 2(g) →2H 2O (l )2、下列各反应的(298)值中,恰为化合物标准摩尔⽣成焓的是()(A )2H(g)+ O 2(g)→H 2O (l )(B )2H 2(g)+O 2(g)→2H 2O (l )(C )N 2(g)+3H 2(g)→2NH 3(g) (D )N 2(g) +H 2(g)→NH 3(g)3、由下列数据确定CH 4(g)的为() C(⽯墨)+O 2(g)=CO 2(g) =-393.5kJ·mol -1H 2(g)+ O 2(g)=H 2O (l) =-285.8kJ·mol -1CH 4(g)+2O 2(g)=CO 2(g)+2H 2O (l ) =-890.3kJ·mol -1(A )211 kJ·mol -1;(B )-74.8kJ·mol -1;(C )890.3 kJ·mol -1;(D )缺条件,⽆法算。
4、已知:(1)C(s)+O 2(g)→CO(g), (1)= -110.5k J·mol -1(2)C(s)+O 2(g)→CO 2(g),(2)= -393.5k J·mol -1 则在标准状态下25℃时,1000L 的CO 的发热量是()(A )504 k J·mol -1 (B )383 k J·mol -1 (C )22500 k J·mol -1 (D )1.16×104 k J·mol -15、某系统由A 态沿途径Ⅰ到B 态放热100J ,同时得到50J 的功;当系统由A 态沿途径Ⅱ到B 态做功80J 时,Q 为()(A ) 70J (B ) 30J (C )-30J (D )-70J6、环境对系统作10kJ 的功,⽽系统失去5kJ 的热量给环境,则系统的内能变化为()(A )-15kJ (B ) 5kJ (C )-5kJ (D ) 15kJ7、表⽰CO 2⽣成热的反应是()(A )CO (g )+ 1/2O 2(g )=CO 2(g )ΔrHmθ=-238.0kJ.mol-1(B )C (⾦刚⽯)+ O 2(g )=CO 2(g )ΔrHmθ=-395.4kJ.mol-1(C )2C (⾦刚⽯)+ 2O 2(g )=2CO 2(g )ΔrHmθ=-787.0kJ.mol-1(D )C (⽯墨)+ O 2(g )=CO 2(g )ΔrHmθ=-393.5kJ.mol-1⼆、填空题1、25℃下在恒容量热计中测得:1mol 液态C 6H 6完全燃烧⽣成液态H 2O 和⽓态CO 2时,放热3263.9kJ ,则△U 为-3263.9,若在恒压条件下,1mol 液态C 6H 6完全燃烧时的热效应为-3267.6。

中南大学2010年硕士研究生入学考试试卷试题A 考试科目代码及名称:912 无机化学一.选择题(每小题2分,共40分)1.欲配制pH=3.0的缓冲溶液,在下列缓冲体系中选择()最好。
A.Na2CO3-NaHCO3(H2CO3的pKƟa2=10.25);B.HCOOH-NaOH(HCOOH的pKƟa=3.75);C.HAc-NaOH(HAc的pKƟa=4.74);D.H3PO4-NaH2PO4(H3PO4的pKƟa1=2.21)。
2.下列关于分子晶体的叙述中正确的是()。
A.分子晶体中只存在分子间力B.分子晶体晶格结点上排列的分子可以是极性分子或非极性分子C.分子晶体中分子间力作用较弱,因此不能溶解于水D.分子晶体在水溶液中不导电3.钠盐中,热稳定性最弱的是()A.卤化物B.硫酸盐C.磷酸盐D.硝酸盐4.在下列反应中,Q p=Q v的反应为()A.CaCO3(s)→CaO(s)+CO2(g)B.N2(g)+3H2(g)→2NH3(g)C.C(s)+O2(g)→CO2(g)D.2H2(g)→2H2O(l)5.按照分子轨道理论,O2中电子占有的能量最高的分子轨道是()A.σ2pB.σ*2pC.π2pD.π*2p6.下列四种电子构型的原子,其中电离能量最低的是()A.ns2np3B.ns2np4C.ns2np5D.ns2np67.下列说法不正确的是()A.电子在原子轨道中的排布应使整个基态原子的能量处于最低;B.在同一原子中,不可能出现四个量子数完全相同的两个电子;C.在能量简并的轨道上,电子尽先分占不同的轨道,且自旋平行;D.在电子排列顺序中最后排入的电子,在电离时一定会最先失去。
8.根据价层电子对互斥理论,XeO4分子的几何构型是()A.平面四方形B.四面体形C,三角锥形 D.八面体形9.金属钡(原子量为137)为体心立方结构,其单位晶胞的相对质量为()A.137B.274C.411D.54810.将含()的溶液用H 2SO 4酸化后,再加入KMnO 4,在加KMnO 4前后只观察到紫色退去。
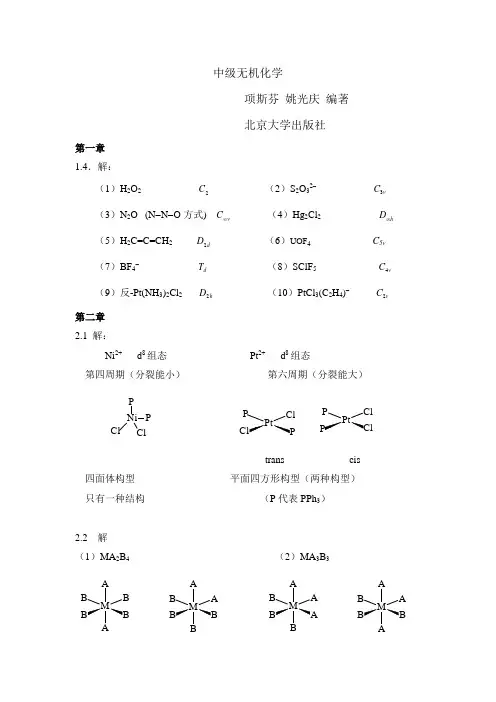
中级无机化学项斯芬 姚光庆 编著 北京大学出版社第一章 1.4.解:(1)H 2O 22C(2)S 2O 32- 3v C (3)N 2O (N -N -O 方式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4-d T (8)SClF 54v C(9)反-Pt(NH 3)2Cl 2 2h D(10)PtCl 3(C 2H 4)- 2v C第二章 2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态 第四周期(分裂能小)第六周期(分裂能大)P Ni ClP ClClCl P Ptrans cis四面体构型 平面四方形构型(两种构型) 只有一种结构 (P 代表PPh 3)2.2 解 (1)MA 2B 4(2)MA 3B 3M A BB M AA BM AAB M A A Btrans cis fac(面式) mer(经式) D4h C2v C3v C2vμ=0 μ≠0 μ≠0 μ≠0μfac>μmer2.3 Co(en)2Cl2+D2h C2光活异构体C2Co(en)2(NH3)Cl2+33Htrans cisCo(en)(NH3)2Cl2+3333NHNH33trans(1)trans(2) cis2.4 Co(en)33+Ru(bipy)32+手性分子D3D3PtCl(dien)+dienHNCH2CH2CH2NH2NH2CH2基本上为平面分子,无手性2.5 (1) 分别用BaCl2溶液滴入,有白色沉液出现的为[Co(NH3)5Br]SO4,或分别加入AgNO3溶液,产生浅黄色沉淀的为[Co(NH3)5SO4]Br。
(2)等物质量的异构体中分别加入过量AgNO3,产生少量沉淀(1molAgCl↓)的为前者(摩尔比为2:1),产生大量沉淀(2molAgCl↓)的为后者。
或用电导方法测量,前者和后者的电导比为2:3(3)[Co(H2O)4Cl2]+顺式C2v、反式D4h,对称性不同,偶极矩不同,可以用物理方法鉴别,例如红外或Raman光谱不同。

无机化学考研真题答案无机化学考研真题答案【篇一:2013无机化学真题】class=txt>中国科学院大学2013 年招收攻读硕士学位研究生入学统一考试试题科目名称:无机化学考生须知:1.本试卷满分为 150 分,全部考试时间总计 180 分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、选择题 (以下各小题所列答案中只有一个是正确的。
共 20 小题,每小题 2分,共 40 分。
)1. 下列物质的水溶液易变成黄色的是:(a) agno3(b) hbr (c) na2s (d) nh4scn2. 下列各元素中,第一电子亲和势代数值(a1)最大的是:(a) cl (b) br (c) he (d) f3. 下列各物种中,属于 n2h5+的共轭碱的是:(a) n2h4(b) n2h5oh (c) n2h6+(d) nh34. co2+的价层电子构型是:(a) 3d74s2(b) 3d7(c) 3d54s2(d) 3d101某一元弱酸溶液的 ph=4.55,则该弱酸的 ka 为:87236. 下列各组原子轨道中不能叠加成键的是:(a) px-px (b) px-py(c) s-px (d) s-pz7. 某反应在标准状态和等温等压条件下,在任何温度都能自发进行的条件是:1,从热力学观点看要使 h2(气)达到最大转化率,反应条件应该是:(a) 高温低压(b) 低温低压(c) 高温高压9. 已知:?(cu2+/ cu)=+0.34 v,?(cu+/ cu)=+0.522 v, 那么?(cu2+ (d) 低温高压/ cu+) 为:(a) +0.182 v (b) +0.158 v(c) +0.364 v (d) +0.862 v10. 在下面所列元素中,与氢能生成离子型氢化物的一类是:(a) 碱金属和钙、锶、钡 (b) 绝大多数活泼金属科目名称:无机化学第 2 页共 4 页(c) 镧系金属元素 (d) 过渡金属元素11. 互卤化物 ax3 中 clf3 是最活泼的,但是液态 brf3 导电性较好,原因是:(a) brf3 的摩尔质量大(b) brf3 较易挥发(c) brf3 较易解离为 brf2+、brf4(d) 导电性与浓度无关12. 干燥 h2s 气体,可选用的干燥剂是:(a) cuso4 (b) koh(c) 浓 h2so4 (d) p2o513. 叠氮酸的结构式是 hn1=n2≡n3,1、2、3 号氮原子采取的杂化类型分别为:(a) s p3,s p,s p (b) s p2,s p,s p(c) s p3,s p,s p2(d) s p2,s p,s p214.下列各元素的正三价离子的半径由大到小的正确排列顺序为:(a) pm、pr、tb、er (b) pr、pm、er、tb(c) pr、pm、tb、er (d) pr、tb、pm、er15. au、pt 分别与王水作用,关于其主要生成物,下列说法正确的是:(a) h[aucl2]、h2[ptcl4],均有 no2 (b) h[aucl2]、h2[ptcl4],均有no(c) h[aucl4]、h2[ptcl6],均有no2(d) h[aucl4]、h2[ptcl6],均有no16. 下列盐中,热稳定性顺序正确的是:(a) nahco3 baco3na2co3 (b) na2co3nahco3 baco3(c) baco3nahco3na2co3 (d) nahco3na2co3 baco317. 在配体 nh3,h2o,scn,cn中,通常配位能力最强的是:(a) scn(b) nh3(c) h2o (d) cn18. 下列有关硼酸的叙述中,正确的是:(a) 硼酸是三元路易斯酸(b) 硼酸在冷水中溶解度小,在热水中因部分氢键断裂而溶解度增大(c) 硼酸与多元醇发生酯化反应,产物的酸性减弱(d) 在硼酸中硼原子采取 sp2和 sp3杂化19.21h+31h →42he+1n 此过程的反应类型是:(a) 裂变(b) 衰变(c) 聚变 (d) 化合反应20. 在立方面心晶胞中,a 原子占有顶点,b 原子占有面心,x 原子占有 a、b围成的所有四面体的空隙,则该化合物的化学式为:(a) abx (b) ab2x4 (c) ab3x8 (d) ab3x4二、填空题 ( 共 5 小题,共 30 分 )1 / 2c(b)。

中科院无机化学试题及答案一选择题(30分):1 下列溶剂最能溶解离子型溶质的是------------------------------------------------------------()A CCl4;B CH3OH;C C5H12; D(C2H5)2O。
2 下列物质中碱性最强的是-----------------------------------------------------------------------( )A R4NOH;B R3NHOH;C R2NH2OH; DNH3(aq)。
3 硼酸晶体中质点间的作用力是-----------------------------------------------------------------( )A 氢键,范德华力;B 共价键;C 离子键;D 离子键,共价键。
4 对于常见分子筛的成分中,硅铝比越大,下列说法正确的是-------------------------()A 耐酸性强,热稳定性差;B 耐酸性差,热稳定性差;C 耐酸强,热稳定性强;D 耐酸怀差,热稳定强。
5 下列金属中,熔沸点相差最大的是-----------------------------------------------------------()A Li;B Al;C Ga;D In。
6NCl3的水解产物是---------------------------------------------------------------------------------()ANH3+HOCl; B NH3+HCl; C HNO2+HCl; DNH2OH+HCl。
7 已知某反应的活化能为114kj.mol-1,采用一种催化剂可使其活化能降低一半,该反应速率将加快倍数约是---------------------------------------------------------------------------------()A 1×102;B1×1010;C1×106;D1×108。

第一章原子结构和元素周期系 (2)第二章分子结构 (8)第三章晶体结构 (11)第四章配合物 (12)第五章化学热力学基础 (15)第六章化学平衡常数 (18)第七章化学动力学基础 (21)第八章水溶液 (23)第九章酸碱平衡 (24)第十章沉淀溶解平衡 (26)第十一章电化学基础 (27)第十一章电化学基础 (30)第十二章配位平衡 (31)第十三章氢稀有气体 (32)第十四章卤素 (34)第十五章氧族元素 (36)第十六章氮、磷、砷 (39)第十七章碳、硅、硼 (42)第十八章非金属元素小结 (45)第十九章金属通论 (47)第二十章s 区金属 (48)第二十一章p 区金属 (51)第二十二章ds 区金属 (53)第二十三章d区金属(一) (56)第二十四章d区金属(二) (59)第一章原子结构和元素周期系一.是非题1. .......................................................................... 电子在原子核外运动的能量越高,它与原子核的距离就越远.任何时候,1s 电子总比2s 电子更靠近原子核,因为E2S > E s. (-X……2. 原子中某电子的各种波函数,代表了该电子可能存在的各种运动状态,每一种状态可视为一个轨道• ................................. (•话.......3. 氢原子中,2s 与2p 轨道是简并轨道,其简并度为4;在钪原子中,2s 与2p 轨道不是简并轨道,2p x,2p y,2p z为简并轨道,简并度为3. ................................. ••…4. 从原子轨道能级图上可知,任何原子在相同主量子数的轨道上,能量高低的顺序总是f > d > p > s;在不同主量子数的轨道上, 总是(n-1)p > (n-2)f > (n-1)d >ns. .................................................................................. (X ...................5. 在元素周期表中, 每一周期的元素个数正好等于该周期元素最外电子层轨道可以容纳的电子个数................................... (X .............6. 所有非金属元素(H,He 除外) 都在p 区, 但p 区所有元素并非都是非金属元素 ............................................. (v) ..................7. 就热效应而言,电离能一定是吸热的,电子亲和能一定是放热的. ..... (X8. 铬原子的电子排布为Cr[Ar]4s1 3d5,由此得出:洪特规则在与能量最低原理出现矛盾时,首先应服从洪特规则 ............................. (X ...........9. s区元素原子丢失最外层的s电子得到相应的离子,d区元素的原子丢失处于最高能级的d电子而得到相应的离子 .......................... (X ........10. 在原子核里因质子数和中子数不同,就组成了不同的核素;同样在原子核里因质子数和中子数不等,就构成了同位素.可见,核素也就是同位素. ....... (X二.选择题1. ................................................................................................. 玻尔在他的原子理论中(D)A. 证明了电子在核外圆形轨道上运动;B. 推导出原子半径与量子数平方成反比;C应用了量子力学的概念和方法;D.解决了氢原子光谱和电子能量之间的关系问题.2. ........................................................................................................ 波函数和原子轨道二者之间的关系是 ........................................................ (C)A. 波函数是函数式,原子轨道是电子轨迹;B. 波函数和原子轨道是同义词;。

中级无机化学习题第二章对称性与群论基础1、利用Td点群特征标衣(右表)回答卜冽问题(1)、群阶,对称操作类数,不可约表示数(2)、S0「-离子屮S原子3px轨道及3d”y轨道所属的不可约农示(3)、可约表不「(10厂2,2Q0)中包括了Td E8C33C26S46a d 哪些不可约表不?SO『-离子是竹农A】11111x2+y2+z2现为红外活性?so/-离子是否表现A2111・1X2-y2为拉曼活性的?E2・1200Ti30・11(Rx,Ry,Rz)解:(1)点群的阶h-8;对称操作类-5;T230・1・11(x,y,z)(xy,xz,yz)不可约表示数=5(2)S原子的Px轨道所属不可约表示为T2表示。
(3)a AX = -Yg^r ^. =-(1x10x1 +8x(-2)xl)+3x2xl = 0;同理h8ci A1 = 0;如]=1;a T2 =i ;a E =2 ;故可约表示r(10?_2 2 0 0)=刁㊉匚㊉2E因T?表示中包含(x,y,z)和(xy,xz,yz),故既表现为红外活性又表现为拉曼活性。
2.利用C3v点群特征标表(见下表)回答下列问题(2)、NH3分子中偶极矩所属的不可约表示(3)可约表示「(6, 0, 2)屮包括了哪些不可约表示?解:(1)点群的阶h=6;对称操作类=3;不可约表示数=3(2)NH?分子中偶极矩所属不可约表示为A】表示(3)(lx6xl + 2x0xl + 3x2xl) = 2;同理h 6a A2 = 0 , a飞=2 ;故"J约表示r(6 0 2) = 2A l㊉2E3.利用CqN群特征标表(见下表)回答下列问题(2)、SF5C1分子屮S原子Px轨道所属的不可约表示(3)、可约表示「(4, 0, 0,・2, 0)中包括了哪些不可约表示?4、试用特征标表的分析MnO,的杂化方式。
(要求冇分析的详细过程)。
第三章配位化学基础 1、配位体与中心金属离子的龙成键作用将影响配合物的分裂能,假 定配位体的兀轨道能量低于屮心金属离子的龙轨道,且已被电子所填 满。

中科院⾼等⽆机化学真题及参考答案10-112011:⾼等⽆机化学⼀、选择题(每题1分,共40分)1.在⽯墨晶体中碳原⼦层与碳原⼦层之间的作⽤⼒为( D )(A)配位键(B) 共价键(C) 双键(D) 范德华⼒2. 下列氢化物中,不属于典型的离⼦氢化物的是(C )(A) NaH (B) KH (C) BeH2(D) BaH23. 下列各物种中,属于有机⾦属化合物的是(C )(A) Co(bipy)33+(B) Co(NO)(CO)3(C) [η5-(C5H5)2Co]+(D) C2H5ONa4. CIO4-、BrO4-、和IO4-氧化性能⼒⼤⼩的顺序是(A )(A) CIO4->BrO4->IO4-(B) CIO4-> IO4- > BrO4-(C) CIO4-IO4-(D) IO4- >BrO4-> CIO4-5. 下列轨道上的电⼦,在xy平⾯上的电⼦云密度为零的是(C )(A) 3S; (B) 3P x(C) 3P z(D) 3d z26. 镧系收缩的后果之⼀是使下列⼀对元素性质相似的是(D )(A) Mn 和Tc (B) Ru 和Rh (C) Nd和Ta (D) Zr和Hf7. 下列各⾦属制容器中,能⽤来贮存汞的容器为(A )(A) 铁制(B) 铅制(C) 铜制(D) 锌制8. 熔融SiO2晶体时,需要克服的作⽤⼒主要是( C )(A) 离⼦键(B) 氢键(C) 共价键(D) 范德华⼒9. 下列化合物中肯定不存在的是( C )(A) BN (B) POCl3(C) NCl5(D) SiF410. 下列各氧化态的含氧酸中,酸性最强的是(A )(A) Ti (IV)(B) V (V)(C) Cr (VI) (D) Mn (VII)11. 当速率常数的单位为mol-1·dm3·s-1时,反应级数为(A)(A) ⼀级(B) ⼆级(C) 零级(D) 三级12. 下列物质中,能溶于硫化铵溶液的是()(A) SnS(B) SnS2(C) PtS (D) Bi2S313. 将0.1 mol·dm-3 下列溶液加⽔稀释1倍后,pH变化最⼩的是( D )(A) HCl(B) H2SO4(C) HNO3(D) HAc14. 空⽓中含有NO x、CO2、CH4、O3、含氟化物等等会引起光化学污染、空洞效应、温室效应等破坏环境的作⽤。
中国科学院研究生院2012年招收攻读硕士学位研究生入学统一考试试题科目名称:无机化学考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
一、选择题 ( 共20题,每题2分,共40分 )1.下列各氧化物中,金属的原子轨道中不存在单电子的是:(A) Mn 3O 4 (B) Fe 3O 4 (C) Pb 3O 4 (D) Cr 2O 32. 根据软硬酸碱理论,下列金属离子中,最软的酸是:(A) Zn 2+ (B) Ca 2+ (C) Mn 2+ (D) Ni 2+3.下列金属中,与汞不能生成汞齐合金的是:(A) Zn (B) Ag (C) Fe (D) Cu4. 主量子数n=4, m s =1/2时,可允许的最多电子数为:(A) 6 (B) 16 (C) 12 (D) 85. 下列叙述正确的是:(A) 在复合反应中,反应级数与反应分子数必定相等(B) 通常,反应活化能越小,反应速率常数越大,反应越快(C) 加入催化剂,使正反应和逆反应的活化能减小相同的倍数(D) 反应温度升高,活化分子数减低,反应加快6. 下列含氧酸盐中热稳定性最差的是:(A) K 2CO 3 (B) ZnCO 3 (C) CaCO 3 (D) Na 2CO 37. 下列离子半径从小到大顺序正确的是:(A) Li +< Na +< Mg 2+<F -<S 2- (B) Li +< F - < Na + < Mg 2+<S 2-(C) Li +< Na + < F -< S 2- < Mg 2+ (D) Li +< Mg 2+ < Na + < F -<S 2-8. 下列物种中,键角最小的是:(A) NO 2- (B) NO 2 (C) NO 2+ (D) N 2O9. H 2O 2既可作氧化剂又可作还原剂,下列叙述中错误的是:(A) H 2O 2可被氧化生成O 2 (B) H 2O 2可被还原生成H 2O(C) pH 变小,H 2O 2的还原性也增强 (D) pH 变小,H 2O 2的氧化性增强10. 在Y X 2208923292 的放射衰变中,发射出的α粒子和β粒子数为:(A) 3α和2β (B) 5α和3β (C) 5α和5β (D) 3α和3β11. 下列物质中, m f H 不等于零的是:(A) O(g) (B) Fe(s) (C) C(石墨) (D) Ne(g)12. 已知 ϕ(Cr 2O 72-/Cr 3+)> ϕ(Fe 3+/Fe 2+)> ϕ(Cu 2+/Cu)> ϕ(Fe 2+/Fe),则上述诸电对的各物种中最强的氧化剂和最强的还原剂分别为:(A) Cr 2O 72-,Fe 2+ (B) Fe 3+,Cu (C) Cr 2O 72-,Fe (D) Cu 2+,Fe 2+13. 关于V 2O 5的下列叙述中错误的是:(A)是酸性氧化物 (B)是无色晶体 (C)具有强氧化性 (D)可作为催化剂14. 室温下用CCl 4萃取I 2的分配系数D =2I C (CCl 4 )/2I C (H 2O), CCl 4萃取AtI 的分配系数D1=C AtI (CCl 4)/ C AtI (H 2O),则:(A) D>D1 (B) D<D1 (C) D=D1 (D)无法确定15. 对于常见分子筛的成分中,硅铝比越大,下列说法正确的是:(A) 耐酸性强,热稳定性差 (B) 耐酸性差,热稳定性差(C) 耐酸性强,热稳定性强 (D) 耐酸性差,热稳定性强16. 仅用一种试剂,即可将Ag +, Hg 2+, Zn 2+, Fe 3+ , Ni 2+ 五种离子区分开,这种试剂可选用:(A) H 2S (B) Na 2S (C) NaCl (D) NaOH17.锰的下列物种能在酸性溶液中发生歧化反应的是:(A) MnO 42- (B) MnO 2 (C) MnO 4- (D) Mn 2+18. 下列叙述错误的是:(A) Ce(OH)3在空气中易被氧化生成黄色的Ce(OH)4(B) Ce 4+的价电子构型为4f 0(C) 镧系元素草酸盐是难溶的(D) 钍和铀是人工放射性元素19. 下列混合物中,可以制成温度最低的制冷剂体系是:(A) 水+甘油 (B) 水+食盐 (C) 冰+氯化钙 (D)水+冰20. 对于下列基元反应 A + 2 B → C ,其速率常数为 k ,若某一个时刻(时间以 s 计)A 的浓度为 2 mol · L -1,B 的浓度为 3 mol · L -1,则反应速率 υ=:(A) 6k mol · L -1 · s -1 (B) 18k mol · L -1 · s -1(C) 12k mol · L -1 · s -1 (D) 36k mol · L -1 · s -1二、填空题 ( 共 5题,共30分 )21. (每空1分)相同温度,压力,体积下,两种气体(1,2)的摩尔质量分别为M 1和M 2(M 1>M 2)试比较,物质的量1 _____ 2,质量1_____ 2,平均动能1 _____ 2,平均速度 1 _____ 2,密度 1 _____ 2。
若体积增大,温度和压力保持不变,这种情况下密度 1 _____ 2。
22. (每空1分)根据价键理论,中心原子以sp 3杂化的配合物,配体数是____,空间结构是______,相同配体数的配合物的空间结构还可以是_______,其杂化轨道是_______ ;对于_______配体的配合物,空间结构可以是三角双锥,其中心原子的杂化轨道中d 轨道为_______, 相同配体数的配合物的空间结构也可以是 ________,其杂化轨道中d 轨道为_______。
23. (每空2分)白色固体A ,加入油状无色液体B ,可得紫黑色固体C ,C 微溶于水,加入A 后C 的溶解度增大,成棕色溶液D 。
将D 分成两份,一份加入一种无色溶液E ,另一份通入气体F ,都褪成无色透明溶液,E 溶液遇酸有淡黄色沉淀,将气体F 通入溶液E ,在所得的溶液中加入BaCl 2溶液有白色沉淀,后者难溶于酸。
那么结构式A ___,B 为浓硫酸,C___, D____, E___, F___。
24. (每空1分)共价键与离子键的最主要的区别是共价键有_____性和_____性,而离子键没有。
25. (每空1分)K 2Cr 2O 7溶液分别与BaCl 2,KOH ,浓HCl(加热)和H 2O 2(乙醚)作用将分别转换为______,______,______, ______。
三、计算题 ( 共 5题,共50分 )26 . (10分) 已知(l)H N 42H 汽化∆= 45 kJ · mol -1,(l)O H 22H 汽化∆= 51.5 kJ · mol -1, 键型 N -N N≡NO =O O -H N -H O -O 键能 E (kJ · mol -1) 159 943.5 498 464398 142 (1) 写出计算N 2H 4(l)+2H 2O 2(l)=N 2(g)+4H 2O(g)反应热的热力学循环图。
(2) 计算N 2H 4(l)+2H 2O 2(l)=N 2(g)+4H 2O(g)的反应热 m r H ∆。
27. (10分) 已知298K 时,PbS 的 SP K =3.4×10-28,H 2S 的 1K a =5.7×10-8, 2K a =1.2×10-15,下列反应的 m r G ∆= -473 kJ · mol -1 ,3 H 2S (aq) + 2 NO 3- (aq) + 2 H +(aq) = 2 NO (g) +4 H 2O (l ) + 3 S (s)(1)写出并配平PbS 与HNO 3反应的化学方程式;(2)计算PbS 与HNO 3反应的反应平衡常数K 。
28. (10分) 已知 恒温下d(ΔG)=ΔVdp 以及金刚石 石墨m H C∆(B,298K) kJ · mol -1 -395.3 -393.4m S (B,298K) J · K -1 · mol -1 2.435.69 ρ g · cm -3 3.513 2.260求(1)298K 时,由石墨转化为金刚石的 m r G ∆ (298K)(2)298K 时,由石墨转化为金刚石的最小压力。
此过程中,假设体积的变化值ΔV为常数。
29. (10分) 今有氢电极(氢气压力为100k Pa),该电极所用的溶液由浓度均为1 mol · L-1的弱酸(HA)及其钾盐(KA)所组成。
将此氢电极作为正极,与另一电极(E= -0.65V)作为负极,组成原电池。
测得其电动势E=0.38V。
试求该氢电极中的pH值及弱酸(HA)的解离常数各为多少。
30. (10分) 在无氧无水的环境中,金属钠与氢气反应生成氢化钠。
产品中除NaH 外,还有未反应的金属钠。
为了测定NaH的含量,先将一定质量的产品放入密闭测试系统,使其与水反应,生成NaOH和氢气。
在温度为22 o C,压力为99.47 kPa下,用排水集气法所得气体体积为56.60 mL。
然后,以0.1236 mol · L-1的HCl标准溶液滴定所得NaOH溶液,终点时,耗用V(HCl)=18.60 mL。
计算:(1)所得氢气的摩尔数;(2)计算产品中的NaH的含量。
已知:所有的气体都可以按理想气体处理。
22 o C时,p(H2O)=2.64 kPa。
四、问答题( 共5题,共30分)31.(10分)高温裂解的石墨是由碳原子层的层状结构堆积而成的,其晶体结构如下图所示,图中虚线标出了石墨晶体结构的单胞。
假设,层内碳原子的共价键长为a1,相邻的层状结构之间的距离为c1,那么请回答:(1)在石墨中碳原子的杂化方式以及为什么石墨具有高导电性;(2)请计算在石墨结构中每个单胞含有几个碳原子(要求写出计算公式);(3)请给出a与a1的关系,c与c1的关系。
32. (5分)KClO3固态受热,在360o C时出现一吸热过程,500 o C时出现一放热过程,580o C时再次放热并显著失重,770o C时又发生一吸热过程。
请加以解释。
33. (3分)什么是“镧系收缩”效应?34. (6分)假设某A元素的原子中,g 轨道刚开始被电子填充,请写出元素A 的电子排布方式,它的原子序数是多少?35. (6分)BF3中的B–F键和H3N BF3中的B–F键,哪一个短一些,为什么?(请将试卷与答题卷一同交回)2007年招收攻读硕士学位研究生入学考试试题试题名称丗无机化学。