高锰酸钾标准溶液的标定
- 格式:doc
- 大小:29.50 KB
- 文档页数:2

高锰酸钾标准溶液的配制与标定
高锰酸钾标准溶液是化学实验室常用的一种溶液,用于分析化学中的氧化还原
滴定。
正确的配制和标定高锰酸钾标准溶液对于实验结果的准确性至关重要。
本文将详细介绍高锰酸钾标准溶液的配制与标定方法。
1. 配制高锰酸钾标准溶液。
首先,准备所需的药品和仪器,高锰酸钾、硫酸、二甲苯、烧杯、容量瓶、磁
力搅拌器等。
其次,按照一定的比例将高锰酸钾溶解于水中,得到一定浓度的高锰酸钾溶液。
在此过程中需要注意高锰酸钾的溶解度,可以适当加热辅助溶解。
然后,将溶解后的高锰酸钾溶液定容至容量瓶刻度线下,摇匀后即得到高锰酸
钾标准溶液。
2. 标定高锰酸钾标准溶液。
首先,准备所需的药品和仪器,硫酸、氧化还原指示剂、已知浓度的氧化剂等。
其次,取一定量的氧化剂溶液,加入适量的硫酸和氧化还原指示剂,然后开始
滴定。
在滴定过程中,需要慢慢加入高锰酸钾标准溶液,直至溶液颜色发生明显改变,记录下滴定所需的高锰酸钾溶液的体积。
最后,根据滴定所需的高锰酸钾溶液的体积和氧化剂的已知浓度,可以计算出
高锰酸钾标准溶液的浓度。
3. 注意事项。
在配制和标定高锰酸钾标准溶液的过程中,需要注意以下几点:
药品的准确称量和溶解。
溶液的定容和摇匀。
滴定过程中的操作细节和记录准确。
结果的计算和验证。
总之,正确的配制和标定高锰酸钾标准溶液是化学实验中必不可少的步骤,只有严格按照标准操作,才能得到准确可靠的结果。
希望本文对您有所帮助,谢谢阅读。


高锰酸钾标准溶液的标定高锰酸钾标准溶液的标定一、目的本指南旨在详细说明高锰酸钾标准溶液的标定过程,包括准确称量试剂、溶解试剂并制备标准溶液、使用滴定法确定高锰酸钾的浓度、调整溶液至所需浓度、储存标准溶液并确保其稳定性、定期校准仪器以确保准确性,以及记录并分析数据以确保准确性。
二、操作步骤1.准确称量试剂首先,需要准确称量高锰酸钾试剂。
使用电子天平按照所需的量称取试剂。
建议使用差量法进行称量,以获得更精确的结果。
2.溶解试剂并制备标准溶液将称量好的高锰酸钾试剂溶解在水中,可以添加适量的硫酸来增强其溶解性。
将溶液转移至容量瓶中,定容至所需体积。
根据所需的浓度,计算出高锰酸钾的用量,并确保充分溶解。
3.使用滴定法确定高锰酸钾的浓度使用滴定法来确定高锰酸钾的浓度。
首先,需要配制一定浓度的亚铁氰化钠溶液作为反应介质。
然后,将待测溶液加入到反应介质中,用硫酸酸化的方式启动反应。
接着,用已知浓度的亚硝酸钠滴定液滴定,直到颜色变化且滴定终点确定。
最后,根据滴定的消耗体积计算出高锰酸钾的浓度。
4.调整溶液至所需浓度根据上述步骤得到的浓度值,调整高锰酸钾溶液的浓度至所需水平。
如果需要更高的浓度,可以增加高锰酸钾试剂的用量并重新溶解。
如果需要更低的浓度,可以稀释已溶解的溶液。
确保在整个过程中保持准确的浓度计量。
5.储存标准溶液并确保其稳定性将标定好的高锰酸钾标准溶液储存于密封的容器中,并存放在干燥、阴凉的地方。
确保在储存期间避免光照和温度变化,以保持其稳定性。
建议定期检查溶液的颜色和浓度变化,以确保其质量。
6.定期校准仪器以确保准确性在使用滴定法进行高锰酸钾标定的过程中,需要定期校准滴定管、容量瓶等仪器以确保准确性。
建议在使用前检查仪器的精度和使用状态,如有需要,及时进行校准和维修。
7.记录并分析数据以确保准确性在整个标定过程中,记录每一步的数据和结果,包括试剂称量、滴定消耗体积、计算结果等。
通过对数据的分析可以评估整个过程的准确性。

实验一高锰酸钾标准溶液的配制与标定一、实验目的1.了解KMnO4标准溶液的配制和保存条件。
2.了解自身指示剂和自动催化的原理。
3. 掌握用草酸钠作基准物标定高锰酸钾浓度的原理、方法及滴定条件。
二、实验原理(一)高锰酸钾标准溶液的配制:间接配制法(原因:高锰酸钾中含有二氧化锰等还原性杂质;高锰酸钾在水溶液中的自动分解;高锰酸钾见光易分解)配制步骤:1.称取稍多于理论计算量的高锰酸钾(如配制0.02mol/L溶液1L则需称取3.3~3.5g);2.用煮沸的冷却的蒸馏水溶解称好的高锰酸钾,以除去水中的还原性物质;3.将配好的高锰酸钾溶液煮沸,保持微沸1小时,然后放置2~3天,使溶液中的各种还原性全部与高锰酸钾反应完全;用微孔玻璃漏斗或古氏磁坩埚将溶液中的沉淀过滤去;配好的高锰酸钾溶液应于棕色瓶中暗处保存。
待标定。
(二)高锰酸钾标准溶液的标定:基准物法--以草酸钠用得最多。
1.标定原理:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O(自身批示剂)反应条件:(1)温度:75~85℃(2)酸度:0.5--1.0mol/LH2SO4(3)滴定速度:与自动催化反应相适应(先慢后快再慢)(4)终点:粉红色稳定30秒(4 KMnO4 + 6 H2SO4= 2K2SO4 + 4MnSO4 + 6H2O + 5O2↑)2.计算224422442(Na C O)10005(KMnO)(Na C O)(KMnO)mcM V创=´三、试剂与仪器仪器:分析化学实验常用仪器、烘干箱、称量瓶、电子天平、干燥器、水浴锅或电炉等;试剂:基准物Na2C2O4、3mol/L H2SO4溶液、KMnO4固体四、实验步骤(一)KMnO4标准溶液配制称取KMnO4固体1.0g于小烧杯中,用水分数次溶解(每次加水30mL溶解,复重操作直到完全溶解)后转移至500mL烧杯中,用水稀释至300mL。
转入棕色试剂瓶中,在暗处静置1~2后,过滤备用。

高锰酸钾标准溶液的标定目的1、熟练滴定操作技术。
2、了解高锰酸钾法的应用特点。
原理高锰酸钾法是经常应用的一种氧化还原滴定法,它以氧化剂高锰酸钾为标准溶液。
由于高锰酸钾是强的氧化剂,尤其在强酸性溶液中,氧化能力更强,同时由于高锰酸钾溶液呈深紫色,在水中着色能力很强,浓度很小时即可观察到显著的粉红色,所以滴定终点不必加入指示剂,稍过量的高锰酸钾即呈粉红色,可指示滴定终点的到达。
因此此法广泛用于许多还原性物质的测定,其应用范围较重铬酸钾法广。
但由于高锰酸钾性质不稳定,容易分解,不容易得到很纯的试剂,所以必须用间接法配制标准溶液,一般在制备高锰酸钾标准溶液时,需加热近沸约30min,以充分氧化水中的有机杂质,并静置过夜,再除去生成的沉淀,同时保存在棕色小口瓶中避免光照,以保持溶液浓度相对稳定,不致迅速氧化。
然后再用基准物质标定其准确浓度。
标定高锰酸钾溶液的基准物质有H2C2O4·2 H2O、FeS O4·7H2O、(NH4)2S O4·6H2O、As2O3和纯铁丝等。
由于前两者较易纯化,所以在标定高锰酸钾时经常采用。
本实验采用Na2C2O4标定预先配好的浓度近0.02mol/L KMnO4溶液,两者反应方程式如下:2KMnO4+8H2SO4+5Na C2O4= 2MnSO4+10CO2 +5Na2SO4+2K2SO4+8H2O 直接称取一定质量的Na2C2O4,用少量蒸馏水溶解后,以待标定的高锰酸钾溶液滴定至终点,按如下计算式计算高锰酸钾溶液的准确浓度:2×m(Na2C2O4)×1000c(KMnO4)= ---------------------------------5×M(Na2C2O4)×V(KMnO4)式中c(KMnO4) ----- 高锰酸钾的准确浓度(mol/L);m(Na2C2O4) ----- 所称草酸钠的质量(g)M(Na2C2O4) ----- 所称草酸钠的摩尔质量(g/mol)V(KMnO4) ----- 所用高锰酸钾的体积(ml)仪器及药品仪器:分析天平、称量瓶、酸式滴定管、锥形瓶、量筒。

一、实验目的1. 掌握高锰酸钾标准溶液的配制方法和保存条件。
2. 掌握采用草酸钠作基准物标定高锰酸钾标准溶液的方法。
3. 了解高锰酸钾在氧化还原滴定中的应用。
二、实验原理高锰酸钾(KMnO4)是一种常用的氧化剂,在酸性条件下,其氧化性更强。
本实验通过滴定法,用草酸钠(Na2C2O4)作为基准物质,标定高锰酸钾溶液的浓度。
反应方程式如下:2MnO4- + 5C2O42- + 16H+ → 2Mn2+ + 10CO2↑ + 8H2O三、实验仪器与试剂1. 仪器:酸式滴定管、锥形瓶、移液管、烧杯、电子天平、温度计、电炉等。
2. 试剂:高锰酸钾(A.R.)、草酸钠(基准试剂)、3 mol/L硫酸溶液、1 mol/L MnSO4溶液。
四、实验步骤1. 配制0.02 mol/L的高锰酸钾溶液:称取1.0 g高锰酸钾固体,置于500 mL烧杯中,加入250 mL蒸馏水,用玻璃棒搅拌溶解。
将溶液加热至微沸,保持微沸1小时,然后过滤除去杂质。
将滤液转移至500 mL棕色试剂瓶中,冷却至室温,用蒸馏水定容至500 mL,摇匀。
2. 标定高锰酸钾溶液浓度:(1)称取0.15 g草酸钠固体,置于锥形瓶中,加入20 mL蒸馏水溶解。
(2)加入10 mL 3 mol/L硫酸溶液,混匀。
(3)将配制好的高锰酸钾溶液滴定至锥形瓶中,每加入一滴溶液,摇匀。
(4)观察溶液颜色变化,当溶液由无色变为浅红色时,停止滴定。
(5)记录消耗的高锰酸钾溶液体积。
3. 计算高锰酸钾溶液的浓度:根据草酸钠的质量和滴定消耗的高锰酸钾溶液体积,计算高锰酸钾溶液的浓度。
五、实验数据与结果1. 高锰酸钾溶液的浓度:C(KMnO4) = 0.0200 mol/L2. 草酸钠的质量:m(Na2C2O4) = 0.1500 g3. 滴定消耗的高锰酸钾溶液体积:V(KMnO4) = 20.00 mL六、实验讨论与分析1. 实验过程中,高锰酸钾溶液加热微沸1小时,目的是去除溶液中的还原性杂质,保证滴定结果的准确性。

高锰酸钾的标准溶液的标定
高锰酸钾是一种常用的氧化剂,广泛应用于化学分析和工业生产中。
在实验室中,我们经常需要使用高锰酸钾的标准溶液来进行定量分析。
而为了确保实验结果的准确性,我们需要对高锰酸钾的标准溶液进行标定,以确定其精确浓度。
本文将介绍高锰酸钾标准溶液的标定方法及步骤。
首先,准备工作。
在进行高锰酸钾标准溶液的标定之前,我们需要准备好所需
的试剂和仪器设备。
主要包括高锰酸钾、硫酸、氧化还原指示剂、容量瓶、分析天平、移液管等。
同时,要确保实验室环境清洁整洁,以避免外界因素对实验结果的影响。
其次,标定步骤。
首先,取一定量的高锰酸钾溶液,加入适量的硫酸,将其还
原为无色的Mn2+离子。
然后,用氧化还原指示剂滴定至溶液变色,记录消耗的滴
定液体积。
根据滴定反应的化学方程式,可以计算出高锰酸钾的浓度。
最后,重复实验至结果一致,取平均值作为最终的标定结果。
最后,结果分析。
通过上述标定步骤,我们可以得到高锰酸钾的标准溶液的精
确浓度。
这个浓度值将成为我们后续定量分析实验的重要依据,确保实验结果的准确性和可靠性。
同时,标定结果也可以帮助我们评估高锰酸钾溶液的质量和稳定性,及时发现和解决溶液存在的问题。
总之,高锰酸钾的标准溶液的标定是化学分析实验中的重要环节,直接关系到
实验结果的准确性和可靠性。
通过严格的标定步骤和精确的实验操作,我们可以得到高质量的标准溶液,并为后续的定量分析实验奠定坚实的基础。
希望本文介绍的标定方法能对相关实验工作提供帮助,确保实验结果的准确性和可靠性。


高锰酸钾标准溶液的配制和标定
高锰酸钾标准溶液是常用标准溶液之一,其pH值通常在10.0以上,在很多污染检测中都有重要作用。
标准溶液的配制和标定可以帮助实验室快速准确地进行污染检测,因此技术人员要具备良好的实验技能。
标准溶液的配制和标定程序可分为以下几步:
1.准备所需的试剂,包括精确称取的高锰酸钾和标准品,以及高纯水;
2.将试剂按照配比摩尔比或制得的质量分数稀释到恰当的浓度,量取的体积取决于最终使用的比色片的容量大小;
3. 用高纯水稀释至0.5 mol/L,并调整溶液的pH值为10.0。
1.用三种不同浓度的标准溶液进行标定,标准液分别为1.00、
2.00、
3.00 mol/L;
2. 准备三种不同浓度的、以及同一批次的比色片,核对标签的比色片的线性浓度梯度;
3.将1.00 mol/L的标准溶液倒入已核对比色片的1 cm2容积位置,振荡搅拌近乎平面比色,比色片上1 cm2位置应能够准确地测量出其pH值和比色强度;
4.重复上述步骤,同时测量其余两种浓度的比色结果,得出线性比色曲线;
5. 根据该线性比色曲线,将实际需要用到的高锰酸钾测量标定成其对应的pH值和比色强度。
以上便是高锰酸钾标准溶液的配制和标定的实验程序。
从上述操作步骤来看,实验人员在进行标准溶液的配制和标定前,应该提前准备好仪器和试剂,严格按照步骤操作,确保最终得到的标准溶液的浓度和pH值的准确性,使用它们进行检查时,能取得精确准确的测量结果。
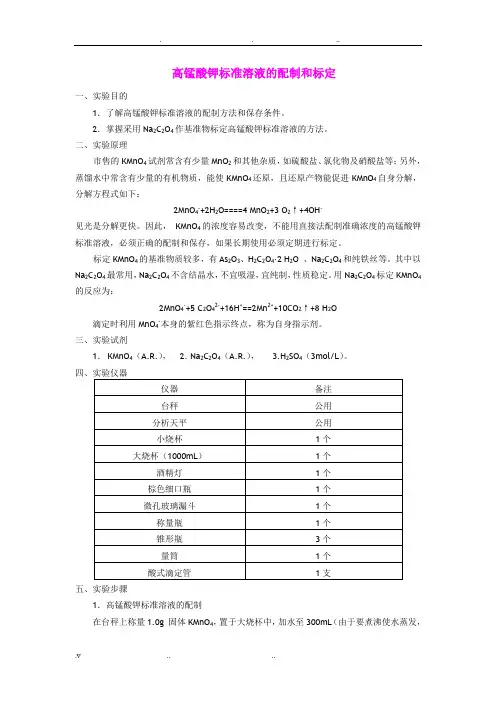
高锰酸钾标准溶液的配制和标定一、实验目的1.了解高锰酸钾标准溶液的配制方法和保存条件。
2.掌握采用Na2C2O4作基准物标定高锰酸钾标准溶液的方法。
二、实验原理市售的KMnO4试剂常含有少量MnO2和其他杂质,如硫酸盐、氯化物及硝酸盐等;另外,蒸馏水中常含有少量的有机物质,能使KMnO4还原,且还原产物能促进KMnO4自身分解,分解方程式如下:2MnO4-+2H2O====4 MnO2+3 O2↑+4OH-见光是分解更快。
因此,KMnO4的浓度容易改变,不能用直接法配制准确浓度的高锰酸钾标准溶液,必须正确的配制和保存,如果长期使用必须定期进行标定。
标定KMnO4的基准物质较多,有As2O3、H2C2O4·2 H2O 、Na2C2O4和纯铁丝等。
其中以Na2C2O4最常用,Na2C2O4不含结晶水,不宜吸湿,宜纯制,性质稳定。
用Na2C2O4标定KMnO4的反应为:2MnO4-+5 C2O42-+16H+==2Mn2++10CO2↑+8 H2O滴定时利用MnO4-本身的紫红色指示终点,称为自身指示剂。
三、实验试剂1.KMnO4(A.R.), 2. Na2C2O4(A.R.), 3.H2SO4(3mol/L)。
五、实验步骤1.高锰酸钾标准溶液的配制在台秤上称量1.0g 固体KMnO4,置于大烧杯中,加水至300mL(由于要煮沸使水蒸发,可适当多加些水),煮沸约1小时,静置冷却后用微孔玻璃漏斗或玻璃棉漏斗过滤,滤液装入棕色细口瓶中,贴上标签,一周后标定。
保存备用。
2.高锰酸钾标准溶液的标定用Na2C2O4溶液标定KMnO4溶液准确称取0.13~0.16g基准物质Na2C2O4三份,分别置于250mL的锥形瓶中,加约30mL 水和3mol·L-1H2SO410mL,盖上表面皿,在石棉铁丝网上慢慢加热到70~80℃(刚开始冒蒸气的温度),趁热用高锰酸钾溶液滴定。
开始滴定时反应速度慢,待溶液中产生了Mn2+后,滴定速度可适当加快,直到溶液呈现微红色并持续半分钟不褪色即终点。

高锰酸钾标准溶液的配制和标定一、实验目的。
本实验旨在掌握高锰酸钾标准溶液的配制和标定方法,以及了解其在化学分析中的应用。
二、实验原理。
1. 高锰酸钾标准溶液的配制。
高锰酸钾标准溶液的配制一般采用称量法或稀释法。
其中,称量法是将一定质量的高锰酸钾溶解于水中,配制成一定容积的标准溶液;稀释法是将高浓度的高锰酸钾溶液逐步稀释至一定浓度。
2. 高锰酸钾标准溶液的标定。
高锰酸钾标准溶液的标定一般采用还原法。
将一定量的含氧还原剂(如氧化亚铁溶液)逐渐加入高锰酸钾标准溶液中,直至产生淡粉色的终点。
三、实验步骤。
1. 高锰酸钾标准溶液的配制。
(1)称量法,取一定质量的高锰酸钾溶解于水中,配制成一定容积的标准溶液。
(2)稀释法,将高浓度的高锰酸钾溶液逐步稀释至一定浓度。
2. 高锰酸钾标准溶液的标定。
(1)准备含氧还原剂,称取一定质量的氧化亚铁溶液。
(2)标定高锰酸钾标准溶液,将氧化亚铁溶液逐渐加入高锰酸钾标准溶液中,直至产生淡粉色的终点。
四、注意事项。
1. 配制高锰酸钾标准溶液时,应注意溶解度和溶液的稳定性,避免溶液浓度不准确。
2. 在标定高锰酸钾标准溶液时,应注意还原剂的加入速度,避免产生误差。
3. 实验操作中应注意安全,避免高锰酸钾的接触和吸入,避免产生危险。
五、实验结果记录与分析。
根据实验操作所得数据,计算出高锰酸钾标准溶液的浓度,并分析实验误差。
六、实验结论。
通过本次实验,我们成功掌握了高锰酸钾标准溶液的配制和标定方法,了解了其在化学分析中的应用,为日后的实验操作提供了基础和经验。
七、参考文献。
[1] 《化学实验技术与方法》,XXX,XXX出版社,2010。
[2] 《高等学校化学实验教程》,XXX,XXX出版社,2008。
以上就是高锰酸钾标准溶液的配制和标定的文档内容,希望对您有所帮助。
高锰酸钾标准溶液的配制和标定在实验室里,配制和标定高锰酸钾标准溶液就像做一道美味的菜,讲究的是材料、火候和手法。
首先,我们得知道高锰酸钾是什么。
它是一种紫色晶体,广泛用于化学分析中,特别是作为氧化剂。
在日常生活中,它也被用作消毒剂,简直是个“万金油”。
好,接下来就让我们一起动手,把这道“菜”做出来吧!1. 材料准备1.1 高锰酸钾晶体首先,我们需要准备高锰酸钾的晶体。
别小看这些小小的紫色颗粒,它们可是不容小觑的哦。
想象一下,它们就像是厨房里的调味料,缺了它们,整个实验就没有味道了。
我们通常会需要一定质量的高锰酸钾,具体要多少呢?这得根据你的实验要求来定,但一般在几克之间,具体的量可以用天平称出来,切忌“一言堂”,记得量好每一克。
1.2 溶剂与器具除了高锰酸钾,我们还需要蒸馏水来作为溶剂。
对,没错,就是那种清澈见底的水,只有它才能将高锰酸钾完美溶解。
再来,别忘了量筒、烧杯、玻璃棒等实验器具,这些可是我们配制过程中不可或缺的“好帮手”。
记得检查这些器具是不是干净哦,脏的器具会影响实验结果,就像做菜前要洗干净锅一样。
2. 配制标准溶液2.1 溶解高锰酸钾现在,咱们开始配制溶液。
首先,把称好的高锰酸钾晶体放入烧杯中,接着缓缓加入蒸馏水。
这里有个小技巧,就是要边加水边搅拌,确保高锰酸钾完全溶解。
这就像是搅拌汤一样,要搅拌得均匀才行。
等到水面呈现出漂亮的紫色,嘿,恭喜你,你的高锰酸钾溶液就做好啦!可别急着用,咱们还要标定呢。
2.2 标定溶液浓度标定是一个关键步骤,关系到你后续实验的准确性。
我们通常用一些标准物质,比如亚硫酸钠,来进行滴定。
首先,取一定量的亚硫酸钠溶液,加入滴定管中,接着慢慢往高锰酸钾溶液里滴。
随着颜色的变化,你要时刻观察,滴到颜色刚好由紫色变成无色时,就是终点。
这一步可要小心谨慎,不然可就前功尽弃了。
3. 实验注意事项3.1 安全第一在整个配制和标定的过程中,安全是第一位的。
高锰酸钾虽然很好用,但它的氧化性也很强,处理时一定要佩戴好手套和护目镜,保护好自己。
高锰酸钾溶液的标定一、基本原理高锰酸钾法是在强酸性溶液中以高锰酸钾为滴定液直接或间接的测定还原或氧化性物质含量的滴定方法。
反应条件控制:以高锰酸钾滴定草酸钠为例离子反应方程式:2MnO4-+5C2O42-+16H+→2 Mn 2++10CO2+ 8 H20(1)酸度:高锰酸钾法只能在强酸性溶液中进行,以充分发挥其氧化能力。
酸度一般控制在0.5~1mol/L,以硫酸为宜(硝酸有氧化性,盐酸有还原性,容易发生副反应)(2)反应速度:A、草酸钠溶液与高锰酸钾常温下反应较慢,加热可加快反应速度。
B、加入硫酸锰的溶液后,红色褪去速度加快。
原因:Mn2+在反应中起催化剂作用而使反应速度加快。
结论:有些物质和高锰酸钾在常温下反应速度较慢,可用两种方法加快反应速度a、可采用加热后趁热滴定的方法,但对于在空气中易氧化或加热易分解的还原性物质如亚铁盐、过氧化氢则不能加热。
b、可采用加Mn2+(催化剂)的方法。
用高锰酸钾滴定还原性物质时,即使在加热情况下,滴定之初反应也较慢,但随滴定液的加人,反应逐步加快。
这是因为随着氧化还原反应进行,溶液中生成的Mn2+不断增加,Mn2+在反应中起催化剂作用而使反应速度加快。
(3)指示剂:高锰酸钾滴定液滴定无色或浅色溶液时,一般不需另加指示剂,这种以滴定液本身的颜色变化指示终点的方法称为自身指示剂法。
二、高锰酸钾滴定液的配制和标定1、向水浴锅中加好水,温度调至85℃备用。
2、高锰酸钾滴定液(0.02mol/L)的配制市售高锰酸钾常含有少量MnO2等杂质,蒸馏水也常有微量的灰尘,溶液在配制初期不够稳定,浓度常降低,因此高锰酸钾溶液不能用直接法配制,所以先配制成近似所需的浓度。
方法:称取稍多于理论用量的固体高锰酸钾,用新煮沸并冷却的蒸馏水溶解,放置两天以上或加热至沸,并保持微沸15min ,使各种还原性物质完全氧化,用垂熔玻璃器过滤,除去MnO 2等沉淀,摇匀,储存于棕色瓶中,暗处密闭保存。
举例:配置0.06mol/L的标准高锰酸钾溶液及其标定一、0.06mol/L高锰酸钾的配置在电子天平上准确称取高锰酸钾9.4818g(注意药品的含量,一般大于99.9%),溶于1000ml水中。
配制时的注意事项:1、称取时高锰酸钾的质量可稍多于理论值9.4818g,因为在配制的过程中可能损失掉一部分。
2、配置好的高锰酸钾溶液需要加热煮沸,并保持微沸1小时,然后放置2-3天,以待标定。
(目的时为了使引入的还原性物质完全氧化)3、标定前,需要用砂芯漏斗过滤,除去里面被氧化的沉淀。
4、在保存时,必须贮存于棕色瓶中,并放在阴暗处,避免阳光照射分解。
二、高锰酸钾的标定标定时的注意事项:1、标定高锰酸钾常用的基准物质有草酸钠、氧化砷、草酸的结晶水合物。
(其中草酸钠最好,因为其容易提纯,性质稳定,不含结晶水,在使用前,需要在105℃-110℃干燥恒重。
2、温度的控制:在室温下,标定过程反应缓慢,因此常将溶液水浴加热至70-85℃时滴定。
3、酸度的控制:一般酸度控制在0.5-1mol/L,酸度过低时,高锰酸钾分解为二氧化锰,酸度过高时,草酸分解。
4、催化剂的控制:二价锰离子(刚开始滴定时慢一些,让其充分生成二价锰离子,然后可以加快滴定速度)5、指示剂:高猛酸价本身的颜色(注:当配制的高锰酸钾浓度小于0.02mol/L时,应加入二苯磺酸钠做指示剂)三、高锰酸钾的标定过程(0.06mol/L)2 MnO4- + 5 C2O4- +16H+ =2Mn2+ + 10CO2↑+ 8H2O称取经过105℃干燥恒重的草酸钠0.4g放入100ml烧杯,加入50ml超纯水在超声的条件下使其完全溶解,然后加入1:1硫酸5ml,充分混合后转移至250ml锥形瓶,75℃水浴5分钟后,趁热标定即可。
标定时:开始应该先加入1滴高锰酸钾,指示溶液瞬间变红,并很长时间不褪色,这时应充分振荡是其褪色后,在加入1滴高锰酸钾,继续振荡至其褪色,直到滴入高锰酸钾后很快的变为无色透明后,可以加快滴定速度。
高锰酸钾标准溶液的标定目的1、熟练滴定操作技术。
2、了解高锰酸钾法的应用特点。
原理高锰酸钾法是经常应用的一种氧化还原滴定法,它以氧化剂高锰酸钾为标准溶液。
由于高锰酸钾是强的氧化剂,尤其在强酸性溶液中,氧化能力更强,同时由于高锰酸钾溶液呈深紫色,在水中着色能力很强,浓度很小时即可观察到显著的粉红色,所以滴定终点不必加入指示剂,稍过量的高锰酸钾即呈粉红色,可指示滴定终点的到达。
因此此法广泛用于许多还原性物质的测定,其应用范围较重铬酸钾法广。
但由于高锰酸钾性质不稳定,容易分解,不容易得到很纯的试剂,所以必须用间接法配制标准溶液,一般在制备高锰酸钾标准溶液时,需加热近沸约30min,以充分氧化水中的有机杂质,并静置过夜,再除去生成的沉淀,同时保存在棕色小口瓶中避免光照,以保持溶液浓度相对稳定,不致迅速氧化。
然后再用基准物质标定其准确浓度。
标定高锰酸钾溶液的基准物质有H2C2O4·2 H2O、FeS O4·7H2O、(NH4)2S O4·6H2O、As2O3和纯铁丝等。
由于前两者较易纯化,所以在标定高锰酸钾时经常采用。
本实验采用Na2C2O4标定预先配好的浓度近0.02mol/L KMnO4溶液,两者反应方程式如下:2KMnO4+8H2SO4+5Na C2O4= 2MnSO4+10CO2 +5Na2SO4+2K2SO4+8H2O 直接称取一定质量的Na2C2O4,用少量蒸馏水溶解后,以待标定的高锰酸钾溶液滴定至终点,按如下计算式计算高锰酸钾溶液的准确浓度:2×m(Na2C2O4)×1000c(KMnO4)= ---------------------------------5×M(Na2C2O4)×V(KMnO4)式中c(KMnO4) ----- 高锰酸钾的准确浓度(mol/L);m(Na2C2O4) ----- 所称草酸钠的质量(g)M(Na2C2O4) ----- 所称草酸钠的摩尔质量(g/mol)V(KMnO4) ----- 所用高锰酸钾的体积(ml)仪器及药品仪器:分析天平、称量瓶、酸式滴定管、锥形瓶、量筒。
高锰酸钾的标定
一、概述
高锰酸钾(Potassium permanganate)是一种强氧化剂,其分子式为KMnO4,其可以用于氧化硫化氢、有机物和水中的有机物,并且有很好的杀菌和消毒作用,因此常被用于水处理、空气消毒、清洗剂中等。
应用于各种工业条件中,要求高锰酸钾有一定的纯度,一般的纯度规格为干燥基准(干燥无水)水份≤ 0.1%,氧化锰含量≥
98.0%,灼烧残渣≤ 0.02%。
为了保证纯度,必须对高锰酸钾进行标定。
二、标定原理
高锰酸钾标定的一般原理是通过电位法,用一定的溶液,将高锰酸钾的氧化锰含量确定下来,从而确定纯度。
电位法的具体步骤如下:
1. 用盐酸配制一个易变色的电位指示剂溶液,指示剂用的通常是对硝酸酚酞;
2. 用KMnO4溶液滴定指示剂溶液,直至指示剂的颜色变为标准色;
3. 然后用标定指示剂溶液测得KMnO4溶液的电位,当电位恒定(称为标定电位),就可以用它来测定某一KMnO4溶液的氧化锰含量。
三、标定结果判定
标定结果以标定电位和电位指示剂溶液的剂量和颜色变化为准,根据已知的电位和指示剂剂量,通过查表法得出KMnO4溶液的氧化锰
含量,从而得出高锰酸钾的纯度。
四、注意事项
1. 使用时需要注意高锰酸钾的毒性和腐蚀性,并且采用有效的防护措施;
2. 高锰酸钾的标定过程中要求温度和电位都保持不变;
3. 标定结果以电位指示剂溶液的剂量和颜色为准,颜色应当尽可能的相等;
4. 试剂要求精密至 0.02%,并且要确保试剂的精密性。
高锰酸钾标准溶液的标定
目的
1、熟练滴定操作技术。
2、了解高锰酸钾法的应用特点。
原理
高锰酸钾法是经常应用的一种氧化还原滴定法,它以氧化剂高锰酸钾为标准溶液。
由于高锰酸钾是强的氧化剂,尤其在强酸性溶液中,氧化能力更强,同时由于高锰酸钾溶液呈深紫色,在水中着色能力很强,浓度很小时即可观察到显著的粉红色,所以滴定终点不必加入指示剂,稍过量的高锰酸钾即呈粉红色,可指示滴定终点的到达。
因此此法广泛用于许多还原性物质的测定,其应用范围较重铬酸钾法广。
但由于高锰酸钾性质不稳定,容易分解,不容易得到很纯的试剂,所以必须用间接法配制标准溶液,一般在制备高锰酸钾标准溶液时,需加热近沸约30min,以充分氧化水中的有机杂质,并静置过夜,再除去生成的沉淀,同时保存在棕色小口瓶中避免光照,以保持溶液浓度相对稳定,不致迅速氧化。
然后再用基准物质标定其准确浓度。
标定高锰酸钾溶液的基准物质有 H
2C
2
O
4
·2 H
2
O、FeS O
4
·7H
2
O、(NH
4
)
2
S O
4
·6H
2
O、
As
2O
3
和纯铁丝等。
由于前两者较易纯化,所以在标定高锰酸钾时经常采用。
本实验采用Na
2
C
2
O
4
标定预先配好的浓度近0.02mol/L KMnO
4
溶液,两者反应方
程式如下:
2KMnO
4+8H
2
SO
4
+5NaC
2
O
4
= 2MnSO
4
+10CO
2
+5Na
2
SO
4
+2K
2
SO
4
+8H
2
O
直接称取一定质量的Na
2C
2
O
4
,用少量蒸馏水溶解后,以待标定的高锰酸钾溶
液滴定至终点,按如下计算式计算高锰酸钾溶液的准确浓度:
2×m(Na
2C
2
O
4
)×1000
c(KMnO
4
)= ---------------------------------
5×M(Na
2C
2
O
4
)×V(KMnO
4
)
式中c(KMnO
4
) ----- 高锰酸钾的准确浓度(mol/L);
m(Na
2C
2
O
4
) ----- 所称草酸钠的质量(g)
M(Na
2C
2
O
4
) ----- 所称草酸钠的摩尔质量(g/mol)
V(KMnO
4
) ----- 所用高锰酸钾的体积(ml)
仪器及药品
仪器:分析天平、称量瓶、酸式滴定管、锥形瓶、量筒。
药品:0.02mol/L KMnO
4溶液,草酸钠(分析纯),3 mol/L H
2
SO
4
等;
内容及步骤
准确称取0.13-0.15g预先已干燥过的分析纯草酸钠三份,分别置于锥形瓶
中,各加入40ml蒸馏水和10ml3 mol/L H
2SO
4
,使草酸钠溶解,慢慢加热,直到有
蒸汽冒出(75-85℃)。
趁热用待标定的KMnO
4
溶液进行滴定,开始时,速度要慢,
滴入第一滴溶液后,不断摇动锥形瓶,使溶液充分混合反应,当紫红色褪去后再滴入第二滴。
当溶液中有Mn2+(催化剂)产生后,反应速度会加快,滴定速度也可随之加快,但仍需按照滴定规则进行。
接近终点时,紫红色退去很慢,此时,
应该减慢滴定速度,同时充分摇匀,以防滴过终点。
最后滴加半滴KMnO
4
溶液
摇匀后30s内不褪色即为达到终点。
记下读数,计算KMnO
溶液的准确浓度。
4
1、本次实验的滴定速度为什么是先慢、再快、后又慢的变化过程?
2、通过实验,你能比较一下高锰酸钾法和重铬酸钾法的优缺点。
3、
4、
5、
6、
(注:素材和资料部分来自网络,供参考。
请预览后才下载,期待你的好评与关注!)
7、
8、
9、。