实验八 对甲苯磺酸钠的制备
- 格式:doc
- 大小:35.00 KB
- 文档页数:2
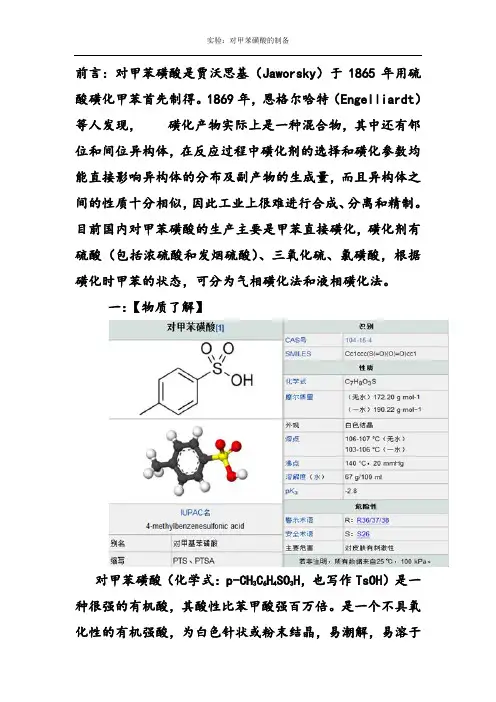
前言:对甲苯磺酸是贾沃思基(Jaworsky)于1865年用硫酸磺化甲苯首先制得。
1869年,恩格尔哈特(Engelliardt)等人发现,磺化产物实际上是一种混合物,其中还有邻位和间位异构体,在反应过程中磺化剂的选择和磺化参数均能直接影响异构体的分布及副产物的生成量,而且异构体之间的性质十分相似,因此工业上很难进行合成、分离和精制。
目前国内对甲苯磺酸的生产主要是甲苯直接磺化,磺化剂有硫酸(包括浓硫酸和发烟硫酸)、三氧化硫、氯磺酸,根据磺化时甲苯的状态,可分为气相磺化法和液相磺化法。
一:【物质了解】对甲苯磺酸(化学式:p-CH3C6H4SO3H,也写作TsOH)是一种很强的有机酸,其酸性比苯甲酸强百万倍。
是一个不具氧化性的有机强酸,为白色针状或粉末结晶,易潮解,易溶于碳化。
这种酸的独特之处是,它在通常情况下为固体,方便称用。
它的另一个优势是,与一些无机强酸相比没有氧化性,可以在一些情况下替代无机强酸。
二:【对甲苯磺酸的主要应用】①催化剂在范围很广的反应中,包括醇化、生成缩醛、脱水、烷基化、脱烷基、贝克曼重排、聚合和解聚反应,它像硫酸一样有效,但效果比硫酸好因为它不会引起氧化或结炭等副反应,所以得到的产物纯度高,颜色浅。
②有机合成常用对甲苯磺酸制造对甲苯磺酰胺、糖精、氯胺T、对甲苯磺酰氯和对砜二氯酰胺等。
对甲苯磺酸的最大用途是用于生产对甲酚。
③稳定剂在工业上,常用对甲苯磺酸和氧化锌制备对甲苯磺酸锌。
在丙烯腈和丙烯酸甲酯或丙烯腈和偏二氯乙烯共聚过程中,可使用对甲苯磺酸锌作为稳定剂,其用量可达0.2%。
对甲苯磺酸还可用于酚醛、环氧和氨基塑料、家具滑漆、染料、粘合剂、合成抗糖尿病医药及电镀槽的防应力添加剂等方面,催化醇上二氢呋喃保护基;羧酸酯化;酯交换反应;使醛生成缩醛,等等。
随着以二甲基甲酰胺为溶剂的一步法腈氯纶和腈纶装置的引进,作为稳定的高质量对甲苯磺酸的需求量,正在迅速增长。
三:【对甲苯磺酸的主要合成方法】❶三氧化硫磺化法,❷氯磺酸磺化法,❸对甲苯磺酰氨水解法,❹硫酸磺化法①三氧化硫磺化法理论上,三氧化硫是最有效的磺化剂,因为只是直接的加成而不用脱除反应生成的水。

实验八对甲苯磺酸钠的制备【实验目的】1.了解芳香族化合物磺化的基本原理、方法及反应温度的影响。
2.进一步熟悉回流、减压过滤、重结晶等基本操作。
【实验的准备】仪器:圆底烧瓶(100 ml 1个);球形冷凝管(1 支);水银温度计(250℃ 1支);烧杯(250 ml、800 ml各1个);吸滤瓶;布氏漏斗;电动搅拌器。
药品:甲苯 14 g 16 ml (0.15 mol);浓硫酸(98 %) 11 ml (0.02 mol);碳酸氢钠 7 g;精盐 23 g;活性炭。
【物理常数】【仪器安装要点】1.以热源为基准,按教材p31图1.18-(1)安装仪器。
2.安装时应注意以下几点:(1)搅拌器的轴、搅拌棒及三颈烧瓶的轴心应在同一直线上。
(1)搅拌棒和紧套在温度计套管上的橡皮管之间用少许甘油或凡士林润滑。
(3)支撑仪器的所有夹子必须旋紧,以保证仪器不承受任何压力和扭力。
(4)搅拌前,用手转动搅拌器,看其启动是否灵活,是否碰撞器壁或温度计。
【操作要点】1.反应温度严格在100~120℃之间;回流速度以2~3滴/min为宜。
2.反应终点的控制:甲苯层消失表明反应已经结束,大约20 min左右。
3.加NaHCO3中和部分酸液时,应分批、在不断搅拌下加入,以防产生大量的CO2气泡逸出烧杯。
4.趁热过滤时,吸滤瓶和布氏漏斗要充分预热。
滤液要自然冷却。
【本实验的成败关键】反应温度的控制和反应终点的判断。
(注:本资料素材和资料部分来自网络,仅供参考。
请预览后才下载,期待您的好评与关注!)。

对甲苯磺酸钠的制备
甲苯磺酸钠是一种重要的有机化合物,在医药、染料、柔和剂
等领域都有广泛的应用。
因此,其制备技术也备受关注。
本文将
对甲苯磺酸钠的制备方法进行分析和讨论。
首先,甲苯磺酸钠的制备方法有很多,其中以苯甲酸和硫酸为
原料经过酸化反应制备的方法应用较为广泛。
以这种方法为例,
具体的制备流程如下:
首先,将苯甲酸加入浓磷酸中,加热至大约70℃,反应3h。
接着,将其室温下降温,随后加入冷却后的浓硫酸搅拌1h。
然后,将该混合物过滤,收集沉淀后,用少量的水洗涤并风干,得到甲
苯磺酸钠。
需要注意的是,在制备过程中应控制反应温度和时间,以确保
反应得到高产率和优质产物。
此外,除了酸化反应法,还有氧化反应法、直接磺化法等其他
制备甲苯磺酸钠的方法。
这些方法各有优缺点,可以根据实际情
况选择合适的方法。
另外,甲苯磺酸钠的纯度和形态也对其应用性有很大影响。
为了得到高纯度的甲苯磺酸钠,可以通过浸提、结晶等方法进行提纯。
此外,对于产物形态的控制,可以按照实际需要进行调节。
总的来说,甲苯磺酸钠的制备技术在不断改进和完善,针对不同的应用领域也有着不同的要求。
因此,在实际制备中需要根据具体情况选择合适的方法,同时对产物的纯度和形态进行控制,以满足不同需求。
![一种废硫酸制备对甲苯磺酸钠的环保生产方法[发明专利]](https://uimg.taocdn.com/5687320e856a561253d36f82.webp)
专利名称:一种废硫酸制备对甲苯磺酸钠的环保生产方法专利类型:发明专利
发明人:王力立,刁正坤,刘萍,徐晓江
申请号:CN201710085014.1
申请日:20170217
公开号:CN106748900A
公开日:
20170531
专利内容由知识产权出版社提供
摘要:本发明公开了一种废硫酸制备对甲苯磺酸钠的环保生产方法,包括以下步骤:(1)将废硫酸浓缩至硫酸重量百分浓度大于70%,然后按照甲苯与硫酸的重量比为1.2‑2.0:1的比例加入甲苯,加热到100‑160℃反应,得到对甲苯磺酸;(2)将含对甲苯磺酸的溶液与氢氧化钠水溶液进行中和反应,得到对甲苯磺酸钠;(3)将含对甲苯磺酸钠的溶液经过活性炭脱色、结晶分离、干燥后得到对甲苯磺酸钠产品。
本发明不仅解决了废硫酸难以处理的问题,更为对甲苯磺酸钠制备工艺提供了新思路,对对甲苯磺酸钠的制备工艺具有极大的革新性和普遍应用性。
申请人:四川省中明环境治理有限公司
地址:620036 四川省眉山市东坡区复盛乡中塘村七组
国籍:CN
代理机构:成都弘毅天承知识产权代理有限公司
代理人:杨保刚
更多信息请下载全文后查看。

对甲苯磺酸的制备及应用甲苯磺酸是一种重要的有机化学品,广泛应用于化学、药物和染料工业等领域。
下面将介绍甲苯磺酸的制备方法及其应用。
甲苯磺酸的制备方法主要有以下几种:1. 甲苯直接磺化法:该方法是使用浓硫酸对甲苯进行磺化反应得到甲苯磺酸。
首先将甲苯加入到反应釜中,加热至80-90,然后缓慢滴加浓硫酸,并保持温度。
反应完成后,冷却并加入稀硫酸使溶液中的甲苯磺酸析出,经过过滤、洗涤、干燥即可得到纯品。
2. 甲苯氯化后的磺化法:该方法首先对甲苯进行氯化得到对甲基苯基氯,然后再用浓硫酸对其进行磺化反应得到甲苯磺酸。
该方法的优点是可以避免甲苯与浓硫酸直接接触,减少环境污染。
甲苯磺酸主要用途如下:1. 化学工业中的合成试剂:甲苯磺酸可以作为有机合成中的重要试剂,例如作为催化剂、还原剂、酸化剂等。
在有机合成中,甲苯磺酸可用于酯化反应、醚化反应、羧化反应等,通过调整反应条件,可以得到不同的有机化合物。
2. 染料工业中的中间体:甲苯磺酸可以用作染料工业中的中间体,用于合成不同类型的染料。
例如,甲苯磺酸经过酰化反应后可以得到苯酰氯,再与苯胺反应可以得到二苯亚胺,进一步与不同的芳香醛类化合物反应可以合成不同颜色的染料。
3. 药物工业中的原料:甲苯磺酸可以作为药物合成中的重要原料,用于制备多种药物。
例如,它可以用于合成抗生素、体外诊断试剂盒中的荧光标记剂以及保健品中的某些成分。
4. 电子工业中的添加剂:甲苯磺酸可以用作电子工业中的添加剂。
例如,在锂离子电池的电解质中加入甲苯磺酸,可以提高电池的电导率和稳定性。
5. 其他应用领域:甲苯磺酸还可以用作催化剂、去污剂、通用溶剂、防腐剂等。
在化学研究中,甲苯磺酸也常常用作研究试剂。
综上所述,甲苯磺酸是一种重要的有机化学品,在化学、药物和染料工业等多个领域具有广泛的应用。
它的制备方法主要有甲苯直接磺化法和甲苯氯化后的磺化法。
甲苯磺酸的主要应用包括化学工业中的合成试剂、染料工业中的中间体、药物工业中的原料、电子工业中的添加剂等。

对甲苯磺酸的制备实验报告甲苯磺酸的制备实验报告一、引言甲苯磺酸是一种重要的有机化合物,广泛用于医药、染料、涂料等行业。
本实验旨在通过甲苯的硝化和硝基甲苯的还原反应制备甲苯磺酸。
二、实验原理甲苯硝化反应是指将甲苯与浓硝酸在硫酸的催化下反应生成硝基甲苯。
硝基甲苯经还原反应后,得到甲苯磺酸。
三、实验步骤1. 准备实验器材和试剂:甲苯、浓硝酸、浓硫酸、氢氧化钠、无水乙醇。
2. 在通风橱内进行实验,佩戴防护眼镜和实验手套。
3. 将甲苯与浓硝酸按1:1的比例加入干净的烧杯中。
4. 加入适量的浓硫酸,用玻璃杯搅拌均匀。
5. 将混合液放入冰水浴中冷却,搅拌保持温度。
6. 在冷却的混合液中缓慢加入氢氧化钠溶液,反应产生的硝基甲苯沉淀出来。
7. 将硝基甲苯用无水乙醇洗涤,过滤并干燥。
8. 将干燥的硝基甲苯与浓硫酸混合,加热回流反应。
9. 过滤得到甲苯磺酸溶液,用无水乙醇洗涤并干燥。
四、实验结果与分析经过实验制备得到的甲苯磺酸呈白色结晶体,纯度较高。
通过对产物的红外光谱分析,发现在1700-1800 cm-1处有强烈的酰基伸缩振动吸收峰,证明甲苯磺酸的结构正确。
同时,通过对产物的元素分析,发现其中含有硫元素,进一步证明了甲苯磺酸的生成。
五、实验讨论在本实验中,我们采用了硝化和还原反应的方法制备甲苯磺酸。
硝化反应是一种常用的有机合成方法,通过硝酸与有机物反应,可以引入硝基基团。
而还原反应则是将硝基基团还原为氨基或烷基基团的过程。
通过这两个反应的组合,我们成功合成了甲苯磺酸。
然而,在实验过程中,我们也遇到了一些问题。
首先,硝化反应需要在低温下进行,以避免副反应的发生。
因此,在实验中需要严格控制温度,以确保反应的选择性和产率。
其次,还原反应需要使用浓硫酸作为催化剂,但硫酸对皮肤和眼睛有刺激性,需要注意安全操作。
六、结论通过本实验,我们成功制备了甲苯磺酸。
实验结果表明,制备的甲苯磺酸纯度较高,结构正确。
本实验不仅加深了我们对有机合成反应的理解,同时也提醒了我们在实验中要注意安全操作。

对甲苯磺酸生产工艺设计甲苯+硫酸,磺化结晶,就会得到对甲苯磺酸和母液,下面详细介绍对甲苯磺酸的主要合成方法合成对甲苯硫酸主要有一下集中方法:磺化反应中使用的磺化剂主要有:发烟硫酸、硫酸、三氧化硫、二氧化硫、氯磺酸、硫酰氯、亚硫酸盐等。
甲苯磺化成对甲苯磺酸采用的磺化剂主要有硫酸、三氧化硫、氯磺酸三种。
合成对甲苯磺酸的主要方法有:硫酸磺化法、三氧化硫磺化法、氯磺酸磺化法、对甲苯磺酰氨水解法,它们各有自己的特点。
1、硫酸磺化法用硫酸磺化甲苯,是采用最多且历史最长的工艺。
磺化反应过程如下:磺化反应速度与甲苯浓度成正比,与硫酸含水量的平方成反比,所以需使用含水少的硫酸和纯度高的甲苯,但磺化反应是可逆反应,每消耗lmol的硫酸就生成lmol的水,水的浓度随反应的进行而逐渐升高,最后达到平衡,产生大量的废酸。
工业生产中,一般采用分压蒸馏法来除掉磺化反应生成的水,使磺化反应进行完全。
用硫酸作磺化剂,其优点是:由于硫酸价格低而具有一定的市场竞争力,且生产工艺简单、设备投资低、易操作等,适用于小规模生产装置。
但此工艺的反应收率低、产品纯度低,反应进行时随着水的生成,硫酸浓度下降,当达到95%时(π值为75%),反应停止,产生大量的废酸,严重污染环境。
最新的研究表明,采用添加助剂的方法可适当提高产品质量和反应收率。
2、三氧化硫磺化法理论上,三氧化硫是最有效的磺化剂,因为只是直接的加成而不用脱除反应生成的水。
在适宜的条件下,产品几乎全部是对甲苯磺酸。
以气相三氧化硫磺化剂磺化甲苯,宜选择降膜吸收反应器,采用1%的有机酸(如加入醋酸可抑制砜的产生)作为定位剂,温度控制在17℃-2O℃之间,SO3气体浓度6%一9%,反应得到的对甲苯磺酸纯度高。
用三氧化硫作磺化剂的优点是:反应安全、速度快、三废少、收率高、副产物少、产品纯度高。
缺点是:生产工艺复杂,一次性设备投资大,反应设备结构复杂,工艺操作要求高,三氧化硫运输困难,此方法对硫酸生产企业较适用。

对甲苯磺酸钠盐的生产方法
将甲苯用96%~98%的硫酸进行磺化,得对甲基苯磺酸,后者再用液碱中和得对甲基苯磺酸钠粗品,然后脱色、浓缩、结晶、离心,即得成品。
对甲苯磺酸钠盐的用途:
1.可用于有机合成、制药。
用于化学工业和合成洗涤剂的料浆调理剂。
用作合成洗涤剂的水助溶剂,配入粉状洗涤剂中可增加含水量,同时对流动性、手感、抗结块性等均有良好的效果。
在化肥生产中也用作结晶添加剂。
2.在液体洗涤剂中,主要用作增溶剂,加入对甲苯磺酸钠后,黏度、浊点都会有所下降。
在使用时,应注意原料的含量、无机盐及溶解性。
特别对液体洗涤剂,其盐的含量对液体透明度有很大的影响。


对甲苯磺酸的制备与应用辽宁石油化工大学继续教育学院论文摘要本文主要对对甲苯磺酸的制备工艺和应用前景进行了研究,分别采用了传统工艺和两种改进工艺制备对甲苯磺酸,并对此进行了比较。
改进工艺克服了传统工艺的弊端。
第一种改进方案是运用了部分结晶选择性原理制备对甲苯磺酸。
甲苯与浓硫酸在甲苯沸腾回流(110℃)的条件下反应5h后,在80℃下加一定量的水使对甲苯磺酸结晶水合物从磺化混合液中析出,而间位和邻位两种异构物留在体系中,补充原料后继续反应,体系重新达到化学平衡状态,再析出产品。
如此循环反应-结晶过程,即抑制了新的间位和邻位异构物进一步产生,又使较纯的对位产物分离出体系。
优化了工艺条件,结果表明,该生产工艺路线为硫酸定量反应,无废酸或甲苯排放,产品纯度大于85%,对于高选择性生产对甲苯磺酸和清洁磺化过程具有重要的意义。
第二种改进工艺是将甲苯缓慢滴加到热的浓硫酸中,此工艺减短了实验时间,使操作时间为平时的四分之一,不但节省了反应物的用量,而且还大大提高了产量,改进的方法制备收率高,反应操作简单。
本文以对甲苯磺酸做催化剂催化合成了邻苯二甲酸二丁酯,其产率为84.0%,用浓硫酸作催化剂的产率为82.8%,尽管两者间的产率相近,但对甲苯磺酸没有腐蚀性,且在反应过程中不能产生废酸,对环境无污染。
关键词: 对甲苯磺酸;磺化;结晶;催化剂I辽宁石油化工大学继续教育学院论文AbstractThis paper focuses on the p-toluene sulfonic acid preparation process and application prospects were studied, respectively using traditional technology and two kinds of improved preparation process of p-toluene sulfonic acid, and make a comparison. Improved technology overcomes the defects of thetraditional process. The first improvement plan is the use of partially crystalline selective preparation principle of p-toluene sulfonic acid. Refluxing toluene with concentrated sulfuric acid in toluene (110 ℃) 5h reaction conditions, adding a certain quantity of water at 80 ℃ for crystalline hydrate precipitated from the sulfonated toluene sulfonic acid in the mixture, and meta - and ortho two isomers in the system, supplementary materials after reaction, system to achieve chemical equilibrium, thenprecipitation products. So the cycle reaction crystallization process, which inhibits the new meta - and ortho isomer to produce, and the para product is pure isolated system. Process conditions, the optimization results show that, the production process for sulfuric acid quantitative reaction, no waste acid or toluene emissions, the purity of product is more than 85%, high selectivity for the production has the vital significance to the toluene sulfonic acid and clean the sulfonation process. Process improvement of second is concentrated sulfuric acid to toluene is slowly added into hot, this process to shorten the experimental period, the operation time is usually 1/4, not only to save the amount of reactants, but also greatly improve the yield, high yield improved method of operation is simple, reactiThe catalyst p-toluene sulfonic acid dibutyl phthalate was synthesized,its yield is 84%, with concentrated sulfuric acid as catalyst. The yield is 82.8%, although similar between the yield, but no corrosive p-toluene sulfonic acid, and can not waste acid produced in the reaction process, no pollution to the environment.Keywords: catalyst p-toluene sulfonic acid sulfonation crystallizationII辽宁石油化工大学继续教育学院论文目录第1章文献综述 (1)1.1 对甲苯磺酸的性质 .....................................................2 1.2对甲苯磺酸的制备方法 (2)1.2.1硫酸磺化法 (2)1.2.2三氧化硫磺化法 ................................................. 3 1.2.3 氯磺酸磺化法 ................................................... 4 1.3对甲苯磺酸的精制 .. (4)1.3.1真空精馏法 (4)1.3.2水稀释法 ....................................................... 4 1.3.3酸的应用 (5)1.4.1催化剂 (5)1.4.2有机合成 ....................................................... 5 1.4.3稳定剂 ......................................................... 5 1.5选题意义 ............................................................. 5 第2章实验部分 . (7)表2.1实验药品 ...........................................................7 表2.2实验仪器 (7)2.3制备对甲苯磺酸的传统工艺 (8)2.3.1原理 (8)2.3.2实验步骤 ....................................................... 8 2.3.3传统工艺存在的问题 ............................................. 8 2.4工艺改进一 .. (9)2.4.1改进原理 (9)III辽宁石油化工大学继续教育学院论文2.4.2 实验过程 (10)2.5工艺改进二 (10)2.5.1改进原理 (10)2.5.2实验步骤 ...................................................... 10 2.6实验改进的结果讨论 .. (10)表2.6.1工艺一实验结果讨论 (11)表2.6.2工艺二 (11)第3章对甲苯磺酸的应用 (12)3.1对甲苯磺酸的应用 (12)3.1.l催化剂 (12)3.1.2有机合成 ...................................................... 12 3.1.3酸合成酯 (12)3.2.1对甲苯磺酸催化合成邻苯二甲酸二丁酯 (12)3.2.2 酯的合成 ...................................................... 13 3.3结果与讨论 .......................................................... 13 第4章结论 (15)致谢........................................................................17IV辽宁石油化工大学继续教育学院论文第1章文献综述对甲苯磺酸是贾沃斯基(Jaworsky)于1865年用硫酸磺化而首先制得的,该产品是无色或白色片状或柱状结晶,易溶于醇,难溶于苯,对皮肤、眼睛、黏膜有刺激性。

青岛大学实验报告2010年9月19号姓名:管清龙学号:200841604036 系年级:08级组别:A15 同组者:姜晓娟李腾科目:有机合成单元反应题目:苯磺酸钠仪器编号:A15一、实验目的:1.了解芳烃磺化的反应原理和合成方法。
2.掌握芳磺酸的分离方法。
二、实验原理:芳环上氢原子被磺酸基取代生成芳磺酸的反应叫磺化反应。
磺化是亲电子取代反应。
芳环上有给电子基,磺化较易进行,有吸电子基则较难进行。
例如:甲苯比苯容易磺化、氯苯比苯难磺化,根据被磺化物的性质要使用不同的磺化剂,所以苯的磺化需要用发烟硫酸。
H SO,SO SO3HCa(OH)2CaNa2CO3SO3Na本实验使用脱硫酸钙法:为了减少磺酸盐中的无机盐,某些磺酸,特别是多磺酸,不能用盐析法分离,需采用脱硫酸钙法。
磺化物在稀释后用Ca(OH)的悬浮液进行中和,生成的磺酸钙能溶于水,过滤掉硫酸钙沉淀后,将溶液再用NaCO3处理,使磺酸盐变成钠盐。
三、主要试剂及仪器:苯、8%发烟硫酸、Ca(OH)2、NaCO3四口烧瓶、搅拌器、球形冷凝管、滴液漏斗、温度计等。
四、目标产物的理化性质及三维图像苯磺酸钠的结构图:SHHHH O O ONa sodium benzenesulfonate苯磺酸钠的一些理化性质:苯磺酸钠结构中的主要键长:S —O 键O—Na键苯磺酸钠结构中的主要键角:苯磺酸钠结构中的面面夹角:五、主要试剂物理化学性质:六、实验装置图:七、实验步骤:在装有搅拌器、球形冷凝管、温度计的250ml四口烧瓶中,加入50ml苯,并在搅拌下慢慢的滴加55ml 8%发烟硫酸,温度不超过75℃。
用冷水浴保持此温度,加热物料。
注意在球形冷凝管中苯蒸汽的冷凝界限以不超过第一球为好。
当反应物的温度达到100℃且球形冷凝管内没有笨蒸汽冷凝下来时,磺化完成,将物料倒入500ml水中,温度为60—65℃时,用Ca(OH)2中和至刚果红试纸变紫色,此时呈微酸性。
将苯磺酸钙过滤,除去CaSO4,用Na2CO3溶液将滤液滴加成钠盐,不再有沉淀为止。
一、实验目的
1、学习芳香族的磺化反应制备芳磺酸。
2、巩固分水器的使用、回流、抽滤等操作。
二、实验原理
烷基苯在磺化剂作用下进行磺化是一个可逆反应。
甲苯在低温下磺化主要得到1:1的邻位和对位磺化产物的混合物,属于动力学控制;于较高温度进行磺化反应,由于空间效应,主要得到热力学稳定的对位产物。
本实验的化学反应式如下:
在制备对甲苯磺酸的时候会产生副反应,降低对甲苯磺酸的产率。
反应方程式如下:
实验装置图如下:
三、实验步骤
1、在50mL圆底烧瓶内放入25mL甲苯,一边摇动烧瓶,一边缓慢的加入5.5mL浓硫
酸,投入几粒沸石。
2、将烧瓶组装到回流分水装置上,加热回流2h或至分水器中积存2mL水为止。
3、反应结束,冷却反应物。
4、将反应物倒入烧杯中,加入1.5mL水,用玻璃棒慢慢搅动,反应物逐渐变成固
体。
用布氏漏斗抽滤,得粗产品。
5、在50mL烧杯里,将粗产品溶于约6mL水。
往此溶液里通入氯化氢气体,直到析出
结晶。
在通氯化氢气体时,要采取措施,防止“倒吸”。
析出的晶体用布氏漏斗快速抽滤。
抽滤完成的晶体保存在干燥器中。
注:实验报告的内容: 一、实验目的;二、实验原理;三、实验步骤;四、实验结果;五、讨论分析(完成指定的思考题和作业题);六、改进实验建议。
对甲苯磺酸制备实验报告甲苯磺酸制备实验报告引言甲苯磺酸是一种重要的有机合成中间体,广泛应用于医药、染料、涂料等领域。
本实验旨在通过对甲苯磺酸的制备过程进行研究,探索最优的制备条件和方法。
实验原理甲苯磺酸的制备方法主要有两种:一种是通过甲苯与浓硫酸反应得到甲苯磺酸;另一种是通过甲苯与亚硝酸钠反应生成对甲基苯磺酸,再通过酸化反应得到甲苯磺酸。
实验步骤1. 实验前准备准备好所需的实验器材和试剂,包括甲苯、浓硫酸、亚硝酸钠等。
2. 反应条件选择根据实验要求和已有文献资料,选择适宜的反应条件。
如温度、反应时间、反应物的摩尔比等。
3. 反应操作将甲苯和浓硫酸按一定比例加入反应瓶中,加热搅拌,控制反应温度在适宜的范围内。
反应结束后,将反应混合物进行冷却。
4. 结晶分离将反应混合物转移到漏斗中,加入适量的冷水进行结晶分离。
通过过滤或离心等方式将结晶物分离出来。
5. 洗涤和干燥用冷水洗涤分离得到的结晶物,去除杂质。
然后将洗净的结晶物晾干或用低温烘干。
6. 验收对制备得到的甲苯磺酸进行质量验收,包括外观、纯度、溶解性等方面。
实验结果与讨论通过实验操作,成功合成了甲苯磺酸。
经过结晶分离、洗涤和干燥等步骤,得到了白色结晶状的甲苯磺酸产物。
对产物进行质量验收,外观无明显杂质,纯度较高,溶解性良好。
在实验过程中,我们发现反应温度对甲苯磺酸的产率和纯度有重要影响。
过高的温度可能导致副反应的发生,降低产率和纯度。
因此,在实验中应控制好反应温度,保证反应的高效进行。
此外,亚硝酸钠的用量也是影响甲苯磺酸产率的关键因素。
过量的亚硝酸钠可能导致副反应的发生,降低产率。
因此,在实验中应根据实际需要合理控制亚硝酸钠的用量。
结论通过本次甲苯磺酸制备实验,我们成功合成了高纯度的甲苯磺酸。
实验结果表明,反应温度和亚硝酸钠的用量是影响甲苯磺酸产率和纯度的重要因素。
在实际应用中,可以根据需要对反应条件进行调整,以获得更好的制备效果。
总结甲苯磺酸作为一种重要的有机合成中间体,在医药、染料、涂料等领域具有广泛的应用前景。
对甲苯磺酸实验报告甲苯磺酸实验报告甲苯磺酸,化学式为C7H8O3S,是一种有机化合物,常用作有机合成反应的试剂。
在实验室中,甲苯磺酸的应用非常广泛,尤其在有机合成和催化反应中扮演着重要角色。
本篇文章将对甲苯磺酸的实验报告进行详细讨论,从实验目的、实验步骤、实验结果和实验分析等方面进行探讨。
实验目的:本实验的主要目的是通过合成甲苯磺酸的方法,探究有机合成反应的机理,并通过实验结果分析其反应过程和产物的性质。
实验步骤:1. 准备实验器材和试剂:包括甲苯、浓硫酸、冷却装置、烧杯等。
2. 在烧杯中加入适量的甲苯,然后缓慢加入浓硫酸。
3. 将烧杯放置在冷却装置中,控制温度在适宜的范围内。
4. 反应进行一段时间后,观察产物的形态和颜色变化。
5. 将产物过滤并进行干燥处理。
6. 对产物进行物理性质和化学性质的测试和分析。
实验结果:在实验过程中,我们观察到甲苯磺酸的合成反应进行顺利。
最初的甲苯在与浓硫酸反应后,产生了明显的颜色变化,从无色逐渐转变为淡黄色。
经过一段时间的反应,产物逐渐沉淀并形成固体。
通过过滤和干燥处理后,我们得到了白色的固体产物。
实验分析:根据实验结果,我们可以初步得出甲苯磺酸的合成反应机理。
在该反应中,甲苯与浓硫酸发生酯化反应,生成甲苯磺酸。
这个反应是一个酸催化的酯化反应,其中浓硫酸起到了催化剂的作用。
甲苯磺酸是一种白色固体,具有一定的稳定性和溶解性,在有机合成中常用作催化剂和试剂。
除了合成甲苯磺酸的实验过程,我们还可以进一步探究甲苯磺酸的应用领域。
甲苯磺酸在有机合成中具有广泛的应用价值,可以用于催化酯化反应、醚化反应和酰化反应等。
此外,甲苯磺酸还可以用作有机合成中的试剂,如酸催化的酯化反应中的催化剂、醇的脱水剂等。
总结:通过对甲苯磺酸实验报告的详细讨论,我们可以更好地了解有机合成反应中的甲苯磺酸的应用。
实验过程中,我们通过合成甲苯磺酸的方法,观察到了反应的颜色变化和产物的形态变化。
通过实验结果的分析,我们初步了解了甲苯磺酸的合成反应机理。
对甲苯磺酸钠的制备一、思索题1.在对甲苯磺酸钠的制备试验中,中和酸时,为什么用NaHC03而不用Na2CO3 ?答:由于用NaHC03中和生成具有酸性的NaHS04 ,其水溶性较大;而用Na2CO3 中和,易将硫酸完全中和,生成中性的Na2s04 ,且水溶性较小,从而易使产品中夹杂有硫酸钠,影响产品质量。
2.在对甲苯磺酸钠的制备试验中,NaCI起什么作用?用量过多或过少,对试验结果有什么影响?答:NaCI的作用是:(1)第一次是使对甲苯磺酸转化成钠盐。
(2 )其次次是起盐析作用,使对甲苯磺酸钠晶体析出。
NaCI用量过多,产品中将混有NaCI杂质,降低产品纯度。
NaCI用量少,不能使对甲苯磺酸钠结晶完全析出,降低产率。
3.用浓硫酸作磺化剂制备对甲苯磺酸钠的优缺点是什么?答:用浓硫酸作磺化剂的优点是:(1)原料易得,价格廉价。
(2 )可以避开使用氯磺酸、发烟硫酸等磺化剂带来的麻烦,削减环境污染。
(3 )操作简洁,反应温度相宜。
用浓硫酸作磺化剂的缺点是:(1)与氯磺酸、发烟硫酸等磺化剂比较,浓硫酸的磺化力量相对较弱,因此反应速度较慢,反应温度相对较高,产率较低。
(2)因使用过度的浓硫酸,使对甲苯磺酸钠的分别相对困难些。
4.在对甲苯磺酸钠的合成中搅拌的目的是什么?答:由于甲苯与浓硫酸互不相溶,通过搅拌可使两者充分接触,达到缩短反应时间,削减碳化,提高产率的目的。
5.在对甲苯磺酸钠的合成中,怎样才能保证产品是对甲苯磺酸钠?答:(1)严格掌握反应温度在100-120℃ ,由于在此温度下主要得到邻位产物。
温度过高,将得到苯二磺酸和二甲苯飒等副产物。
(2)反应中肯定要保持微沸状态,使提升蒸气环不超过球形冷凝管的1/3O6.在对甲苯磺酸钠的合成中,在平安方面应留意什么?如不当心发生甲苯起火或浓硫酸溅到皮肤上应怎样处理?答:再平安方面应留意:防止发生火灾和被浓硫酸灼伤。
如不慎发生起火,应马上切断电源,移开四周其它易燃物品,快速用石棉布掩盖火源,使甲苯与空气隔绝而灭火。
苯磺酸钠的制备实验目的掌握苯的磺化反应和常用磺化剂的使用;掌握制备苯磺酸钠的原理和方法;了解苯磺酸钠的性质及分离方法。
实验原理磺化是亲电取代反应,芳烃衍生物磺化的难易,取决于芳烃上取代基的性质,芳环上有亲核取代基时有利于磺化反应。
磺化反应要根据被磺化物的性质来选择磺化剂。
最常用的磺化剂有:硫酸,氯磺酸,发烟硫酸。
苯的磺化较难,宜用发烟硫酸做磺化剂。
仪器和试剂1. 仪器:三口瓶,球形冷凝管,Y型管,滴液漏斗,烧杯,温度计,电热套,抽滤装置,托盘天平,量筒。
2. 试剂:苯20mL,发烟硫酸(8%)14mL,碳酸钙,氢氧化钙,碳酸钠。
实验步骤1. 磺化在装有温度计,球形冷凝管和滴液漏斗的150mL三口瓶中,加入20mL苯,在不断搅拌下缓慢滴加14mL8%的发烟硫酸[1](约在30min内加完),并用冷水浴控制反应温度不超过75℃。
发烟硫酸加完后,用电热套加热回流2h。
使球形冷凝管内的苯蒸汽的冷凝界限不超过第一球为宜。
2. 中和当反应液的温度达到100℃[2],且球形冷凝管中无苯蒸汽冷凝现象时,则说明磺化完成。
将物料冷却至50℃以下,倒入盛有100mL水的烧杯中,用氢氧化钙和碳酸钙[3]中和至pH=6。
3. 过滤和分离磺化产物过滤中和液,以除去硫酸钙。
用30mL热水淋洗滤饼,取出滤饼放入500mL 烧杯中,加入50mL热水,搅拌,过滤,滤饼再用30mL热水淋洗,并将洗液与滤液合并。
滤液中加入碳酸钠,将苯磺酸钙转变为钠盐[4]。
过滤(抽滤,用双层滤纸)除去碳酸钙,并用少量水洗滤饼。
将滤液先用烧杯蒸发,然后转入蒸发皿中蒸发至有苯磺酸钠结晶出现为止,冷却,结晶,过滤,干燥。
产品[5]称重,并计算产率。
注释[1]发烟硫酸为强腐蚀性液体,应小心操作,防止灼伤。
配制时应戴眼镜和手套,并在通风橱内操作。
[2]磺化反应温度应控制在110℃以下,高于此温度会增加副产物。
[3]用碳酸钙中和苯磺酸时,有二氧化碳气体放出,所以碳酸钙必须分批加入并不断搅拌反应混合物。
实验八对甲苯磺酸钠的制备
【实验目的】
1.了解芳香族化合物磺化的基本原理、方法及反应温度的影响。
2.进一步熟悉回流、减压过滤、重结晶等基本操作。
【实验的准备】
仪器:圆底烧瓶(100 ml 1个);球形冷凝管(1 支);水银温度计(250℃ 1支);烧杯(250 ml、800 ml各1个);吸滤瓶;布氏漏斗;电动搅拌器。
药品:甲苯 14 g 16 ml (0.15 mol);
浓硫酸(98 %) 11 ml (0.02 mol);
碳酸氢钠 7 g;精盐 23 g;
活性炭。
【物理常数】
【仪器安装要点】
1.以热源为基准,按教材p31图1.18-(1)安装仪器。
2.安装时应注意以下几点:
(1)搅拌器的轴、搅拌棒及三颈烧瓶的轴心应在同一直线上。
(1)搅拌棒和紧套在温度计套管上的橡皮管之间用少许甘油或凡士林润滑。
(3)支撑仪器的所有夹子必须旋紧,以保证仪器不承受任何压力和扭力。
(4)搅拌前,用手转动搅拌器,看其启动是否灵活,是否碰撞器壁或温度计。
【操作要点】
1.反应温度严格在100~120℃之间;回流速度以2~3滴/min为宜。
2.反应终点的控制:
甲苯层消失表明反应已经结束,大约20 min左右。
3.加NaHCO3中和部分酸液时,应分批、在不断搅拌下
加入,以防产生大量的CO2气泡逸出烧杯。
4.趁热过滤时,吸滤瓶和布氏漏斗要充分预热。
滤液要自然冷却。
【本实验的成败关键】
反应温度的控制和反应终点的判断。