02九年级化学期中复习专题(二)物质的分类
- 格式:pptx
- 大小:563.89 KB
- 文档页数:13

中考化学复习知识点总结物质的分类物质的分类是化学中的一个重要内容,也是中考化学考试的重点之一、下面是关于物质的分类的知识点总结:1.物质的分类原则:(1)按物质的纯净程度分类:纯物质和混合物。
(2)按物质的组成分类:元素和化合物。
(3)按物质的状态分类:固体、液体和气体。
(4)按物质的性质分类:金属、非金属和半金属。
2.纯物质和混合物:(1)纯物质是由同一种物质组成的,有固定的化学组成,在一定条件下具有一定的物理性质和化学性质。
(2)混合物是由两种或两种以上的纯物质按一定比例物理上混合而成的,可以通过物理方法分离。
3.元素和化合物:(1)元素是由原子组成,是化学中最基本的物质单位,不能被化学方法分解成其他物质。
(2)化合物是由两种或两种以上元素以一定的化学组成比例通过化学反应联结而成的物质。
4.固体、液体和气体:(1)固体的分子间距离小,分子之间有规则排列,密度大,体积固定,不易被压缩。
(2)液体的分子间距离较大,可以流动,密度较小,体积不固定,不易被压缩。
(3)气体的分子间距离最大,自由运动,无固定体积和形状,可被压缩。
5.金属、非金属和半金属:(1)金属具有良好的导电性、导热性和延展性,大多数具有金属光泽,常为固态。
(2)非金属通常为气体、液体或固体,导电性、导热性较差,通常无金属光泽。
(3)半金属具有金属和非金属的一些性质,导电、导热性较差,弹性和脆性。
以上就是关于物质的分类的一些基本知识点。
中考化学复习时,可以通过复习这些知识点来加深对物质分类的理解,并结合实例进行巩固。
同时,还应重点掌握物质分类的应用,如根据物质的性质选择适当的分离纯化方法等。
希望对你的学习有所帮助!。

初三化学知识点:物质的分类知识就是力量,时间就是金钱,小伙伴们需要抓紧时间做好备考复习,下面由小编为你精心准备了“初三化学知识点:物质的分类”,持续关注本站将可以持续获取更多的考试资讯!物质的分类(1)混合物和纯净物混合物:组成中有两种或多种物质。
常见的混合物有:空气、海水、自来水、土壤、煤、石油、天然气、爆鸣气及各种溶液。
纯净物:组成中只有一种物质。
①宏观上看有一种成分,微观上看只有一种分子;②纯净物具有固定的组成和特有的化学性质,能用化学式表示;③纯净物可以是一种元素组成的(单质),也可以是多种元素组成的(化合物)。
(2)单质和化合物单质:只由一种元素组成的纯净物。
可分为金属单质、非金属单质及稀有气体。
化合物:由两种或两种以上的元素组成的纯净物。
(3)氧化物、酸、碱和盐氧化物:由两种元素组成的,其中有一种元素为氧元素的化合物。
氧化物可分为金属氧化物和非金属氧化物;还可分为酸性氧化物、碱性氧化物和两性氧化物;酸:在溶液中电离出的阳离子全部为氢离子的化合物。
酸可分为强酸和弱酸;一元酸与多元酸;含氧酸与无氧酸等。
碱:在溶液中电离出的阳离子全部是氢氧根离子的化合物。
碱可分为可溶性和难溶性碱。
盐:电离时电离出金属阳离子和酸根阴离子的化合物。
盐可分为正盐、酸式盐和碱式盐。
物质为构成宇宙间一切物体的实物和场。
例如空气和水,食物和棉布,煤炭和石油,钢铁和铜、铝,以及人工合成的各种纤维、塑料等等,都是物质。
世界上所有的存在都是物质。
人体本身也是物质。
除实物之外,光、电磁场等也是物质,它们是以场的形式出现的物质。
物质的种类形态万千,物质的性质多种多样。
气体状态的物质,液体状态的物质或固体状态的物质;单质、化合物或混合物;金属和非金属;矿物与合金;无机物和有机物;天然存在的物质和人工合成的物质;无生命的物质与生命物质以及实体物质和场物质等等。
物质的种类虽多,但它们有其特性,那就是能够被观测或被理论预言,以及都具有质量和能量。

物质的分类
1.物质分类:纯净物和混合物
a、纯净物:由一种物质组成的,"纯净"是相对的,绝对纯净的物质是没有的,只要杂质含量低,不至于对生产和科学研究产生影响的物质就是纯净物。
b、混合物:由两种或多种物质组成,这些物质相互间没有发生化学反应,各物质都保持各自的性质(例如:空气、雨水、溶液、碳酸饮料、牛奶等)。
2.注意事项:划分纯净物、混合物的标准是根据物质的种类来划分的。
只含一种物质的就属于纯净物,含有几种物质的就属于混合物。
另:水、蒸馏水、冰水混合物都是纯净物;自然界的水、矿泉水、盐水、糖水、雪碧饮料等都是混合物。

初三化学知识点:物质的分类1500字物质是构成世界的基本单位,根据其物理性质、化学性质和组成方式,可以将物质分为不同的类别。
在化学中,通常根据其组成方式和化学性质分类物质。
以下是关于物质分类的一些知识点。
1. 纯物质和混合物:纯物质是由同一种物质组成的,具有确定的物理性质和化学性质。
例如,金属银、纯净水等都是纯物质。
混合物是由两种或多种不同的物质混合而成的,其成分可以是不固定的。
例如,空气、淡盐水都是混合物。
2. 元素和化合物:元素是由同一种原子组成的物质,不能通过化学方法分解为其他物质。
目前已知的元素共有118种,如氧气、铜、银等。
化合物是由两种或更多种元素以固定的比例结合而成的物质,可以通过化学方法分解为其组成元素。
例如,水(H2O)、盐(NaCl)等都是化合物。
3. 金属、非金属和半金属:金属是一类常见的物质,具有良好的导电性、热传导性和延展性。
例如,铁、铜、铝等都是金属。
非金属是指性质与金属相反的物质,通常具有较低的导电性和热传导性。
例如,碳、硫、氧等都是非金属。
半金属具有一些金属和非金属的性质。
例如,硅、锑等都是半金属。
4. 酸、碱和盐:酸是指具有酸性质的物质,能够与碱发生中和反应。
酸通常具有酸味、能够腐蚀物质和导电性等特点。
例如,硫酸(H2SO4)、盐酸(HCl)等都是酸。
碱是指能够与酸发生中和反应并产生盐和水的物质,通常具有苦味和腻感。
例如,氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)等都是碱。
盐是一类化合物,由阳离子和阴离子组成,通常是酸和碱反应后的产物。
例如,氯化钠(NaCl)、硫酸钠(Na2SO4)等都是盐。
5. 有机物和无机物:有机物是由碳元素与氢元素以及其他非金属元素组成的物质,通常具有复杂的结构和多种功能。
例如,葡萄糖、甲烷等都是有机物。
无机物是除了有机物以外的所有物质,包括无机酸、无机盐、无机气体等。
例如,氯气、氧气、盐酸等都是无机物。
总结起来,物质的分类有纯物质和混合物、元素和化合物、金属、非金属和半金属、酸、碱和盐以及有机物和无机物等。
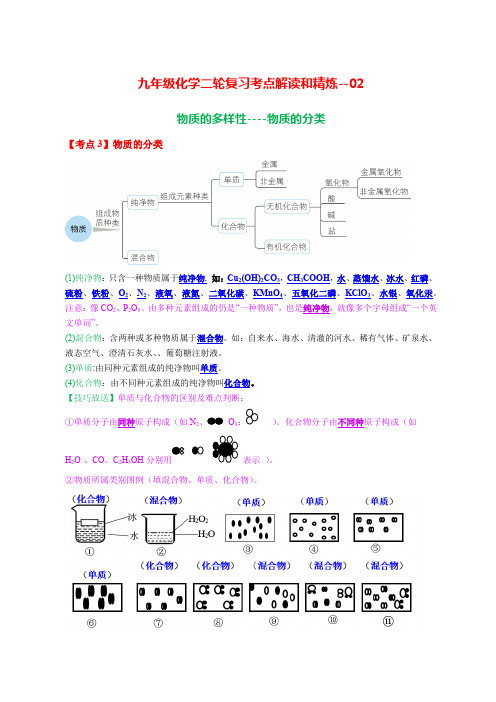
九年级化学二轮复习考点解读和精炼--02物质的多样性----物质的分类【考点3】物质的分类(1)纯净物:只含一种物质属于纯净物.如:Cu2(OH)2CO3,CH3COOH,水、蒸馏水、冰水、红磷、硫粉、铁粉、O2、N2、液氧、液氮、二氧化碳、KMnO4、五氧化二磷、KClO3、水银、氧化汞。
注意:像CO2、P2O5、由多种元素组成的仍是“一种物质”,也是纯净物,就像多个字母组成“一个英文单词”。
(2)混合物:含两种或多种物质属于混合物。
如:自来水、海水、清澈的河水、稀有气体、矿泉水、液态空气、澄清石灰水、、葡萄糖注射液。
(3)单质:由同种元素组成的纯净物叫单质。
(4)化合物:由不同种元素组成的纯净物叫化合物。
【技巧放送】单质与化合物的区别及难点判断:①单质分子由同种原子构成(如N2O3)。
化合物分子由不同种原子构成(如H2O、CO、C2H5OH表示)。
②物质所属类别图例(填混合物、单质、化合物)。
③一种元素形成的单质有可能是多种,如O元素形成的单质有O2、O3,P元素形成的单质有红磷、白磷,C元素形成的单质有金刚石、石墨、C60、C70、碳纳米管等。
说明含一种元素的物质有可能是纯净物、单质、或多种单质组成的混合物。
④判断单质、化合物、氧化物的方法:单一“物质”组成的都是纯净物;纯净物中像C、Fe、O2、N2这样单一“元素”组成的叫单质;像H2O、CO2、KMnO4、KClO3这样由多种元素“合而为一”组成的物质叫化合物,这些化合物中,像H2O、CO2、Fe3O4这样两种元素组成且其一为氧元素的物质叫氧化物。
即:单质、化合物、氧化物首先都是纯净物。
(5)氧化物:由两种元素组成的化合物中,若其中一种是氧元素叫做氧化物(或由氧元素和元素组成的化合物)。
(6)酸:电离时产生的阳离子全部是H+的化合物。
(7)碱: 电离时产生的阳离子全部是OH-的化合物。
(8)盐:由金属离子(铵根离子)和酸根离子构成的化合物。

A B.C.D.问题2:氧化物、含氧化合物与化合物的区别和联系?知识精讲:判断一种物质是否是氧化物,除了看是否含有氧元素外,还必须要看该化合物中是否含有两种元素,两个条件都具备了才是氧化物;练习4:(2016•某某)下列几种常见的物质中,属于氧化物的是()A.生石灰B.海水C.高锰酸钾D.酒精问题3:酸、碱、盐有哪些区别和联系?物质酸碱盐概电离时电离时生电离时引导学生分析讨论氧化物、含氧化合物、化合物之间的区别和联系。
强调判断一种物质是氧化物的方法。
【方法指导】氧化物是由两种元素组成、其中一种是氧元素的化合物。
生石灰是由钙元素和氧元素组成的化合物,属于氧化物;海水中含有水、氯化钠等物质,属于混合物,不属于氧化物;高锰酸钾是由三种元素组成的化合物,不属于氧化物;酒精是由三种元素组成的化合物,不属于氧化物。
【答案】A教师引导学生复习回顾常见的酸、碱、盐,并书写常见的酸碱盐的化学式,从化学式中得出酸、碱、盐的概念,以及酸碱盐的相同点和不同点。
知能应用例1:(2016•某某模拟)现有①四氧化三铁②空气③铁粉④氯酸钾⑤液态氧⑥冰⑦氯化钾⑧海水等物质,其中属于混合物的有(填序号,下同),属于纯净物的有,属于化合物的有,属于单质的有,属于氧化物的有.例2:(2016•某某)掌握分类的方法对于化学学习非常重要,以下物质的思路导析:解决本题的关键是掌握纯净物、混合物、单质、化合物、氧化物的概念以及它们之间的区别和联系。
①四氧化三铁由铁元素和氧元素组成,既属于化合物又属于氧化物;②空气中含有氧气、氮气、二氧化碳等物质,属于混合物;③铁粉是由一种元素组成,属于单质;④氯酸钾由三种元素组成,属于化合物;⑤液态氧是由氧元素一种元素组成,属于单质;⑥冰是由氢元素和氧元素组成,既属于化合物又属于氧化物;⑦氯化钾由两种元素组成,属于化合物;⑧海水中含有氯化钠、水等物质,属于混合物。
【答案】②⑧;①③④⑤⑥⑦;①④⑥⑦;③⑤;①⑥.主要生产原料是油脂、氢氧化钠和水等.(1)有关氢氧化钠和水的分类正确的是.选项氢氧化钠水A 混合物纯净水B 碱氧化物C 有机物无机物(2)生产肥皂的主要反应原理:C57H114O4+3NaOH3C14H35O2Na+X,则X的化学式为.达标测试作业设计教后反思。
化学九年级知识点总结期中化学是一门研究物质及其性质、结构、组成、变化规律以及与能量的关系的科学。
它是一门重要的自然科学学科,对于我们了解世界和解决实际问题具有重要的意义。
下面将对化学九年级的一些重要知识点进行总结。
一、物质与反应1. 物质的分类:物质可以分为纯物质和混合物两大类。
纯物质又可以分为化合物和元素,化合物由两种或更多元素以一定的比例组合而成,元素是由同种原子组成。
2. 物质的性质:物质的性质可以分为物理性质和化学性质。
物理性质是指物质在不改变物质本质的条件下所表现出的性质,如颜色、硬度等;化学性质是指物质与其他物质发生变化时所表现出的性质,如燃烧、腐蚀等。
3. 化学反应:化学反应是指物质之间发生变化,生成新的物质的过程。
化学反应的条件包括温度、压力、浓度等。
二、原子结构和元素周期表1. 原子结构:原子是物质的基本单位,由原子核和电子组成。
原子核中有质子和中子,电子存在于原子核外的电子壳层中。
2. 元素周期表:元素周期表是根据元素的原子序数和化学性质,将元素按一定规律排列的表格。
元素周期表可以分为周期、族和区三个方向,周期为水平方向,族为垂直方向,区为分割的块状区域。
三、化学键和化合物1. 化学键:化学键是原子之间相互吸引而形成的连接。
常见的化学键有离子键、共价键和金属键等。
2. 化合物:化合物是由两种或更多种元素以一定的比例结合而成的物质。
化合物有固定的化学式和化学性质。
四、离子反应和酸碱中和反应1. 离子反应:离子反应是指溶液中的离子之间的化学反应。
离子反应中的阳离子和阴离子互相组成新的物质。
2. 酸碱中和反应:酸碱中和反应是指酸和碱反应形成盐和水的反应。
酸具有酸性质,碱具有碱性质。
五、氧化还原反应和电解质1. 氧化还原反应:氧化还原反应是指物质中的原子或离子发生电荷变化的化学反应。
氧化是指原子或离子失去电子,还原是指原子或离子获得电子。
2. 电解质:电解质是指在溶液或熔融状态下能导电的物质。
2024年中考化学复习考点归纳总结—物质的分类(全国通用)知识点一、纯净物和混合物1.由单一物质组成的物质称为纯净物,如氧气(O2)、水(H2O)等。
2.由两种或两种以上不同物质组成的物质叫混合物,如空气、海水、合金等。
知识点二、单质和化合物1.按组成元素的种数又可以将纯净物分为单质和化合物。
2.单质:由同种元素组成的纯净物,如铜(Cu)、银(Ag)、氮气(N2)等。
3.化合物:由不同种元素组成的纯净物,如H2O、KClO3等。
化合物主要分为有机化合物和无机化合物。
(1)有机化合物是指含碳元素的化合物,如甲烷(CH4)、乙醇(C2H5OH)、蛋白质等。
(2)无机化合物是指不含碳元素的化合物。
但有些含碳化合物也属于无机物,包括CO、CO2、H2CO3、Na2CO3(碳酸盐)和NaHCO3(碳酸氢盐)等。
【易错辨析】(1)区分混合物和纯净物时不看元素种类,看物质种类。
相同的元素可组成不同的物质,如H2O 和H2O2等。
(2)冰水混合物是纯净物而不是混合物。
知识点三、氧化物、酸、碱、盐1.氧化物:由两种元素组成,其中一种元素是氧元素的化合物,如CO2、H2O等。
2.酸:在水溶液中解离出的阳离子全部为H+的化合物,如HCl、H2SO4等。
3.碱:在水溶液中解离出的阴离子全部为OH-的化合物,如NaOH、Ca(OH)2、NH3·H2O等。
4.盐:由金属阳离子(或NH4+)与酸根阴离子构成的化合物,如NaCl、NaHCO3、K2MnO4等。
【易错辨析】(1)含有氧元素的化合物不一定是氧化物,如H2SO4是酸而不是氧化物。
(2)酸性物质不一定是酸,碱性物质不一定是碱。
考点一.从组成上识别氧化物1.(2023•永州)分类是学习和研究化学的常用方法。
下列物质属于氧化物的是()A.O3B.KMnO4C.CaO D.H2SO4【解答】解:A.O3是由氧元素组成的单质,不属于氧化物,故选项错误;B.KMnO4是由钾元素、锰元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;C.CaO是由钙元素和氧元素组成的化合物,属于氧化物,故选项正确;D.H2SO4是由氢元素、硫元素和氧元素组成的化合物,由三种元素组成,所以不属于氧化物,故选项错误;故选:C。
九年级期中化学知识点归纳化学知识点归纳化学是一门研究物质的组成、性质、结构、变化以及变化过程的科学。
在九年级的化学学习中,我们学习了许多基础的化学知识点,下面将对这些知识点进行归纳和总结,帮助大家更好地理解和记忆。
一、物质的分类和性质1. 物质的分类:包括元素、化合物和混合物三种类型。
其中,元素是由相同类型的原子组成的纯物质;化合物由不同类型的原子以确定的比例结合而成;混合物是由两种或多种物质混合而成,其组成比例可以变化。
2. 物质的性质:包括化学性质和物理性质。
化学性质是物质在发生化学变化时所表现出来的性质,例如燃烧、腐蚀等;物理性质是物质在不发生化学变化时所表现出来的性质,例如颜色、密度等。
二、元素和化合物1. 元素:元素由同种类型的原子组成,具有一定的原子序数和原子量。
常见的元素包括氢、氧、碳、氮等。
元素可以通过化学符号进行表示,并可根据其物理和化学性质进行分类。
2. 化合物:化合物由不同类型的原子以确定的比例结合而成,具有独特的化学性质。
化合物可以通过化学式进行表示,例如水的化学式为H2O,二氧化碳的化学式为CO2。
三、化学反应1. 化学反应的基本概念:化学反应是指物质之间发生的化学变化过程,反应前的物质称为反应物,反应后的物质称为生成物。
2. 反应类型的分类:主要包括合成反应、分解反应、置换反应和化合反应等。
合成反应是指两个或多个物质在一定条件下生成一个新物质;分解反应是指一个化合物在一定条件下分解成两个或多个物质;置换反应是指两种物质中的原子或离子交换位置,形成新的化合物;化合反应是指物质之间发生化学反应,生成其他化合物。
四、离子和离子反应1. 离子的概念:离子是由带电的原子或原子团组成的,正离子带正电荷,负离子带负电荷。
2. 离子反应:在溶液中,离子具有活动性,可以与其他离子或分子发生反应。
常见的离子反应包括酸碱中和反应、离子交换反应等。
五、常见化学实验1. 酸碱中和反应:酸和碱反应产生盐和水。