纳米微粒制备实验
- 格式:doc
- 大小:9.29 MB
- 文档页数:13



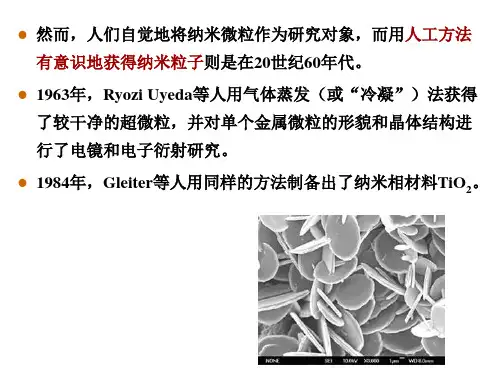
ZnS∶Cu纳米颗粒的制备及发光性质3孙远光,曹立新,柳 伟,苏 革,曲 华,姜代旬(中国海洋大学材料科学与工程研究院,山东青岛266100)摘 要: 采用水热法制备了Cu离子掺杂的ZnS (ZnS∶Cu)纳米颗粒,研究了锌硫比和反应时间对ZnS∶Cu纳米颗粒光致发光性质的影响。
通过X射线衍射(XRD)和透射电子显微镜(TEM)对样品的物相和形貌进行分析表征,发现该方法得到立方闪锌矿结构的球形ZnS∶Cu纳米晶,粒径在1~6nm之间。
室温下,用350nm波长的紫外光激发ZnS∶Cu纳米粒子,可以得到归属于浅施主能级与铜t2能级之间的跃迁产生的绿色发光,发光强度随锌硫比的增大和反应时间的延长先增强后减弱,发射峰位随锌硫比和反应时间的变化有一定移动。
认为浅施主能级为与硫空位有关的能级,锌硫比和反应时间对硫空位的数量和能级位置有一定影响。
关键词: ZnS∶Cu纳米晶;水热法;光致发光中图分类号: O611.4;O614.24文献标识码:A 文章编号:100129731(2009)04206892041 引 言ZnS是一种性能优越的Ⅱ2Ⅵ族发光材料,禁带宽度为3.66eV。
属于直接带结构半导体,在荧屏显示领域已有广泛应用。
近年来,随着纳米材料研究的深入,国内外对ZnS纳米发光材料已进行了多方面的研究,当ZnS中掺入稀土离子或过渡金属离子(如掺Mn[1]、Cu[2~8]、Ag[9])作为激活剂时,可改变基质内部能带结构,形成各种不同的发光能级。
例如,铜离子作为ZnS的激活剂时,在4个硫离子形成的四面体晶体场中,铜的3d9基态分裂为较高的t2能级和较低的e 能级。
相对于锰掺杂,关于铜掺杂ZnS的研究较少,具体到纳米级光致发光材料,就更少了。
纳米级ZnS∶Cu粒子可以用多种方法制备,但不同的工艺形成不同的能级,引起其发光性质的不同。
例如,刘昌辉等[3]研究了硫脲和硫代硫酸钠体系中, Cu+掺杂浓度为0.6%时发射达到最强.该发射峰随掺杂浓度的提高和微粒生长时间的延长而红移;当Cu+掺杂浓度为0.2%时,ZnS∶Cu纳米微粒还产生一个位于450nm的蓝色发射带,该发射带在掺杂浓度更高时被猝灭。


一、引言纳米颗粒是指直径小于100纳米的微粒子,具有较大的比表面积和量子尺寸效应等特性,广泛应用于医学、材料科学、能源、环境保护等领域。
其中,Fe3O4纳米颗粒具有磁性、生物相容性和化学稳定性等优良特性,因此被广泛应用于生物医学领域中。
二、研究现状Fe3O4纳米颗粒的合成方法主要包括化学共沉淀法、水热法、溶胶-凝胶法、氢热还原法等。
其中,化学共沉淀法是一种常用的合成方法,但其制备过程中需要使用大量的化学试剂,且存在产物结晶不完全、粒径分布不均匀等问题。
因此,近年来研究人员开始关注使用可再生和环境友好的方法制备Fe3O4纳米颗粒。
三、可再生合成方法目前,可再生合成方法主要包括植物提取物辅助合成法、微生物辅助合成法等。
其中,植物提取物辅助合成法具有操作简单、环境友好等优点。
研究人员发现,某些植物提取物中含有的多酚、蛋白质等有机分子可以作为还原剂和稳定剂,用于Fe3O4纳米颗粒的合成。
四、植物提取物辅助合成法1. 实验步骤(1)制备植物提取物:将干燥的植物材料粉碎并加入无水乙醇中浸泡过夜,随后离心收集液体部分即可得到植物提取物。
(2)制备Fe3O4纳米颗粒:将适量的FeCl3和FeCl2混合溶液滴加到植物提取物中,并进行超声处理。
随着反应时间的增加,产物会逐渐由棕色转变为黑色。
(3)分离和洗涤:通过磁性分离器将Fe3O4纳米颗粒分离出来,并使用无水乙醇将其洗涤干净。
(4)表征:使用扫描电子显微镜、透射电子显微镜、X射线衍射等方法对合成的Fe3O4纳米颗粒进行表征并确定其粒径和形貌等性质。
2. 实验结果通过实验,研究人员成功合成了具有较好分散性和稳定性的Fe3O4纳米颗粒。
经过表征发现,其平均粒径为20纳米左右,呈球形或椭圆形,并且具有良好的磁性。
五、结论通过植物提取物辅助合成法,可以制备出具有良好分散性和稳定性的Fe3O4纳米颗粒。
该方法具有操作简单、环境友好等优点,并有望应用于生物医学等领域中。
但是,目前该方法仍面临一些问题,如产物粒径分布不均匀、反应时间长等,需要进一步改进和优化。


纳米材料——微乳液法制备纳米微粒微乳液法的概述:微乳液法是利用两种互不相溶的溶剂在表面活性剂的作用下形成均匀的乳液,从乳液中析出固相从而制备出一定粒径的纳米粉体。
但相对于细乳液和普通乳液而言的,微乳液颗粒直径约为l0~lOOnm,细乳液颗粒直径约为lO0~400nm,普通乳液颗粒直径一般在几百纳米到上千纳米。
一般情况下,将两种互补相溶的液体在表面活性剂作用下所形成的热力学稳定、各项同性、外观透明或半透明、粒径l~lOOnm 的分散体系称为微乳液。
相应的把制备微乳液的技术称为微乳化技术(MET)。
1982年Boutonmt首先报道了应用微乳液制备出了纳米颗粒:用水合肼或者氢气还原在w/0型微乳液水合中的贵金属盐,得到了分散的Pt、Pd、Ru、Ir 金属颗粒(3~40nm)。
从此以后,微乳液理论的研究获得了飞速发展,尤其是2O世纪9O年代以来,微乳液应用研究更快,在许多领域如3次采油、污水治理、萃取分离、催化、食品、生物医药、化妆品、材料制备、化学反应介质,涂料等领域均具有潜在的应用前景。
微乳液法是一种简单易行而又具有智能化特点的新方法,是目前研究的热点。
运用微乳液法制备纳米粉体是一个非常重要的领域。
运用微乳液法制备的纳米颗粒主要有以下几类。
:(1)金属,如Pt、Pd、Rh、Ir、Au、Ag、Cu等;(2)硫化物CdS、PbS、CuS等;(3)Ni、Co、Fe等与B的化合物;(4)氯化物AgC1、AuC1 等;(5)碱土金属碳酸盐,如CaCO3、BaCO3、Sr—CO3;(6)氧化物Eu2O 、Fe2O。
、Bi2O 及氢氧化物如Al(0H)3 等。
1 微乳反应器原理在微乳体系中,用来制备纳米粒子的一般都是W/O型体系,该体系一般由有机溶剂、水溶液、活性剂,助表面活性剂4个组分组成。
常用的有机溶剂多为C6~C8直链烃或环烷烃;表面活性剂一般为A0T(2一乙基己基磺基琥珀酸钠)、SDS(十二烷基硫酸钠)阴离子表面活性剂、SDBS(十六烷基磺酸钠)阴离子表面活性剂、CTAB(十六烷基三甲基溴化铵)阳离子表面活性剂、TritonX(聚氧乙烯醚类)非离子表面活性剂等;助表面活性剂一般为中等碳链C5~C8的脂肪酸。



纳米颗粒的化学制备方法纳米颗粒的各种化学制备方法及例举本文通过查阅图书馆中文数据库(CNKI)和外文数据库(Elsevier)相关资料,对纳米粒子的化学制备方法,如:沉淀法、溶胶-凝胶法、溶液蒸发法、化学气相沉积法和模板合成法等分别进行了举例说明,并对其各种化学制备方法的基本原理、化学反应及制备过程进行了简要的描述。
一.沉淀法1、共沉淀法Fe3O4磁性纳米粒子的共沉淀法制备研究陈亭汝青岛大学化学化工与环境学院孙瑾烟台南山学院以液相共沉淀法制备纳米磁性Fe3O4粒子的工艺,研究了反应搅拌速度、n(Fe3+ ) /n(Fe2+)的比例、pH值和熟化温度对制备纳米Fe3O4粒子的影响,并利用透射电镜表征观察Fe3O4纳米粒子的形貌。
研究结果表明,在搅拌速度较快的情况下制备纳米级Fe3O4颗粒的最佳合成工艺条件为:n(Fe3+)/n(Fe2+)为1﹒8:1(摩尔比),熟化温度70 ℃,熟化时间30 m in以氨水作沉淀剂最佳pH值是9左右,可制得纯度较高,粒径小于10nmFe3O4磁性粒子。
(1)制备原理搅拌速度的影响纳米颗粒可以自动的进行团聚降低本身的能量,适当的搅拌速度可以破坏团聚体中小微粒之间的库仑力和范德华力,有利于纳米微粒在混合溶液中保持稳定和分散均匀。
由于搅拌速度的加快有利于反应物之间的充分接触,能避免搅拌不均而产生的局部浓度过高,使晶核生成和长大都均匀地进行,从而粒径小且分布均匀。
因此较高的搅拌速度有利于合成较小粒径的纳米粒子。
(2)试剂及反应方程式试剂:FeCl3*6H20, FeCl2*4H20, NH3*H20, NaOH,柠檬酸、尿素均为分析纯。
反应方程式采用液相共沉淀法制备纳米Fe3O4 的反应原理如下:Fe2+ + 2Fe3+ + 8OH-- =Fe3O4 +4H2O(3)制备工艺过程如下图2、均匀沉淀法均匀沉淀法合成纳米氧化铁欧延,邱晓滨,许宗祥,林敬东,廖代伟厦门大学物理化学研究所,化学系,固体表面物理化学国家重点实验室以尿素为均匀沉淀剂、氯化铁为原料,采用均匀沉淀法在不同的条件下合成具有实用价值的a型纳米氧化铁.用XRD和TEM测定产品的形貌并确定产品的纳米尺度.实验表明,所合成的Fe2O3为α型,粒径在20~40 nm范围,且分散性好.(1)制备原理采用均匀沉淀法,利用尿素高温发生水解反应(1)(如下),缓慢生成构晶离子,随着反应的缓慢进行,溶液的pH值逐渐上升.Fe3+和OH一反应,并在溶液的不同区域中均匀地形成铁黄粒子,尿素的分解速率直接影响了形成铁黄粒子的粒度,而尿素的分解速率又由反应温度所决定.温度很低时,离子具有的能量较低,晶粒生成速度很小,虽然有利于形成稳定的晶粒,但反应速度太慢,使得粒径大且分布不均匀.反应温度升高则反应速度加快,晶粒形成的速度也加快,但温度过高,一方面溶液的过饱和度下降,同时不利于形成稳定的晶粒,晶粒生成速度反而下降.(2)反应方程式(3)合成过程二.溶液蒸发法1.冷冻干燥法冷冻干燥法制备氧化铜纳米粉体的实验研究刘军东北大学机械工程与自动化学院徐成海沈阳大学师范学院利用冷冻干燥法,以无机化合物硫酸铜和氢氧化钠为原料,选取铜氨络合物为前驱体,制备出了粒径为20~50nm的氧化铜粉和带有均匀~10nm孔隙的多孔颗粒材料,并进行了TEM 和SEM检测。
纳米材料微乳液法制备纳米微粒微乳液法的概述:微乳液法是利用两种互不相溶的溶剂在表面活性剂的作用下形成均匀的乳液,从乳液中析出固相从而制备出一定粒径的纳米粉体。
但相对于细乳液和普通乳液而言的,微乳液颗粒直径约为10〜100nm细乳液颗粒直径约为I00~400nm,普通乳液颗粒直径一般在几百纳米到上千纳米。
一般情况下,将两种互补相溶的液体在表面活性剂作用下所形成的热力学稳定、各项同性、外观透明或半透明、粒径I 〜I00nm 的分散体系称为微乳液。
相应的把制备微乳液的技术称为微乳化技术(MET)。
982年Bout onmt首先报道了应用微乳液制备出了纳米颗粒:用水合肼或者氢气还原在w/0型微乳液水合中的贵金属盐,得到了分散的Pt、Pd、Ru Ir金属颗粒(3~40nm) 。
从此以后, 微乳液理论的研究获得了飞速发展, 尤其是20世纪90年代以来,微乳液应用研究更快,在许多领域如3次采油、污水治理、萃取分离、催化、食品、生物医药、化妆品、材料制备、化学反应介质,涂料等领域均具有潜在的应用前景。
微乳液法是一种简单易行而又具有智能化特点的新方法,是目前研究的热点。
运用微乳液法制备纳米粉体是一个非常重要的领域。
运用微乳液法制备的纳米颗粒主要有以下几类。
:(1) 金属, 如Pt、Pd、Rh Ir、Au、Ag、Cu等; (2)硫化物CdS PbS CuS等; (3)Ni、Co、Fe 等与B 的化合物;(4) 氯化物AgC1、AuC1 等;(5) 碱土金属碳酸盐,如CaC0、3 BaC03、Sr—C03;(6) 氧化物Eu20 、Fe20。
、Bi20 及氢氧化物如AI(0H)3 等。
1 微乳反应器原理在微乳体系中, 用来制备纳米粒子的一般都是W/ 0型体系, 该体系一般由有机溶剂、水溶液、活性剂,助表面活性剂4个组分组成。
常用的有机溶剂多为C6〜C8直链烃或环烷烃;表面活性剂一般为A0T(2一乙基己基磺基琥珀酸钠)、SDS(十二烷基硫酸钠)阴离子表面活性剂、SDBS十六烷基磺酸钠)阴离子表面活性剂、CTAB(十六烷基三甲基溴化铵)阳离子表面活性剂、TritonX( 聚氧乙烯醚类) 非离子表面活性剂等;助表面活性剂一般为中等碳链C5〜C8的脂肪酸。
实验技术中的纳米材料制备与测试方法的经验总结的纳米颗粒合成与表征方法实验技术中的纳米材料制备与测试方法的经验总结随着纳米科技的迅猛发展,纳米材料的制备与表征成为了研究人员关注的焦点之一。
本文将从纳米颗粒合成与表征两个方面,总结实验技术中的一些常用方法与技巧。
一、纳米颗粒合成1. 溶液法合成纳米颗粒溶液法是目前最常用的纳米颗粒合成方法之一。
其中,溶剂选择很关键,常见的有水相和非水相溶剂。
对于需要控制粒径和形状的纳米颗粒,可以采用胶体溶液法或微乳液法。
在合成过程中,注意控制沉淀温度,搅拌速度和溶剂的添加速率,以获得所需的纳米颗粒。
2. 气相法合成纳米颗粒气相法合成纳米颗粒是利用气态反应物质在高温下形成微粒,然后通过冷却凝聚形成纳米颗粒。
常见的气相法有气相凝聚法和气相沉积法。
合成过程中,需控制反应温度、气体流量和压力,以及反应物质的浓度和成分,来控制纳米颗粒的尺寸和结构。
3. MOCVD法合成纳米薄膜金属有机化合物化学气相沉积(MOCVD)方法在纳米薄膜合成中被广泛应用。
该方法通过热分解有机金属化合物在基底上沉积出纳米薄膜。
在选择反应气体时,考虑到有机金属前体的热分解特性和基底的适应性,并控制反应温度和气流速度,可以得到具有高纯度和均匀性的纳米薄膜。
二、纳米颗粒表征方法1. 透射电子显微镜(TEM)TEM是一种常用的纳米颗粒形态观察技术。
通过透射电子照射样品,利用电子-物质相互作用信息,可以获得纳米颗粒的形貌、大小以及晶体结构等信息。
在样品制备过程中,需仔细控制样品的制备温度和湿度,避免因样品制备不当而引入错误。
2. 扫描电子显微镜(SEM)SEM是观察纳米颗粒表面形貌和结构的重要手段。
与TEM相比,SEM能够提供更高的分辨率和更大的观察范围。
在使用SEM时,需注意样品的制备和金属涂覆的均匀性,以及电子束的加速电压和探针电流的选择。
3. X射线衍射(XRD)XRD是用于分析纳米颗粒结构和晶体性质的主要方法之一。
HT-218型纳米微粒制备实验仪使用说明书一.基本原理纳米科学技术是20世纪80年代末期刚刚诞生并正在迅速发展的新科技。
它是研究由尺寸在0.1~100纳米之间的物质组成体系的运动规律和相互作用以及可能的实际应用中的技术问题的科学技术,也是一个融前沿科学和高技术于一体的完整体系。
在整个纳米科技的发展中,纳米颗粒的制备和微粒性质的研究是最早开展的。
微粒制备的方法很多,按制备方法可分为物理方法和化学方法。
按制备路径分,或分为粉碎法和聚集法。
本实验仪采用电阻加热,气体冷凝法制备纳米微粒。
图中显示蒸汽冷凝法制备纳米微粒的过程。
首先利用抽气泵(真空泵)对系统进行真空抽吸,并利用隋性气体进行置换。
惰性气体为高纯Ar,He等,有些情形也可以考虑用N2气。
经过几次置换后,将真空反应室内保护气的气压控制至所需的参数范围,通常约为0.1kPa 至10kPa范围,与所需粒子路径有关。
当原材料被加热至蒸发温度时蒸发为气相。
气相的原材料原子与惰性气体的原子(或分子)碰撞,迅速降低能量而骤然冷却。
骤冷使得原材料的确蒸气中形成很高的局域过饱和,非常有利于成核。
成核与生长过程都是在极短的时间内发生的,首先形成原子簇,然后继续生长成纳米微晶,最终在收集器上收集到纳米粒子。
二.仪器组成如图所示纳米微粒制备实验仪外型图仪器照片实验仪器玻璃真空罩G置于食品顶部真空橡皮圈的上方。
平时真空罩内保持一定程度的低气压,以维护系统的清洁。
当需要制备微粒时,打开阀门V2让空气进入真空室,使得真空室内外气压相近即可掀开真空罩。
真空罩下方真空室底盘P的上部倒置了一只玻璃烧杯F,用作纳料微粒的收集器。
两个铜电极I之间可以接上随机附带的螺旋状钨丝H。
铜电极接至蒸发速率控制单元,若在真空状态下或低气压惰性气体状态下启动该单元,钨丝上即通过电流并可获得1000ºC以上的高温。
真空底盘P开有四个孔,孔的下方分别接有气体压力传感器E,以及连接阀门V1,V2和电磁阀门Ve的管道。
气体压力传感器E连结至真空度量单元,并在数字显示表M1上直接显示实验过程中真空室内的气体压力。
阀门V1通过管道与仪器后侧惰性气体接口连接,实验时可利用V1调整气体压力,亦可借助Ve调整压力。
阀门V2的另一端直通大气,主要为打开钟罩而设立。
电磁阀Ve的另一端接至抽气单元并由该单元实行抽气的自动控制,以保证抽气的顺利进行并排除真空泵油倒灌进入真空室。
蒸发控制单元的加热功率控制钮置于仪器面板上。
调节加热器时数字显示表M2直接显示加热功率。
三.主要技术指标真空度<0.01kPa气体压力测量范围0.01kPa~120kPa 四位半数字显示加热功率0~200w功率测量三位半数字显示电源220V 50Hz四.操作步骤①准备工作②⑴检查仪器系统的电源接线,惰性气体连结管道是否正常。
惰性气体最好用高纯Ar气,亦可考虑使用化学性质不活泼的高纯N2气。
③⑵利用脱脂白绸布,分析纯酒精,仔细擦净真空罩以及罩内的底盘,电极和烧杯。
④⑶将螺旋状钨丝接至铜电极。
⑤⑷从样品盒中取出铜片(用于纳米铜粉制备),在钨丝的每一圈上挂一片,罩上烧杯。
⑥⑸罩上真空罩,关闭阀门V1,V2,将加热功率旋钮沿逆时针方向旋至最小,合上电源总开关S1。
此时真空度显示器显示出与大气压相当的数值,而加热功率显示为零。
由于HT-218预置了不当操作报警,如果回执功率钮示调节到最小,蜂鸣器将持续发出信号直至纠正为止。
⑦⑹合上开关S2,此时抽气单元开始工作,电磁阀Ve自动接通,真空室内压力下降。
下降至一定值时关闭S2,观察真空度是否稳定在该值附近,如果真空度持续变差,表明存在漏气因素,检查V1,V2是否关闭。
正常情况下不应漏气。
⑧⑺打开阀门V1,此时惰性气体进入真空室,气压随之变大。
⑨⑻熟练上述抽气与供气的操作过程,直至可以按实验的要求调节气体压力为止。
⑩⑼准备好备用的干净毛刷和收集纳米微粉的容器。
②制备铜纳米微粒⑴关闭V1,V2阀门,对真空室抽气至0.05kPa附近。
⑵利用氩气(或氮气)冲洗真空室。
打开阀门V1使氩气进入真空室,边抽气边进气(氩气或氮气)约5分钟。
⑶关闭阀门V1,观察真空度至0.13kPa附近时关闭S2,停止抽气。
此时真空度应基本稳定在0.13kPa附近。
⑷沿顺时针方向缓慢旋转功率旋钮,观察加热功率显示器,同时关注钨丝。
随着加热功率的逐渐增大,钨丝逐渐发红进而变亮。
当温度达到铜片(或其它材料)的熔点时铜片熔化,并由于表面张力的原因,浸润至钨丝上。
⑸继续加大加热功率时可以见到用作收集器的烧杯表面变黑,表明蒸发已经开始。
随着蒸发过程的进展,钨丝表面的铜液越来越少,最终全部蒸发掉,此时应立即将加热功率调到最小。
⑹打开阀门V2使空气进入真空室,当压力与大气压相近时,小心移开真空罩,取下作为收集罩的烧杯。
用刷子轻轻地将一层黑色粉末刷至烧杯底部再倒入备好的容器,贴上标签。
收集到的细粉既是纳米铜粉。
⑺在2×0.13kPa,5×0.13kPa,10×0.13kPa,及30×0.13kPa处重复上述实验制备,并记录每次蒸发时的加热功率,观察每次制备时蒸发情况有何差异。
注:可将微粒粒径作如下检测⑴利用X线衍射仪进行物相分析,确定晶格常数并与大晶粒的同种材料进行对比。
⑵比较纳米粉与大晶粒同种材料的衍射线半高峰宽,判断不同气压下制备的材料的晶粒平均尺寸。
给出气压与晶粒尺寸之间的关系。
⑶有条件的可进行TEM观察,选取有代表性的电镜照片作出微粒尺寸与颗粒娄分布图。
也可用超声波清洗机进行乳化,进行观察和比较。
既可制备金属如金,银,铜,铝,镍等材料,也可制备氧化物,塑料及高分子材料等。
制备粒度在10nm至200nm不等,每次约10~100mg蒸汽冷凝法制备纳米微粒引言20世纪80年代末以来,一项令世人瞩目的纳米科学技术正在迅速发展。
纳米科技将在21世纪促使许多产业领域发生革命性变化。
关注纳米技术并尽快投入到与纳米科技有关的研究,是本世纪许多科技工作者的三中三中历史使命。
在物理学发展的历史上,人类对宏观领域和微观领域已经进行了长期的,不断深入的研究。
然而介于宏观和微观之间的所谓介观领域却是一块长期以来未引起人们足够重视的领域。
这一领域的特征是以相干量子输运现象为主,包括团簇,纳米体系和亚微米体系,尺寸范围为1~1000nm 。
但习惯上人们将100-1000nm范围内有关现象的研究,特别是电输运现象的研究领域称为介观领域。
因而1-100nm的范围就是指纳米尺度,在此范围的研究领域称为纳米体系(图8.4-1)。
纳米科技正是指在纳米尺度上研究物质的特性和相互作用以及利用这些特性的科学技术。
经过几十年的急速发展,纳米科技已经形成纳米物理学,纳米化学,纳米生物学,纳米电子学,纳米材料学,纳米力学和纳米加工学等学科领域。
纳米材料与宏观材料相比具有以下的一些特殊效应。
⒈小尺寸效应纳米材料的尺寸与光波波长,德布罗意波长以及超导态的相干长度或透射尝试等物理特征尺寸相当或更小,宏观晶体的周期性边界条件不再成立,导致材料的声,光,电,磁,热,力学等特性呈现小尺寸效应。
例如各种金属纳米颗粒几乎都显现黑色,表明光吸收显著增加:许多材料存在磁有序向无序转变,导致磁学性质异常的现象;声子谱发生改变,导致热学,电学性质显著改变。
曾有人人利用高分辨率电子显微镜追踪拍摄超细微粒,观察到微粒的外形,结晶态不停的变化,特定界面的原子不断地脱离平衡位置又不停地返回平衡位置,呈现出与常规材料不同的特性,被称为living particle。
纳米微粒之间甚至在室温下就可以合二而一,它们的熔点降低自然是意料之中的结果。
图8.4-2为金属微粒熔点与尺寸的关系图8.4-2⒉表面效应以球形颗粒为例,单位质量材料的表面积(称为比表面积)反比于该颗粒的半径。
因此当半径减小时比表面积增大。
例如将一颗直径1μm的颗粒分散成直径10nm的颗粒,颗粒数变为100万颗,总比表面积增大100倍。
表面原子数比例,表面能等也相应地增大,从而表面的活性增高。
潜逃的金属纳料颗粒往往会在室温环境的空气中燃烧(表面有薄层氧化物时相对稳定),这是必须面对的问题,但是反过来也为优良的催化剂提供了可能。
⒊量子尺寸效应传统的电子能带理论表明,金属费米能级附近电子能级是连续的。
但是按照著名的久保理论,低温下纳米微粒的能级不连续。
相邻电子能级间距δ与微粒直径相关。
NE F 34=δ (8.4-1) 式中N 为一个微粒所含的导电电子数,F E 为费米能 ()32232n m E F π = (8.4-2)式中 为普朗克常数,m 为电子质量,n 为电子密度。
若将微粒简单地看作球形的,则近似地31d ∝δ (8.4-3)D 为直径。
由此可见随着微粒直径变小,电子能级间距变大。
久保理论中提及的低温效应应按如下标准判断,即只在B K >δ时才会产生能级分裂,式中K B 为玻尔兹曼常数,T 为绝对温度。
这种当大块材料变为纳米微粒时金属费米能级附近的电子能级由准连续变为离散能级的现象称为量子尺寸效应。
当能级间距大于热能,磁能,静磁能,静电能,光子能量或超导态凝聚能时,微粒的磁电光热以及超导电性均会与大块材料有显著不同。
以Cu 纳米微粒为例,其导电性能即使在室温下也明显下降。
对于半导体微粒,如果存在不连续的最高被占据分子轨道和最低未被占据的分子轨道能级,能隙变宽现象等亦称为量子尺寸效应。
⒋宏观量子隧道效应微观粒子具有穿透势垒的几率,称为隧道效应。
近年来,人们发现一些宏观量,例如小颗粒的磁化强度,量子相干器件中的磁通量等亦具有隧道效应,称为宏观量子隧道效应。
宏观量子隧道效应对纳米科技有着重要的价值,它是纳米电子学发展的重要依据。
此外,近十年来,尚有“库仑堵塞与量子隧穿”,“介电限域效应”等新效应被发现。
上述各种效应使得纳米材料呈现出与宏观材料显著不同的特性,甚至出现一些反常的现象,更加吸引着人们开拓和探索这一引人入胜的学科领域。
在整个纳米科技的发展过程中,纳米微粒的制备和微粒性质的研究是最早开展的。
时至今日,纳米科技的领域已经迅速地扩大和深入,但要进入纳米领域,最好还是从纳米微粒的制备与测量起步。
一.实验目的⒈学习和掌握利用蒸汽冷凝法制备金属纳米微粒的基本原理和实验方法,研究微粒尺寸与惰性气体气压之间的关系。
⒉学习利用电子成像法,X 射线衍射峰宽法或其它方法测量微粒的粒径。
二.实验仪器(参见HT-218型纳米微粒制备实验仪使用说明书)纳米微粒制备实验利用南京大学恒通公司研制的HT-218型纳米微粒制备实验仪进行,该仪器的原理图示于图8.4-7。
玻璃真空罩G置于食品顶部真空橡皮圈的上方。
平时真空罩内保持一定程度的低气压,以维护系统的清洁。
当需要制备微粒时,打开阀门V2让空气进入真空室,使得真空室内外气压相近即可掀开真空罩。