第四章 酸碱滴定法
- 格式:doc
- 大小:248.50 KB
- 文档页数:11









第四章酸碱滴定法第四章酸碱滴定法酸碱滴定法(acid-base titrations)是以⽔溶液中的质⼦转移反应为基础的滴定分析⽅法。
⼀般酸、碱以及能与酸碱直接或间接发⽣质⼦反应的物质,⼏乎都可以⽤酸碱滴定法测定。
因此,酸碱滴定法是分析化学的基础内容之⼀。
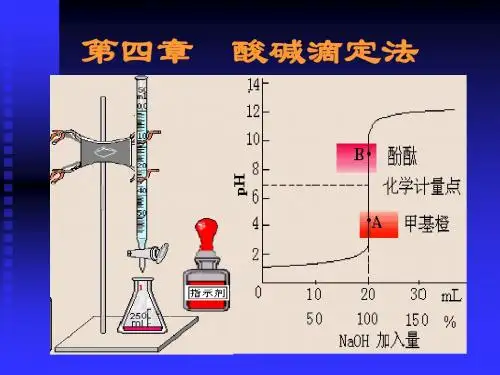
这个⽅法的关键问题是计量点的确定。
因为酸碱反应通常不发⽣外观的变化,在滴定中需选⽤适当的指⽰剂,利⽤它的变⾊作为到达计量点的标志。
因为不同的指⽰剂的变⾊有其不同的pH,⽽不同类型的酸碱反应的计量点时pH⼜不相同,为了正确地确定计量点,就需要选择⼀个刚好能在计量点时变⾊的指⽰剂。
要解决这个问题,必须了解滴定过程中溶液pH的变化情况。
因此,在学习酸碱滴定时,不仅要了解指⽰剂的变⾊原理和变⾊范围,同时也要了解滴定过程中溶液pH的变化规律和指⽰剂的选择原则,以便能正确地选择合适的指⽰剂,获得准确的分析结果。
基于上述原因,我们先讨论酸碱溶液平衡的基本原理,然后再介绍酸碱滴定中的理论及应⽤。
第⼀节⽔溶液中的酸碱平衡⼀、酸碱的质⼦理论根据质⼦理论,凡能给出质⼦(H+)的物质是酸,能接收质⼦的物质是碱。
酸碱关系可⽤下式表⽰:酸HA与碱A-处于⼀种相互依存的关系中,即:HA失去质⼦转化为它的共轭碱A-,A-得到质⼦后,转化为它的共轭酸HA,则HA与A-被称为共轭酸碱对。
如:由上述酸碱的半反应可知:酸碱可以是中性分⼦,也可以是阳离⼦或阴离⼦,酸碱是相对的。
⼜如:离⼦(H2PO4-)在H3PO4-H2PO4-共轭体系中为碱,⽽在H2PO4--HPO42-共轭体系中为酸。
同⼀物质在某些场合是酸,⽽在另⼀场合是碱,其原因是共存物质彼此间给出质⼦能⼒相对强弱不同。
因此同⼀物质在不同的环境(介质或溶剂)中,常会引起其酸碱性的改变。
既能给出质⼦⼜能接受质⼦的物质称为两性物质。
酸碱质⼦理论认为,酸碱反应的实质是质⼦转移。
例如HAc在⽔中离解,溶剂⽔就起着碱的作⽤,否则HAc⽆法实现其在⽔中的离解,即质⼦转移是在两个共轭酸碱对间进⾏。
第四章酸碱滴定法1.下列各酸,哪些能用NaOH溶液直接滴定或分步滴定? 哪些不能?如能直接滴定,各应采用什么指示剂?(1)甲酸(HCOOH)K a=1.8×10-4(2)硼酸(H3BO3) K a1=5.4×10-10(3)琥珀酸(H2C4H4O4)K a1=6.9×10-5 ,K a2=2.5×10-6(4)柠檬酸(H3C6H5O7)K a1=7.2×10-4 ,K a2=1.7×10-5 ,K a3=4.1×10-7(5)顺丁烯二酸K a1=1.5×10-2 ,K a2=8.5×10-7(6)邻苯二甲酸K a1=1.3×10-3 ,K a2=3.1×10-6答:(1)cK a≥10-8,可以直接滴定,酚酞。
(2)cK a≤10-8,不能直接滴定。
可用甘油或甘露醇等多元醇与H3BO3配位增加酸的强度。
(3)cK a1>10-8,cK a2>10-8,但K a1 /cK a2<104,不能分步滴定,一个突跃,酚酞。
(4)cK a1>10-8,cK a2>10-8,cK a3≈10-8,cK a1 / cK a2<104,cK a2 / cK a3<104,不能分步滴定。
(5)cK a1>10-8,cK a2>10-8,cK a1 / cK a2>104,能分步滴定,二个突跃,先用甲基橙,再用酚酞。
(6)cK a1>10-8,cK a2>10-8,cK a1 / cK a2<104,不能分步滴定,一个突跃,酚酞。
2.NaOH标准溶液吸收了空气中的CO2,当用于滴定(1)强酸(2)弱酸时,对滴定的准确度各有何影响?答:(1)滴定强酸时:若用甲基橙:CO32-→ H2CO3,消耗2molH+,无影响。
若用酚酞:碱性变色,CO32-→ HCO3-,消耗1molH+,结果偏低。
(2)滴定弱酸时:计量点pH>7,只能用酚酞,结果偏低。
3.标定HCl溶液时,若采用(1)部分风化的Na2B4O7∙10H2O;(2)部分吸湿的Na2CO3;(3)在110℃烘过的Na2CO3,则标定所得的浓度偏低、偏高,还是准确?为什么?答:(1)偏低;(2)偏高;(3)偏高。
4.为什么用盐酸可滴定硼砂而不能直接滴定醋酸钠?又为什么用氢氧化钠可滴定醋酸而不能直接滴定硼酸?解:(1)Na2B4O7∙10H2O可看成是H3BO3和NaH2BO3按1:1组成的,则B4O72-+5H2O=2H2BO3-+2H3BO3H2BO3-的145b10101018105410.K..---⨯==⨯⨯,由于cK b>10-8,故可用HCl标准溶液滴定。
而NaAc的1410b5101059101710.K..---⨯==⨯⨯,由于cK b<10-8,故不能用HCl标准溶液直接滴定。
(2)同上,因为HAc的K a=1.7×10-5,cK a>10-8,所以可用NaOH滴定;而硼酸H3BO3的实际形式为HBO2∙H2O,K a=5.4×10-10,cK a<10-8,故不能用NaOH标准溶液直接滴定。
5.酸碱指示剂的变色原理是什么?什么是变色范围?选择指示剂的原则是什么?6.试用酸碱质子理论解释水分对非水溶液滴定酸或碱的影响。
答:水分对非水溶液滴定酸或碱有影响。
因为水既可以接受质子,又可给出质子,从质子理论的观点看来,水既是酸性杂质,又是碱性杂质。
所以在非水滴定中,无论滴定的物质是酸还是碱,水均消耗较多的标准溶液。
7.在下列何种溶剂中,醋酸、苯甲酸、盐酸及高氯酸的酸强度都相同?(1)纯水;(2)浓硫酸;(3)液氨;(4)甲基异丁酮8.用非水酸碱滴定法测定下列样品,应选择何种溶剂、指示剂、标准溶液?①醋酸钠;②苯甲酸;③磺胺嘧啶;④枸橼酸钠;⑤苯酚解:显酸性的:②、⑤显碱性的:①、③、④9.下列溶剂中何者为质子溶剂?何者为无质子溶剂?若为质子溶剂,是酸性溶剂还是碱性溶剂?若为无质子溶剂,是偶极亲质子溶剂还是惰性溶剂?(1)冰醋酸;(2)二氧六环;(3)乙二胺;(4)甲基异丁酮;(5)苯;(6)水;(7)乙醚;(8)异丙醇;(9)丙酮;(10)丁胺。
10.若要对苯酚、HAc、水杨酸、HClO4进行区分滴定,应选用何种溶剂、滴定剂?答:以甲基异丁酮(p K s>30)为溶剂,以氢氧化四丁胺为滴定剂。
11.试设计测定下列混合物中各组分的方法,写出滴定原理、指示剂、操作步骤及计算公式。
(1)HCl和H3PO4;(2)HCl和硼酸;(3)HCl和NH4Cl;(4)HCl和HAc;(5)Na3PO4和NaOH;(6)Na3PO4和Na2HPO4;(7)NaHSO4和NaH2PO4;(8)NH3∙H2O和NH4Cl 答:(1)HCl和H3PO4;均可滴定。
先用甲基橙,变色时V1(HCl→H2O,H3PO4→H2PO4-)再用酚酞,变色时V2(H2PO4-→HPO42-)(2)HCl和硼酸;H3BO3的K a=7.3×10-10,不能用NaOH滴定,而加入甘油后可用NaOH直接滴定。
所以,可先用NaOH标准溶液滴定HCl,以甲基橙为指示剂,由红变黄,记下体积,可求出HCl的含量;再将适量的甘油加入后摇匀,加入酚酞指示剂,用NaOH标准溶液滴定至粉红色,记下体积即可测定硼酸的含量。
(3)HCl和NH4Cl;①NH4+的p K a=9.25,不能用NaOH滴定,用NaOH标准溶液滴定HCl完全后,溶液NH4++NaCl(pH≈5.2),甲基红。
②再用NH4Cl与甲醛反应释放H+,酚酞,用NaOH滴定。
(4)HCl和HAc;①用NaOH标准溶液,甲基黄为指示剂,滴至NaCl+HAc,求HCl;②用NaOH标准溶液,酚酞为指示剂,滴至NaCl+NaAc,求HAc。
(5)Na3PO4和NaOH;方法1:①用HCl标准溶液,百里酚酞为指示剂滴定至无色,滴至Na2HPO4+NaCl,V1;②用HCl标准溶液,甲基橙为指示剂滴定至橙色,①生成的Na2HPO4→NaH2PO4,V2。
Na3PO4→V2,NaOH→V1-V2方法2:①甲基橙为指示剂,用HCl溶液滴定至溶液由黄变橙,所用HCl溶液的体积V1。
消耗HCl的物质的量等于2n(Na3PO4)+ n(NaOH)。
②另一份待测液,百里酚酞指示剂,用HCl溶液滴定至蓝色忽然变浅,所用HCl溶液的体积V2。
消耗HCl的物质的量等于n(Na3PO4)+ n(NaOH)。
通过以上两组实验数据即可求出各组分含量。
(6)Na 3PO 4和Na 2HPO 4;①用HCl 标准溶液,酚酞为指示剂,滴至Na 2HPO 4,V 1; ②用HCl 标准溶液,甲基橙为指示剂,滴至NaH 2PO 4,V 2。
Na 3PO 4→V 1,Na 2HPO 4→V 2-V 1 (7)NaHSO 4和NaH 2PO 4;①取混合液一份,以甲基橙为指示剂,用NaOH 滴定至黄色。
仅有NaHSO 4被滴定,设消耗NaOH 体积为V 1。
以V 1计算NaHSO 4的含量。
②在上溶液中加入百里酚酞作指示剂,用NaOH 滴定至浅蓝色,设消耗NaOH 体积为V 2。
以V 2计算Na 2HPO 4的含量。
(8)NH 3∙H 2O 和NH 4Cl ;①NH 3∙H 2O 为弱碱,cK b >10-8,可用HCl 标准溶液滴定,甲基红。
②用甲醛法测NH 4Cl 。
12.有一碱液,可能含有NaOH ,Na 2CO 3,或NaHCO 3,也可能是其中两者的混合物。
今用盐酸溶液滴定,以酚酞为指示剂,消耗HCl 体积为V 1;后用甲基橙指示剂,继续用HCl 溶液滴定,又消耗HCl 体积为V 2。
当出现下列情况时,溶液各由哪些物质组成?(1)V 1>V 2,V 2>0;(2)V 2>V 1,V 1>0;(3)V 1=V 2;(4)V 1=0, V 2>0;(5)V 1>0,V 2=0,{(1)NaOH+Na 2CO 3(2)Na 2CO 3+NaHCO 3(3)Na 2CO 3(4)NaHCO 3(5)NaOH } 13.计算下列溶液pH①0.10mol/LNaH 2PO 4;②0.05mol/LK 2HPO 4;③0.05mol/L 醋酸+0.05mol/L 醋酸钠;④0.1mol/L 醋酸钠;⑤0.05mol/L 邻苯二甲酸氢钾;⑥0.20mol/LH 3PO 4;⑦0.10mol/LNH 4CN ;⑧0.10mol/LH 3BO 3;⑨0.05mol/LNH 4NO 3解:①mol/L 1019.2]H [521-+⨯=⋅=a a K K 66.4pH =②HPO 4-为两性物质,cK a3=0.05×4.8×10-13=2.4×10-14<20K w ,, c>20K a2,又因c + K a 2≈c ,用近似式计算+10[H ]20510mol/L.-===⨯ p H 969.= ③缓冲溶液76.4p lgp pH ==+=a aba K c c K④-6[OH ]76710mol/L .-===⨯ 12.5pOH = pH 888.=⑤mol/L 1035.6101.3103.1]H [56321---+⨯=⨯⨯⨯=⋅=a a K K 20.4=pH⑥K a1=6.9×10-3,K a2=6.2×10-8,K a3=4.8×10-138005.-=≤,可忽略H 3PO 4第二级解离,cK a1≥20K w ,c/ K a1=0.2/6.9×10-3<500,则采用近似式计算:+[H ]0034mol/L .== p H 147.= ⑦mol/L 1089.5106.5102.6']H [101010---+⨯=⨯⨯⨯=⋅=a a K K 23.9pH = ⑧mol/L 1035.71.0104.5]H [610--+⨯=⨯⨯=⋅=c K a 13.5pH =⑨+6[H ]52910mol/L .-===⨯ p H 528.= 14.当下列溶液各加水稀释10倍时,其pH 值有何变化?计算变化前后的pH 值。
(1)0.1mol/L HCl ;(2)0.1mol/L NaOH ;(3)0.1mol/L HAc ;(4)0.1mol/L NH 3∙H 2O +0.1mol/L NH 4Cl(1.00,2.00;13.00,12.00;2.88,3.38;9.25,9.25) 15.用下列数据近似地计算弱酸或弱碱的离解常数:(1)某一元弱酸摩尔质量为122.1,称取1.04g ,配成100ml 水溶液,其pH 为2.64,计算弱酸的p K a 。