第四章 酸碱滴定法
- 格式:doc
- 大小:329.50 KB
- 文档页数:18









第四章酸碱滴定法第四章酸碱滴定法酸碱滴定法(acid-base titrations)是以⽔溶液中的质⼦转移反应为基础的滴定分析⽅法。
⼀般酸、碱以及能与酸碱直接或间接发⽣质⼦反应的物质,⼏乎都可以⽤酸碱滴定法测定。
因此,酸碱滴定法是分析化学的基础内容之⼀。
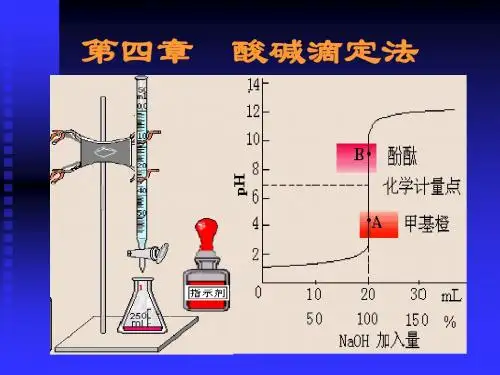
这个⽅法的关键问题是计量点的确定。
因为酸碱反应通常不发⽣外观的变化,在滴定中需选⽤适当的指⽰剂,利⽤它的变⾊作为到达计量点的标志。
因为不同的指⽰剂的变⾊有其不同的pH,⽽不同类型的酸碱反应的计量点时pH⼜不相同,为了正确地确定计量点,就需要选择⼀个刚好能在计量点时变⾊的指⽰剂。
要解决这个问题,必须了解滴定过程中溶液pH的变化情况。
因此,在学习酸碱滴定时,不仅要了解指⽰剂的变⾊原理和变⾊范围,同时也要了解滴定过程中溶液pH的变化规律和指⽰剂的选择原则,以便能正确地选择合适的指⽰剂,获得准确的分析结果。
基于上述原因,我们先讨论酸碱溶液平衡的基本原理,然后再介绍酸碱滴定中的理论及应⽤。
第⼀节⽔溶液中的酸碱平衡⼀、酸碱的质⼦理论根据质⼦理论,凡能给出质⼦(H+)的物质是酸,能接收质⼦的物质是碱。
酸碱关系可⽤下式表⽰:酸HA与碱A-处于⼀种相互依存的关系中,即:HA失去质⼦转化为它的共轭碱A-,A-得到质⼦后,转化为它的共轭酸HA,则HA与A-被称为共轭酸碱对。
如:由上述酸碱的半反应可知:酸碱可以是中性分⼦,也可以是阳离⼦或阴离⼦,酸碱是相对的。
⼜如:离⼦(H2PO4-)在H3PO4-H2PO4-共轭体系中为碱,⽽在H2PO4--HPO42-共轭体系中为酸。
同⼀物质在某些场合是酸,⽽在另⼀场合是碱,其原因是共存物质彼此间给出质⼦能⼒相对强弱不同。
因此同⼀物质在不同的环境(介质或溶剂)中,常会引起其酸碱性的改变。
既能给出质⼦⼜能接受质⼦的物质称为两性物质。
酸碱质⼦理论认为,酸碱反应的实质是质⼦转移。
例如HAc在⽔中离解,溶剂⽔就起着碱的作⽤,否则HAc⽆法实现其在⽔中的离解,即质⼦转移是在两个共轭酸碱对间进⾏。
第四章酸碱滴定法(8学时)【本章重点】:1.各种类型的酸碱滴定的pH变化规律和选用指示剂的依据2.弱酸、弱碱溶液准确滴定的原则3.酸碱滴定液的配制和标定方法4.酸碱滴定法测定各种酸和碱的原理和指示剂的正确选择5.溶剂的性质6.非水滴定的相关计算一、选择题1 OH-的共轭酸是(B)A. H+B. H2OC. H3O+D. O2-2 在下列各组酸碱组分中,不属于共轭酸碱对的是(C)A.HOAc-NaOAcB. H3PO4-H2PO4-C. +NH3CH2COOH-NH2CH2COO-D. H2CO3-HCO3-3 水溶液中共轭酸碱对K a与K b的关系是(B)A. K a·K b=1B. K a·K b=K wC. K a/K b=K wD. K b/K a=K w4 c(NaCl) = 0.2mol∙L-1的NaCl水溶液的质子平衡式是(C)A. [Na+] = [Cl-] = 0.2mol∙L-1B. [Na+]+[Cl-] = 0.2mol∙L-1C.[H+]=[OH-]D. [H+]+[Na+] = [OH-]+[Cl-]5 浓度相同的下列物质水溶液的pH最高的是(D)A. NaClB. H4ClC. NaHCO3D. Na2CO36 在磷酸盐溶液中,H2PO4-浓度最大时的pH是(A)(已知H3PO4的解离常数p K a1 = 2.12,p K a2 = 7.20,p K a3 = 12.36)A. 4.66B. 7.20C. 9.78D. 12.367 今有一磷酸盐溶液的pH = 9.78, 则其主要存在形式是(A)(已知H3PO4的解离常数p K a1 = 2.12,p K a2 = 7.20,p K a3 = 12.36)A.PO42-B. H2PO4-C. HPO42- + H2PO4D. H2PO4-+ H3PO48 在pH = 2.67~6.16的溶液中,EDTA最主要的存在形式是(B)(已知EDTA的各级解离常数分别为10-0.9、10-1.6、10-2.0、10-2.67、10-6.16和10-10.26)A. H3Y-B. H2Y2-C. HY3-D. Y4-9 EDTA二钠盐(Na2H2Y)水溶液pH约是(D)(已知EDTA的各级解离常数分别为10-0.9、10-1.6、10-2.0、10-2.67、10-6.16和10-10.26)A. 1.25B. 1.8C. 2.34D. 4.4210 以下溶液稀释10倍时pH改变最小的是(A)A. 0.1 mol·L-1 NH4OAc溶液B. 0.1 mol·L-1 NaOAc溶液C. 0.1 mol·L-1 HOAc溶液D. 0.1 mol·L-1 HCl溶液11 以下溶液稀释10倍时pH改变最大的是(B)A. 0.1 mol·L-1 NaOAc-0.1 mol·L-1 HAc溶液B. 0.1 mol·L-1 NaOAc溶液C. 0.1 mol·L-1 NH4OAc-0.1 mol·L-1 HOAc溶液D. 0.1 mol·L -1 NH 4OAc 溶液12 六次甲基四胺[(CH 2)6N 4]缓冲溶液的缓冲pH 范围是(A )(已知六次甲基四胺p K b = 8.85)A. 4~6B. 6~8C. 8~10D. 9~1113 欲配制pH=5的缓冲溶液,下列物质的共轭酸碱对中最好选择(C )A. 一氯乙酸(K a = 1.4×10-3)B. 甲酸(K a = 1.8×10-4)C. 乙酸 (K a = 1.8×10-5)D. 氨水(K b = 1.8×10-5)14 欲配制pH=9的缓冲溶液,应选用(B )A. NH 2OH(羟氨) (p K b =8.04)B. NH 3·H 2O (p K b = 4.74)C. CH 3COOH (p K a = 4.74)D. HCOOH (p K a = 3.74)15 用NaOH 滴定某一元酸HA ,在化学计量点时,[H +]的计算式是(D ) A. a HA K c ⋅ B. -B HA a c c K ⋅ C. a A w -K c K ⋅ D. -A w a c K K ⋅ 16按质子理论,Na 2HPO 4是( D )(A )中性物质 (B )酸性物质 (C )碱性物质 (D )两性物质 17浓度为0.1 mol/L HAc(pKa=4.74)溶液的pH 是( C )(A )4.87 (B )3.87 (C )2.87 (D )1.8718.浓度为0.10 mol/LNH 4Cl (pKb=4.74)溶液的pH 是( A )(A )5.13 (B )4.13 (C )3.13 (D )2.1319.pH 1.00的HCl 溶液和pH 13.00的NaOH 溶液等体积混合后pH 是( C )(A )14 (B )12 (C )7 (D )620.酸碱滴定中选择指示剂的原则是( C )(A )指示剂变色范围与化学计量点完全符合(B)指示剂应在pH 7.00时变色(C)指示剂的变色范围应全部或部分落入滴定pH突跃范围之内(D)指示剂变色范围应全部落在滴定pH突跃范围之内21.将甲基橙指示剂加到无色水溶液中,溶液呈黄色,该溶液的酸碱性为(D )(A)中性(B)碱性(C)酸性(D)不定22.将酚酞指示剂加到无色水溶液中,溶液呈无色,该溶液的酸碱性为(D )(A)中性(B)碱性(C)酸性(D)不定23.浓度为0.1 mol/L的下列酸,能用NaOH直接滴定的是( A )(A)HCOOH(pK a=3.45) (B)H3BO3(pK a=9.22)(C)NH4NO2(pK b=4.74) (D)H2O2(pK a=12)24.测定(NH4)2SO4中的氮时,不能用NaOH直接滴定,这是因为(C )(A)NH3的K b太小(B)(NH4)2SO4不是酸(C)NH4+的K a太小(D)(NH4)2SO4中含游离H2SO425.标定盐酸溶液常用的基准物质是(A )(A)无水Na2CO3 (B)草酸(H2C2O4·2H2O)(C)CaCO3 (D)邻苯二甲酸氢钾26.标定NaOH溶液常用的基准物质是( B )(A)无水Na2CO3 (B)邻苯二甲酸氢钾(C)硼砂(D)CaCO3 27.已知邻苯二甲酸氢钾的摩尔质量为204.2 g/mol,用它来标定0.1 mol/L 的NaOH溶液,宜称取邻苯二甲酸氢钾( D )(A)0.25g左右(B)1 g左右(C)0.1 g左右(D)0.45 g左右28.作为基准物质的无水碳酸钠吸水后,标定HCl,则所标定的HCl浓度将( A )(A)偏高(B)偏低(C)产生随机误差(D)没有影响29.若将H2C2O4·2H2O基准物质长期保存于保干器中,用以标定NaOH溶液的浓度时,结果将( B )(A)偏高(B)偏低(C)产生随机误差(D)没有影响30.用NaOH溶液分别滴定体积相等的H2SO4和HOAc溶液,消耗的体积相等,说明H2SO4和HOAc两溶液中( C )(A)氢离子浓度相等(B)H2SO4和HAc的浓度相等(C)H2SO4的浓度为HAc的1/2(D)两个滴定的pH突跃范围相同31.含NaOH和Na2CO3混合碱液,用HCl滴至酚酞变色,消耗V1mL,继续以甲基橙为指示剂滴定,又消耗V2 mL,其组成为(B )(A)V1=V2 (B)V1>V2 (C)V1<V2 (D)V1=2V2 32.某混合碱液,先用HCl滴至酚酞变色,消耗V1mL,继以甲基橙为指示剂,又消耗V2mL,已知V1<V2,其组成为( D )(A)NaOH-Na2CO3 (B)Na2CO3(C)NaHCO3 (D)NaHCO3-Na2CO333.关于缓冲溶液,下列说法错误的是( C )(A)够抵抗外加少量强酸、强碱或稍加稀释,其自身pH值不发生显著变化的溶液称缓冲溶液。
(B)缓冲溶液一般由浓度较大的弱酸(或弱碱)及其共轭碱(或共轭酸)组成(C)强酸强碱本身不能作为缓冲溶液(D)缓冲容量的大小与产生缓冲作用组分的浓度以及各组分浓度的比值有关34.用0.1mol/L HCl滴定0.1mol/L NaOH时的pH突跃范围是9.7-4.3,用0.01mol/L HCl滴定0.01mol/L NaOH的突跃范围是( C )(A)9.7-4.3 (B)8.7-4.3 (C)8.7-5.3 (D)10.7-3.3 35.对于酸碱指示剂,全面而正确的说法是( C ).A: 指示剂为有色物质B: 指示剂为弱酸或弱碱C: 指示剂为弱酸或弱碱,其酸式或碱式结构具有不同颜色D: 指示剂在酸碱溶液中呈现不同颜色36.关于酸碱指示剂,下列说法错误的是( B ).A:指示剂本身是有机弱酸或弱碱B: 指示剂的变色范围越窄越好C: HIn与In-的颜色差异越大越好D: 指示剂的变色范围必须全部落在滴定突跃范围之内37. 0.1000mol/L NaOH标准溶液滴定20.00mL 0.1000mol/L HAc,滴定突跃为7.74-9.70,可用于这类滴定的指示剂是( D ).A: 甲基橙(3.1-4.4) B: 溴酚蓝(3.0-4.6)C: 甲基红(4.0-6.2) D: 酚酞(8.0-9.6)38.以下四种滴定反应,突跃范围最大的是(A ).A: 0.1mol/L NaOH滴定0.1mol/L HCl B: 1.0mol/L NaOH滴定1.0mol/L HClC: 0.1mol/L NaOH滴定0.1mol/L HOAc D: 0.1mol/L NaOH滴定0.1mol/L HCOOH39.滴定操作时,眼睛应( C ).A: 为了防止滴定过量,眼睛应一直注意滴定管溶液的下降情况B: 可以四处张望C: 一直观察三角瓶内溶液颜色的变化D: 没有特别的要求40.强酸滴定弱碱时,一般要求碱的离解常数与浓度的乘积达( A ),才可能选择指示剂指示。
A:≥10-8B: <10-8C: >10-2D: >10-9二、填空题1.凡是能(给出)质子的物质是酸;凡是能(接受)质子的物质是碱。
2.各类酸碱反应共同的实质是(质子的转移)。
3.根据酸碱质子理论,物质给出质子的能力越强,酸性就越(强),其共轭碱的碱性就越(弱)。
4.给出NaH2PO4溶液的质子条件式时,一般以(H2PO4-)和(H2O )为参考水准。
5.HPO42-是(PO43-)的共轭酸,是(H2PO4-)的共轭碱。