第四章__酸碱滴定法
- 格式:ppt
- 大小:2.27 MB
- 文档页数:127







第四章酸碱滴定法第四章酸碱滴定法酸碱滴定法(acid-base titrations)是以⽔溶液中的质⼦转移反应为基础的滴定分析⽅法。
⼀般酸、碱以及能与酸碱直接或间接发⽣质⼦反应的物质,⼏乎都可以⽤酸碱滴定法测定。
因此,酸碱滴定法是分析化学的基础内容之⼀。
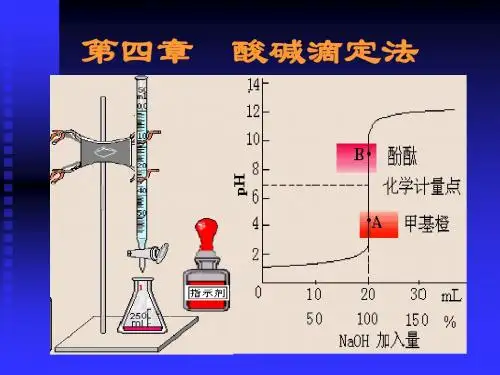
这个⽅法的关键问题是计量点的确定。
因为酸碱反应通常不发⽣外观的变化,在滴定中需选⽤适当的指⽰剂,利⽤它的变⾊作为到达计量点的标志。
因为不同的指⽰剂的变⾊有其不同的pH,⽽不同类型的酸碱反应的计量点时pH⼜不相同,为了正确地确定计量点,就需要选择⼀个刚好能在计量点时变⾊的指⽰剂。
要解决这个问题,必须了解滴定过程中溶液pH的变化情况。
因此,在学习酸碱滴定时,不仅要了解指⽰剂的变⾊原理和变⾊范围,同时也要了解滴定过程中溶液pH的变化规律和指⽰剂的选择原则,以便能正确地选择合适的指⽰剂,获得准确的分析结果。
基于上述原因,我们先讨论酸碱溶液平衡的基本原理,然后再介绍酸碱滴定中的理论及应⽤。
第⼀节⽔溶液中的酸碱平衡⼀、酸碱的质⼦理论根据质⼦理论,凡能给出质⼦(H+)的物质是酸,能接收质⼦的物质是碱。
酸碱关系可⽤下式表⽰:酸HA与碱A-处于⼀种相互依存的关系中,即:HA失去质⼦转化为它的共轭碱A-,A-得到质⼦后,转化为它的共轭酸HA,则HA与A-被称为共轭酸碱对。
如:由上述酸碱的半反应可知:酸碱可以是中性分⼦,也可以是阳离⼦或阴离⼦,酸碱是相对的。
⼜如:离⼦(H2PO4-)在H3PO4-H2PO4-共轭体系中为碱,⽽在H2PO4--HPO42-共轭体系中为酸。
同⼀物质在某些场合是酸,⽽在另⼀场合是碱,其原因是共存物质彼此间给出质⼦能⼒相对强弱不同。
因此同⼀物质在不同的环境(介质或溶剂)中,常会引起其酸碱性的改变。
既能给出质⼦⼜能接受质⼦的物质称为两性物质。
酸碱质⼦理论认为,酸碱反应的实质是质⼦转移。
例如HAc在⽔中离解,溶剂⽔就起着碱的作⽤,否则HAc⽆法实现其在⽔中的离解,即质⼦转移是在两个共轭酸碱对间进⾏。



第四章酸碱滴定法1.写出下列各酸的共轭碱:H2O,H2C2O4,H2PO4-,HCO3-,C6H5OH,C6H5NH3+,HS-,Fe(H2O)63+,R-NH+CH2COOH.答:H2O的共轭碱为OH-;;H2C2O4的共轭碱为HC2O4-;H2PO4-的共轭碱为HPO42-;HCO3-的共轭碱为CO32-;;C6H5OH的共轭碱为C6H5O-;C6H5NH3+的共轭碱为C6H5NH2;HS-的共轭碱为S2-;Fe(H2O)63+的共轭碱为Fe(H2O)5(OH)2+;R-NH2+CH2COOH的共轭碱为R-NHCH2COOH。
2. 写出下列各碱的共轭酸:H2O,NO3-,HSO4-,S2-,C6H5O-,C u(H2O)2(OH)2,(CH2)6N4,R—NHCH2COO-,COO-C O O-。
答:H2O的共轭酸为H+;NO3-的共轭酸为HNO3;HSO4-的共轭酸为H2SO4;S2的共轭酸为HS-;C6H5O-的共轭酸为C6H5OHC u(H2O)2(OH)2的共轭酸为Cu(H2O)3(OH)+;(CH2)6N4的共轭酸为(CH2)4N4H+;R—NHCH2COO-的共轭酸为R—NHCHCOOH,COO-C O O-的共轭酸为COO-C O O-H3.根据物料平衡和电荷平衡写出(1)(NH4)2CO3,(2)NH4HCO3溶液的PBE,浓度为c(mol·L-1)。
答:(1)MBE:[NH4+]+[NH3]=2c; [H2CO3]+[HCO3-]+[CO32-]=cCBE:[NH4+]+[H+]=[OH-]+[HCO3-]+2[CO32-]PBE:[H+]+2[H2CO3] +[HCO3-]=[NH3]+[OH-](2)MBE:[NH4+]+[NH3]=c; [H2CO3]+[HCO3-]+[CO32-]=cCBE:[NH4+]+[H+]=[OH-]+[HCO3-]+2[CO32-]PBE:[H+]+[H2CO3]=[NH3]+[OH-]+[CO32-]4.写出下列酸碱组分的MBE、CEB和PBE(设定质子参考水准直接写出),浓度为c (mol·L-1)。