电化学-第七章 气体电极过程
- 格式:ppt
- 大小:52.53 MB
- 文档页数:63


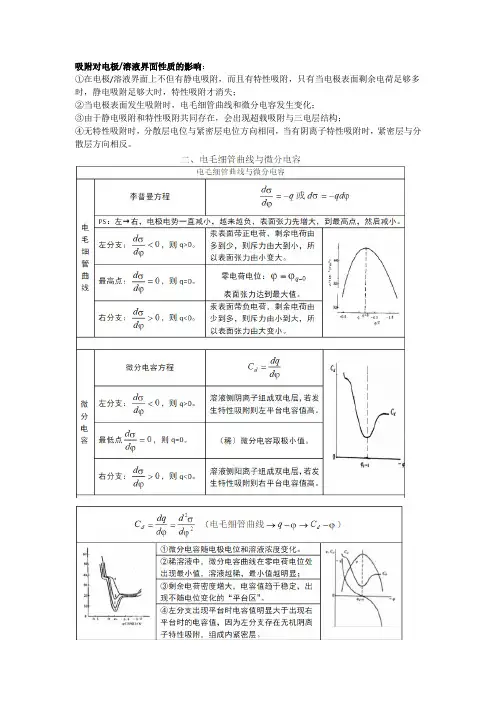
吸附对电极/溶液界面性质的影响:①在电极/溶液界面上不但有静电吸附,而且有特性吸附,只有当电极表面剩余电荷足够多时,静电吸附足够大时,特性吸附才消失;②当电极表面发生吸附时,电毛细管曲线和微分电容发生变化;③由于静电吸附和特性吸附共同存在,会出现超载吸附与三电层结构;④无特性吸附时,分散层电位与紧密层电位方向相同,当有阴离子特性吸附时,紧密层与分散层方向相反。
电极过程——电极表面附近薄液层中进行的过程与电极表面上发生的过程的总称。
电极过程单元步骤:①液相传质——反应粒子向电极表面传递;②表面转化(前置)——反应粒子在电极表面或附近液层发生某些转化;③电化学——反应粒子在电极/溶液界面得到电子或失去电子;④表面转化(后置)——反应产物在电极表面或附近液层发生某些转化;⑤a、新相生成——反应产物不溶时,反应产物生成新相;b、液相传质——反应产物可溶时,产物粒子从电极表面向溶液中或溶液电极内部迁移。
电极极化——电流通过电极时,电极电势偏离平衡电极电势的现象。
过电势——表示某一电流密度下极化电势与平衡电势之差。
①阳极过电势:②阴极过电势:控制步骤——电极过程中最慢的单元步骤。
极化曲线——电极上电势随电流密度变化的关系曲线。
传质过程(溶液):①对流——物质粒子随液体流动而移动。
A、自然对流——液体各部分之间由于存在浓度差或温度差产生的密度差或密度梯度而产生的对流;B、强制对流——通过搅拌而引起的对流。
②扩散——溶液中某一组分由于存在浓度梯度(或化学势梯度)而发生该组分向减少这种梯度的方向转移的过程。
③电迁移——带电粒子在电场梯度或电势梯度的作用下而引起的迁移过程。
扩散层——通过电流时,由于物质迁移缓慢而引起浓度发生扩散的液层。
稳态扩散——溶液中任意一点的浓度不再随时间变化的扩散过程。
(扩散速度与时间无关,反应粒子浓度分布只与空间有关,扩散层厚度一定)非稳态扩散——溶液中任意一点的浓度随时间变化的扩散过程。


第七章电化学教学目的与要求了解电解质溶液的导电机理和法拉第定律、离子独立运动定律理解离子迁移数、电导率, 摩尔电导率的概念。
理解电导测定的应用。
理解电解质活度和离子平均活度系数的概念。
了解离子氛的概念和Debye-Huckel极限公式。
理解可逆电池及韦斯顿标准电池,理解原电池电动势和热力学函数的关系。
掌握能斯特方程及其计算。
掌握电动势测定方法与其主要应用。
掌握各种类型电极的特征。
理解把电池反应设计成电池的方法*。
理解电极极化的原因和超电势的概念。
了解分解电压、析出电势的概念以及析出反应次序与析出电势的关系*。
教学重点与难点重点:电化学系统中的基本原理及其应用。
难点:离子氛的概念,电解质活度、离子平均活度系数和超电势的计算.作业: 7.1 7.5 7.7 7.11 7.13 7.16 7.19 7.25 7.29 7.30 7.36 7.40 电化学主要研究电能和化学能相互转化的一门科学。
是物理化学的一个重要分支。
研究的主要内容:电解质溶液、电化学平衡电极过程热力学、应用问题7-1 电解质溶液的导电机理及法拉第定律一、基本概念1、导体分类第一类导体(电子导体):依靠电子在电场下作定向移动导体。
如金属、石墨等A.自由电子作定向移动而导电B.导电过程中导体本身不发生变化C.温度升高,电阻也升高D.导电总量全部由电子承担第二类导体(又称离子导体),如电解质溶液、熔融电解质等。
依靠正负离子在电场作用下移动导电。
A.正、负离子作反向移动而导电B.导电过程中有化学反应发生C.温度升高,电阻下降D.导电总量分别由正、负离子分担2、电池(电解池、原电池)(1)电解池装置(2)原电池装置3. 阴极、阳极和正、负极的确定①按电势的高低高→正极低→负极②按得失电子的不同失电子,发生氧化反应→阳极得电子,发生还原反应→阴极4. 分析对照图讲解原电池中:负极(阳极),正极(阴极)电解池中:负极(阴极),正极(阳极)5. 电解质溶液的导电机理正、负离子的定向移动以及在电极溶液界面上发生化学反应而实现。

第七章不可逆电极过程7.1 本章学习要求本章为打“*”号的内容。
实际发生的电化学现象中,往往有一定的电流通过电极,发生不可逆反应,是不可逆过程。
1.要求学生了解不可逆电极过程的特点及与可逆电极变化的关系;2.了解分解电压、极化现象和超电势;3.了解极谱分析的原理;4.了解金属腐蚀及防护;5.了解化学电源。
7.2 内容概要7.2.1 不可逆电极过程使电解反应能持续稳定进行所必须施加的最小外加电压称为分解电压(decomposition voltage)。
分解电压的数值是电解反应的电流——电压(I-V)曲线转折点对应的数值,实测分解电压Vd没有确切的理论意义,其数值大小受电极材料、电解液、温度等诸多因素的影响,但在实际应用中Vd有很大的意义。
电极上有电流通过时,发生不可逆电极过程(irreversible processes at electrodes),电极电势偏离其平衡电极电势的现象称为电极的极化(polarization)。
电极极化时电极电势相对于可逆电势的偏离值称为过电势或超电势(overpotetial)。
通过电极的电流密度越大,超电势越大。
电极的反应发生在电极与溶液的界面上,反应的结果改变了电极表面附近溶液中离子的浓度,而离子扩散的迟滞性导致电极表面附近的溶液与溶液本体之间产生浓度差,这样引起的极化作用称为浓差极化(concentration polarization)。
由于电极反应的迟缓性引起的极化称为电化学极化(electrochemical polarization)或活化极化(activation polarization)。
由于极化作用,使阳极的极化电势高于可逆电势,阴极的极化电势低于可逆电势。
所以原电池放电时两极间的实际电势差小于可逆电动势,在电解池中只有外加端电压高于可逆电动势时,电解反应才能得以进行。
时的超电势称为氢超电势(hydrogen H+在阴极上电解还原成H2overpotetial),其与电流密度的关系可用Tafel方程(Tafel’s equation)表示:η=a+b lg i式中η为氢超电势,i为电流密度,a,b是常数。


气体电极(gas electrode )指有气体参与电极反应的电极,如氢电极、氧电极等。
气体分子与溶液中相应的离子在气/液相之间的惰性金属上接受电子,从而建立电极反应的平衡。
实验室中往往用镀有铂黑的铂片作为电极之电子导体。
近年在燃料电池、金属空气电池等的研制开发中研制了载有催化剂的气体扩散电极,扩展了气体电极的应用。
气体电极是将被单质气体冲击着的铂片浸入单质气体其离子组成的溶液中而构成。
其中标准氢电极是把镀有铂黑的铂片浸入的溶液中,并以的干燥氢气不断冲击到铂电极上构成,电极结构,规定标准氢电极(SHE)的电极电势为零。
呼吸式气体电极特征在于包括外壳、气体腔、多孔电极和电解液腔构成,气体腔和电解液腔之间仅通过多孔电极内的毛细管相连通;所述气体腔或电解液腔与周期性变化的压力源相连;周期性变化的压力使多孔电极内产生周期性的气驱液和液驱气过程,形成有利于电化学反应的三相区域,加快多孔电极内的传质过程,从而提高电池的输出功率;适用于消耗气体的燃料电池电极,如氧电极、氢电极等。
气体扩散电极Gas diffusion electrode是一种特制的多孔膜电极,由于大量气体可以到达电极内部,且与电极外面的整体溶液(电解质)相连通,可以组成一种三相(固、液、气)膜电极。
它既有足够的“气孔”,使反应气体容易传递到电极上,又有大量覆盖在催化剂表面的薄液层。
催化剂(如铂黑)的粉粒分散在多孔膜中,并通过薄液层的“液孔”与电极外面的电解质溶液连通,以利于液相反应物和产物的迁移。
气体进入扩散电极发生催化反应,并产生电流,由此可测出气体的含量,常用于监测气体中某些微量组分。
用气体扩散电极制成的小型监测器用于监测环境、工厂、矿场空气中某些微量的有害气体。
气体扩散电极应用用于携带式的一氧化碳监测仪,其中的电解质用稀硫酸,含有一氧化碳的气流通过装有催化剂的气体扩散电极被氧化为二氧化碳,氧气则被还原为水。
测量这一电池的电流,便可测出一氧化碳含量。

91第七章 气体电极过程在电化学生产实践中,气体电极反应所涉及的面极为广泛,所以研究气体电极过程具有重要的意义。
电解食盐工业和电解水工业都是全部或部分以气体电极过程为基础的电化学工业。
在某些类型的化学电源中,利用气体电极的反应自由焓变化来获得电能,例如各种不同类型的“空气电池”、“燃料电池”,其中都是利用氧的还原构成阴极反应。
在氢氧燃料电池中,还利用氢的电离过程构成阳极反应。
另一方面,由于气体电极反应的出现,也可能对生产造成一些不利的因素,甚至带来十分有害的后果。
例如在电镀工业中,氢和氧的析出,不仅降低了主要电极反应的电流效率,氢在阴极上的析出,还能使金属引起“氢脆”,使镀层产生针孔、麻点,鼓泡等现象,氧在阳极上的析出,使阳极金属钝化,溶解不良。
在金属的电化学腐蚀中,氢离子或溶解氧的还原反应往往是促使金属腐蚀的主要原因。
为了有效地控制这些气体电极过程,要求人们研究这些过程的规律性。
下面我们将重点讨论氢和氧的阴极过程,并简单介绍电催化的基本概念。
7.1 氢的阴极析出过程氢的阴极析出过程,是各类电极过程中研究得比较多的一种,至今已有半个世纪以上的历史。
但是对氢在阴极上的析出机理,却长期存在着分歧意见,直到近年,才逐渐在主要问题上取得了比较一致的结论。
7.1.1 氢析出的基本实验事实在大多数金属电极上,氢的析出反应都存在着比较大的过电位。
塔菲尔在大量的实践中发现,在许多电极上,氢的过电位与电流密度间存在着半对数关系,即i b a lg +=∆ϕ。
在大多数纯净金属的表面上,公式中的经验常数b 具有几乎相同的数值,约0.11~0.12 v(见表7-1)。
有时虽也观察到比较高的b 值(>0.14 v ),其原因常常是由于表面状态发生了变化所致。
公式中经验常数a ,数值主要决定于电极材料。
电极不同,a 也不同,说明电极及其表面对氢的析出过程,有着不同的“催化能力”(7.8)。
一般按a 值的大小,可将电极材料大致分为三类: (1)高过电位金属(a ≈1.2~1.5 v ),如Pb 、Cd 、Hg 、Tl 、Zn 、Sn 等。


第七章电化学7.1电极过程、电解质溶液及法拉第定律原电池:化学能转化为电能(当与外部导体接通时,电极上的反应会自发进行,化学能转化为电能,又称化学电源)电解池:电能转化为化学能(外电势大于分解电压,非自发反应强制进行)共同特点:(1)溶液内部:离子定向移动导电(2)电极与电解质界面进行的得失电子的反应----电极反应(两个电极反应之和为总的化学反应,原电池称为电池反应,电解池称为电解反应)不同点:(1)原电池中电子在外电路中流动的方向是从阳极到阴极,而电流的方向则是从阴极到阳极,所以阴极的电势高,阳极的电势低,阴极是正极,阳极是负极;(2)在电解池中,电子从外电源的负极流向电解池的阴极,而电流则从外电源的正极流向电解池的阳极,再通过溶液流到阴极,所以电解池中,阳极的电势高,阴极的电势低,故阳极为正极,阴极为负极。
不过在溶液内部阳离子总是向阴极移动,而阴离子则向阳极移动。
两种导体:第一类导体(又称金属导体,如金属,石墨);第二类导体(又称离子导体,如电解质溶液,熔融电解质)法拉第定律:描述通过电极的电量与发生电极反应的物质的量之间的关系=n=FQξzF电F -- 法拉第常数; F = Le =96485.309 C/mol = 96500C/molQ --通过电极的电量;z -- 电极反应的电荷数(即转移电子数),取正值;ξ--电极反应的反应进度;结论: 通过电极的电量,正比于电极反应的反应进度与电极反应电荷数的乘积,比例系数为法拉第常数。
依据法拉第定律,人们可以通过测定电极反应的反应物或产物的物质的量的变化来计算电路中通过的电量。
相应的测量装置称为电量计或库仑计coulometer,通常有银库仑计和铜库仑计 。
7.2 离子的迁移数1. 离子迁移数:电解质溶液中每一种离子所传输的电量在通过的总电量中所占的百分数,用 tB 表示1=∑±=-++t 或显然有1:t t离子的迁移数主要取决于溶液中离子的运动速度,与离子的价数无关,但离子的运动速度会受到温度、浓度等因素影响。
5.电极过程和电极过程动力学5.1电化学装置的可逆性:化学反应可逆性;热力学上可逆性5.2电极的极化5.3电极过程的控制步骤:电极反应的特点;电极反应的控制步骤5.4电荷转移动力学方程5.5交换电流密度与电极反应速度常数5.6稳态极化时的电极动力学方程5.7浓差极化及其电机动力学方程5.8化学极化分解电压E分:在可逆情况下使电解质有效组元分解的最低电压,称为理论分解电压(V e)。
理论分解电压是阳极平衡电极电位(εe(A))与阴极平衡电极电位(εe(K))之差。
Ve=εe(A)- εe(K)(10 - 5)当电流通过电解槽,电极反应以明显的速度进行时,电极反应将会明显偏离平衡状态,而成为一种不可逆状态,这时的电极电位就是不平衡电位,阳极电位偏正,阴极电位偏负。
这时,能使电解质熔体连续不断地发生电解反应所必需的最小电压叫作电解质的实际分解电压。
显然,实际分解电压比理论分解电压大,有时甚至大很多。
实际分解电压简称分解电压(V),是阳极实际析出电位(ε(A))和阴极析出电位(ε(K))之差。
V=ε(A)- ε(K)(10 - 6)当得知阴、阳极在实际电解时的偏离值(称为超电位)就可以算出某一电解质的实际分解电压。
分解电压符合能斯特方程,可以表示为如下形式:式中E i,E0分别表示实际和标准状态下组元i的分解电压;a i__组元的活度;n i __组元在熔盐中的化合价;F __ 法拉弟常数;可以看出,温度和电解质组成均会影响分解电压电极极化电解时的实际分解电压比理论分解电压要大很多,这是由于电流通过电解槽时,电极反应偏离了平衡状态。
通常将这种偏离平衡电极电位的现象称为极化现象。
电解过程实际分解电压和理论分解电压之差称为超电压。
⏹电解电极反应一般包含1:☐(1)反应离子由熔体向双电层移动并继续经双电层向电极表面靠近。
这一阶段在很大程度上靠扩散实现,扩散则是由于导电离子在熔体和双电层外界的浓度差别引起的。
☐(2)反应离子在电极表面进行电极反应前的转化过程,如表面吸附等;☐(3)在电极上的电子传递- - 电化学氧化或电化学还原反应;☐(4)反应产物在电极表面进行反应后的转化过程,例如自电极表面的脱附,反应产物的复合、分解和其它化学反应;☐(5)反应产物形成新相,或反应产物自电极表面向电解质熔体的传递。
吸附对电极/溶液界面性质的影响:①在电极/溶液界面上不但有静电吸附,而且有特性吸附,只有当电极表面剩余电荷足够多时,静电吸附足够大时,特性吸附才消失;②当电极表面发生吸附时,电毛细管曲线和微分电容发生变化;③由于静电吸附和特性吸附共同存在,会出现超载吸附与三电层结构;④无特性吸附时,分散层电位与紧密层电位方向相同,当有阴离子特性吸附时,紧密层与分散层方向相反。
电极过程——电极表面附近薄液层中进行的过程与电极表面上发生的过程的总称。
电极过程单元步骤:①液相传质——反应粒子向电极表面传递;②表面转化(前置)——反应粒子在电极表面或附近液层发生某些转化;③电化学——反应粒子在电极/溶液界面得到电子或失去电子;④表面转化(后置)——反应产物在电极表面或附近液层发生某些转化;⑤a、新相生成——反应产物不溶时,反应产物生成新相;b、液相传质——反应产物可溶时,产物粒子从电极表面向溶液中或溶液电极内部迁移。
电极极化——电流通过电极时,电极电势偏离平衡电极电势的现象。
过电势——表示某一电流密度下极化电势与平衡电势之差。
①阳极过电势:②阴极过电势:控制步骤——电极过程中最慢的单元步骤。
极化曲线——电极上电势随电流密度变化的关系曲线。
传质过程(溶液):①对流——物质粒子随液体流动而移动。
A、自然对流——液体各部分之间由于存在浓度差或温度差产生的密度差或密度梯度而产生的对流;B、强制对流——通过搅拌而引起的对流。
②扩散——溶液中某一组分由于存在浓度梯度(或化学势梯度)而发生该组分向减少这种梯度的方向转移的过程。
③电迁移——带电粒子在电场梯度或电势梯度的作用下而引起的迁移过程。
扩散层——通过电流时,由于物质迁移缓慢而引起浓度发生扩散的液层。
稳态扩散——溶液中任意一点的浓度不再随时间变化的扩散过程。
(扩散速度与时间无关,反应粒子浓度分布只与空间有关,扩散层厚度一定)非稳态扩散——溶液中任意一点的浓度随时间变化的扩散过程。