朗道血凝质控说明书
- 格式:pdf
- 大小:1.31 MB
- 文档页数:7

血栓/止血试剂(Dade® Behring)使用手册PT凝血酶原时间一、原理:在受检血浆中加入过量的因子III(人胎盘的浸出液)和Ca2+,使凝血酶原转变为凝血酶,后者使纤维蛋白原转变为纤维蛋白,血浆凝固所需要的时间即为PT。
它是外源性凝血系统常用筛选试验之一。
二、试剂:Thromborel S试剂,为人胎盘浸出液和Ca2+的混合试剂,试剂说明书中包含本试剂用在不同型号、不同方法学的仪器上的国际敏感度指数(ISI)。
试剂溶解时分别按包装用10ML或4.0ML的蒸馏水复溶。
三、标本制备:9份静脉血加一份3.8g/dl(109mmol/L)枸橼酸钠抗凝,立即混匀,1000xg离心10分钟,血浆可在15-25℃保存4小时,在-20℃至少可以保存24小时。
四、操作步骤:SYSMEX的CA系列血凝仪采用的是散射光比浊,百分比检测,监测样品凝集开始到凝集完全的散射光强度的变化,50%凝集时所对应的时间即为凝血酶原时间。
1、将PT的试剂按照说明溶解好以后,放到确定的位置上。
2、将样本离心准备好以后,放到样本架上,样本架放到自动进样器上。
3、在屏幕上进入WORK LIST菜单,设好ID号,及要检测的项目,一切准备好便可按START开始。
五、注意事项:试剂溶解后,可在15℃放置8小时,2-8℃可保存5天。
复溶要充分,溶解后的试剂最好不要在低温冷冻保存。
六、参考值:PT 9-13秒七、临床意义:PT延长:先天性见于因子II、V、VII、X缺乏和无(或)低纤维蛋白原血症;获得性见于弥散性血管内凝血、原发性纤溶症、维生素K缺乏症、肝脏疾病;血循环中有抗凝物质,如肝素、FDP、以及抗因子II、V、VII、X的抗体存在等情况。
PT缩短:见于因子V增多症、口服避孕药、高凝状态和血栓性疾病等。
口服抗凝剂的监测:凝血酶原时间是监测口服抗凝剂的常用指标,中国人INR在1.5~2.5用药较为安全和有效。
八、订货信息:Thromborel S凝血酶原 OUHP49 10*10MLThromborel S凝血酶原 OUHP29 10*4.0MLAPTT部分凝血活酶时间原理:在37℃下,以鞣花酸为激活剂活化凝血因子XII和XI,以脑磷脂(部分凝血活酶)代替血小板提供凝血的催化表面,在Ca2+的参与下,观察贫血小板血浆凝固所需要的时间。

HIGH SENSITIVITY CRP CALIBRATOR SERIES(hsCRP CAL)(HIGH SENSITIVITY CRP CALIBRANT)CAT. NO. CP 2478SIZE: 6 x 2 mlINTENDED USEThis product is intended for in vitro diagnostic use in the calibration of CRP on clinical chemistry systems.SAFETY PRECAUTIONS AND WARNINGSThe calibrator contains human CRP in a stabilised protein matrix. Human source material from which the product has been derivedhas been tested at donor level for the Human Immunodeficiency Virus (HIV 1, HIV 2) antibody, Hepatitis B Surface Antigen (HbsAg), Hepatitis C Virus (HCV) antibody, HBV DNA, HCV RNA and HIV DNA and found to be NON-REACTIVE. FDA approved methodshave been used to conduct these tests.However, since no method can offer complete assurance as to the absence of infectious agents, this material and all patient samplesshould be handled as though capable of transmitting infectious diseases and disposed of accordingly.For in vitro diagnostic use only, do not pipette by mouth, exercise the normal precautions required for handling laboratory reagents.This material contains Sodium Azide. Avoid ingestion or contact with skin or mucous membranes. In case of skin contact, flushaffected area with copious amounts of water. In case of contact with eyes or if ingested, seek immediate medical attention.Sodium Azide reacts with lead and copper plumbing, to form potentially explosive azides. When disposing of such reagents flush withlarge volumes of water to prevent azide build up. Exposed metal surfaces should be cleaned with 10% sodium hydroxide.Dispose of this material according to local regulations.STORAGE AND STABILITYThe CRP calibrators are supplied ready for use and are stable up to the expiry date when capped and stored at +2°C to +8°C in the absence of contamination. Only the required amount of product should be removed. After use, any residual product should NOT BE RETURNED to the original vial.MATERIALS PROVIDEDCRP CalibratorsLevel 1 (1 x 2 ml) Level 4 (1 x 2 ml)Level 2 (1 x 2 ml) Level 5 (1 x 2 ml)Level 3 (1 x 2 ml) Level 6 (1 x 2 ml)MATERIALS REQUIRED BUT NOT PROVIDEDNoneVALUE ASSIGNMENTCalibration of CRP Calibrators has been preformed at Randox by latex-enhanced immunoturbidimetry with reference to material standardised against an appropriate International Reference Preparation. The assigned values for the batch are listed below.LOT NO. CRP (mg/l) CRP (mg/dl) EXPIRY DATE1986CP 0.00 0.00 2013-031981CP 0.54 0.054 2013-031982CP 1.07 0.107 2013-031983CP 1.61 0.161 2013-031984CP 5.35 0.535 2013-031985CP 10.69 1.069 2013-0314 Sep ’11 neLOT NOS.1981CP -1986CP THIS PAGE IS INTENTIONALLY BLANK。
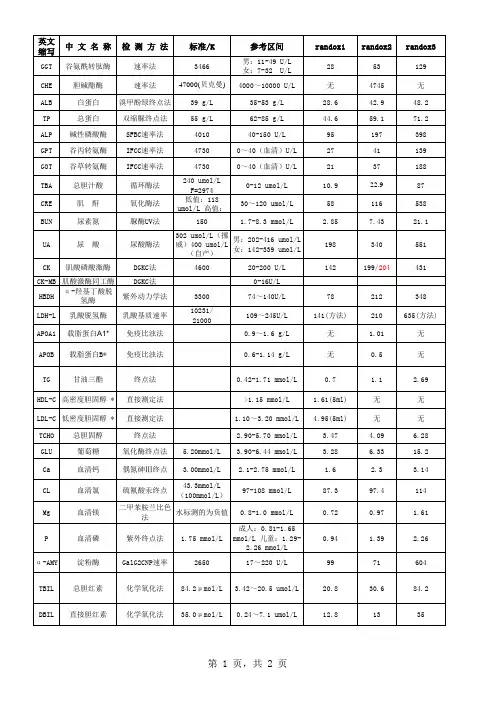

RANDOX控血清使用说明
[使用前准备]
1.小心打开瓶盖,避免内容物的损失
2 .每一瓶用5ml重蒸水复溶
3.轻轻晃动,使干粉充分溶解
4 .大约30分钟后,即可使用
5.注意不要剧烈摇动瓶子
[稳定性]
复溶后常温(25C)可稳定24小时;2-8 C可保存一周。
-20 C冰冻保存可达一个月以上注意:不要反复冻融
[注意事项]
1 . ALP的水平当超过稳定期时会升高,建议复融后1小时内进行检测(室温条件下)。
2.血清中胆红素对光敏感,注意避光保存。
3.总ACR前列腺ACP^醛缩酶项目稳定性可通过下面的措施得到提高:在每血清中加入一滴
(25-30 l ) 0.7M的醋酸溶液,室温下稳定2小时,2-8 C保存2天,冰冻条件下可保存一个月以上。
4.该质控血清不可做校正品用。
[备注]
原文说明书中列有各类生化分析仪的平均值(MEAN OF ALL INSTRUMENTS )和10余种仪器的详细数
值,请根据您的仪器对照查询。
以下是各项目方法学的中英文对照,具体数值请依据使用试剂盒的方法原理在原文说明书中查询。

$%&quality management solutions 质控管理解决方案Why is it important for laboratories to use 247?--为什么要使用247?Importance for laboratories to use 247使用247的重要性1. Improper Quality Control leads to increased costs in the laboratory-质量控制做的不好会导致实验室成本增加–Due to possible repeated tests-可能导致重复检测–Improper patient treatment because of incorrect test results –因检验结果不准确导致的治疗不当Could be detected using 247 –可通过247发现问题Importance for laboratories to use 247使用247的重要性2. Result Validation-结果的确认–Data being entered can be validated using multi rule QC procedures-可通过多规则质控程序保证结果可靠–The advantages of Multirule QC procedures are that false rejections can be kept low while at the same time maintaining high error detection-使用多规则质控程序的好处在于可降低误拒绝率同时提高错误检出率Importance for laboratories to use 247使用247的重要性3.Turnaround time for reporting test result to clinicians can be reduced–Through minimising false rejections that requires repeat analysis of controls and re-runs of patient samples–误拒绝的结果需进行质控和样本的重新检测,通过最小化这种错误拒绝,可减少向临床报告检验结果的时间Importance for laboratories to use 247 4.Can be used as a trouble-shooting tool–If there are concerns that the controlmaterial is not performing well-如果担心质控物有问题–247 enables the lab to separate the effects of the method from suspected effects ofthe control by looking at the effect of thesame controls in other labs-可通过247观察其他实验室的数据迅速区分是质控物的问题还是分析系统的问题–Leading to more rapid and effectiveproblem solving –更加快速有效的解决问题Importance for laboratories to use 247 5. 247 provides means and SD’s for the material that are relevant because they reflect current testing conditions among labs 247软件可以提供相关质控物的均值和SD范围,反映实验室间的检测情况Importance for laboratories to use 247 6. Many managers ‘sign off’on the results without really investigating if those results are in fact accurate–247 provides an easy and fast way for laboratory managers to be confident that the results theysign for are correct.–实验室管理者在检验报告单上签字时往往并没有去考察结果是否可靠。

凝血试验的质量控制流程一、引言凝血试验是临床常用的一种检验方法,用于评估患者的凝血功能状态。
为了保证凝血试验结果的准确性和可靠性,需要进行质量控制。
本文将详细介绍凝血试验的质量控制流程,包括质控样品的选择与制备、质控参数的监测与评估以及异常结果的处理。
二、质控样品的选择与制备1. 样品选择:质控样品应具有与患者样本相似的特征,如凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)等指标的范围。
常用的质控样品包括商业质控品和自制质控品。
2. 样品制备:商业质控品应按照生产商提供的说明书进行制备。
自制质控品的制备需要选取健康人的血浆或全血样本,并经过离心、分装、冻存等处理步骤,确保样品的稳定性和一致性。
三、质控参数的监测与评估1. 内部质控:每天开始工作前,应进行内部质控,即使用质控样品进行测试,以评估仪器和试剂的稳定性。
记录并比较每次测试的结果与设定的目标范围,如果结果在范围内,则说明仪器和试剂正常。
2. 外部质控:定期参加外部质量评估计划,如国家或地区的质量控制项目。
按照规定的时间表,使用质控样品进行测试,并将结果报告给评估机构。
评估机构会对结果进行统计和比对,以评估实验室的准确性和可靠性。
四、异常结果的处理1. 高于上限值的结果:如果质控样品的测试结果超过了上限值,可能是由于试剂或仪器故障导致的。
应立即停止测试,并检查试剂和仪器的状态。
如果问题无法解决,应及时联系供应商或技术支持人员进行维修或更换。
2. 低于下限值的结果:如果质控样品的测试结果低于下限值,可能是由于试剂过期或质控样品的稀释不当导致的。
应检查试剂的有效期和质控样品的制备方法,确保使用正确的试剂和适当的稀释倍数。
3. 持续异常的结果:如果质控样品的测试结果持续异常,可能是由于操作失误、仪器老化或环境因素等原因导致的。
应仔细检查操作步骤、仪器性能和实验室环境,找出问题的根源并及时解决。
五、结论凝血试验的质量控制流程是确保凝血试验结果准确性和可靠性的重要步骤。


血液凝固分析室内控制品使用说明书一、控制品名称:西门子凝血控制品,第1水平,第2水平。
二、适用范围:第1水平、第2水平凝血控制品。
可用于各种仪器、试剂和方法学的凝血酶原时间(PT)和活化部分凝血活酶时间(APTT),纤维蛋白原含量(Fbg)测定。
三、控制品性质:含人血浆、稳定剂和缓冲液的冻干制品。
未开瓶控制品保存于2℃-8℃,可稳定至有效期限。
四、使用方法:使用时,在控制品中加1.0ml蒸馏水或去离子水,然后盖上塞子,轻轻混匀,不要产生气泡,置室温约15分钟至完全溶解后供测定使用,使用前再轻轻混匀,不要震摇。
复溶后闭盖保存于2℃~8℃,可稳定16小时,15~25℃闭盖可稳定8小时。
五、控制品质量控制方法:1、在准备开始进行凝血试验质控时,需连续用同一批号控制品按使用方法测定10天,每天2次,并将检测数据输入电脑,累积20个数据,电脑将自动计算其均值(x)和标准差(s)。
并以此x和s判别第一个月输入的质控数据是否在控;以后2个月电脑将分别以每月累积x和s判别输入的质控数据是否在控;连续3个月后,电脑将计算累积3个月的x和s,以此来判别以后输入的质控数据在控情况。
2、每日进行凝血试验标本测定前,必须先使用控制品,按常规方法进行操作,随每批标本2个水平至少各做1次,将测定数据按软件要求输入电脑,并保存原始数据。
3、失控规则:根据实验室实际情况制定合适的质控规则,建议采用13s 、22s质控规则。
4、一旦发现失控,应查找原因并及时纠正,且有记录。
在控后才能进行日常标本检测和出具检测报告。
5、更换新批号试剂及质控品时,必须重新确定控制品的x和s。
6、每月底将室内质控数据上报至上海市临床检验中心质控业务科。
上海市临床检验质量控制中心临床血液体液室 2013年1月10日。

血凝项目室内和室间质量控制的标准操作流程1、质量操纵1.1 质量保证(QA)质量保证 (QA)是一个全面的定义,可用来描述实验室检测与报告的可靠性的所有度量标准。
包含试验的选择,患者标本有效的采集,标本的分析,检测结果登记的及时性与准确性包含结果的解释,与有关临床医生关于检测结果的交流。
1.2 室内质量操纵(IQC)与室间质量评估 (EQA)室内质量操纵(IQC)与室间质量评估 (EQA)是两个不一致的概念,是对实验室质量保证程序的相互补充。
IQC用于确立所使用的一系列技术与方法是否在相当一段时期内保持一致。
可用来确认日常实验室工作的一致性。
EQA用来评估某实验室与其他实验室之间得出结果的符合率。
在大规模的EQA计划中,通过对参与实验室结果的回顾性分析,不仅能帮助EQA成绩差的实验室改善操作,也能找出由于试剂与方法问题导致结果不准确原因。
2、室间质量操纵(EQA)2.1 大规模EQA方案能提供分析方法有关性能的信息,包含方法的原理,试剂与设备。
EQA方案能使参与实验室间相互联系,以改善实验室操作,并在减少实验室间检测结果的可变性及促进个体实验室操作能力方面发挥积极作用。
2.2 对个体实验室操作能力的评估是EQA方案最基本的构成部分。
WFH EQA方案将相同样本在参与实验室与国际血友病培训中心(IHTCs)实验室间进行比较。
实验结果不满意的原因有很多,有些原因是比较易见的,但根本问题的确定却并非简单。
大规模EQA方案能发现由于试剂与方法学差异而导致的误差。
2.3 保密性是所有EQA与上述国际性EQA方案的重要特征,个体实验室能力的有关信息不能泄漏给非部门领导者。
3、室内质量操纵 (IQC)3.1 室内质量操纵的目的:室内质量操纵用来确定在一段时间内一系列的技术与方法所得出的结果是否始终保持一致。
质量操纵(QC)通常用于描述所建立的检测方法是否足够可靠,以协助临床对止血特殊性疾病的推断、治疗、监测及诊断。
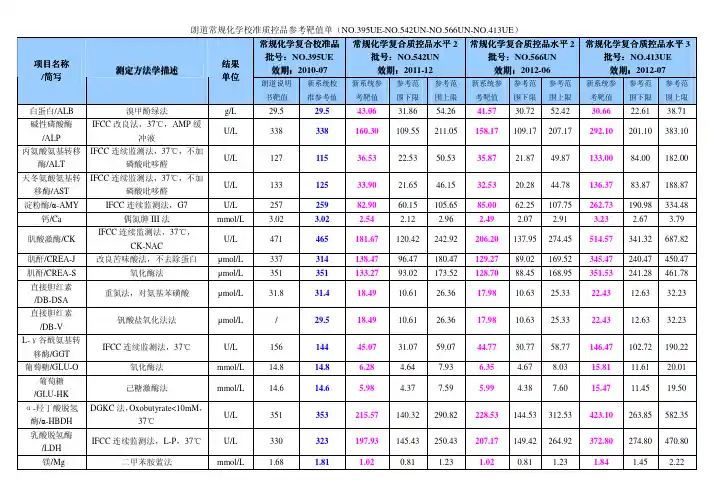
凝血功能常规质控SOP程序一、选择质控品我室采用与仪器配套的Stago公司出品的Stago Control N+P,包括N(正常值)和P(异常值)二、建立质控文件1、将一个新批号的质控品的条码页平缓地从条码读取窗前移动,则该批号的质控信息自动被仪器扫描录入2、在应用程序中建立质控文件:根据PT±15%,APTT±15%,FIB±15%,TT±15%的误差要求确定每个项目的SD并将、SD录入电脑,建立质控文件。
3、二水平, 连续5天检测20次,确定靶值。
4、室内质控使用Levey-Jennings图,失控判断使用Westgard多规则方法,可选择多规则使用,但至少包含反映系统误差和随机误差。
每天实时录入和评估质控测定数据,决定是否校正定标,保证当天病人结果的可靠性、准确性,可否签发报告等。
5、常用判断失控的质控规则有12S:一个质控结果超过X+2S,如出现符合这一条件的质控数据,提示警告;提示存在随机误差的质控规则有12.5S 13S R4S( 同批连续两质控结果之差值超过4S);提示存在系统误差的质控规则有22S41S7X10X(连续十个质控结果在均数一侧)。
6、以总允许误差(TEa)确定质量目标,可根据室间质评标准,参考美国CLIA`88能力比对检验(PT)的评价限和国内的CCV,结合本实验室的测定精密度,制定出本室各项目的TEa。
通常要求误差检出率(Ped)达90%以上,假失控概率(Pfr) 5%以下可满足一般实验室的要求。
增加Ped 同时也会增加Pfr。
TEa =RE+SE三、质控测定1、质控品要与临床标本同样条件下进行测定,随机进行2、早上7:30将质控品从冰箱中取出,置室温中10~15分钟平衡,打开盖子,用标准移液管准确吸取1ml去离子水或灭菌用注射用水,加入复溶,室温静置待干粉完全溶化,轻轻旋转混匀(不能颠倒混匀)再放置几分钟,整个过程大概需要20~30分钟,在混匀过程中避免剧烈振摇而产生气泡。
质控血清靶值说明书货号:HN1530 规格:20 x 5ml批号:1255UN 效期:2021-10-28【预期用途】该类质控血清可用在多种型号的全自动生化分析仪上对临床化学分析项目进行质量控制的评价。
【检验原理】质控血清分为两个水平,水平 2 和水平 3。
我们为所列分析物提供两个水平范围的靶值和参考范围。
该产品为水平 2。
【主要组成成份】试剂成分:人血清基质【储存条件及有效期】1. 试剂的稳定性开封:冷冻贮存( 2-8℃)。
复溶血清 25℃稳定 8 小时,4℃稳定 7 天,-20℃冻时至少稳定1 个月(见局限性)。
未开封:冷冻贮存( 2-8℃)。
每个独立试剂瓶都可稳定保存到有效期。
2. 有效期:四年。
【适合机型】雅培AEROSET®、Bayer ADVIA l650®、雅培Architect c8000/ei8200®、BAYERRA500/1000/2000/XT/OPERA®、Bayer Ciba 550 Express®、COBAS INTEGRA®、COBAS MIRA®、DADE DIMENSION®、HITACHI SERIES®、JOHNSON AND JOHNSON VITROS®、Konelab 20/30/60®、OLYMPUS AU400/500/600/800®、SYNCHRON CX4/5/7/9/LX20、VITALAB SELECTRA®等全自动生化分析仪。
【检验方法】质控血清处于冻干状态。
1. 在 20℃至 25℃,使用 5 m1 蒸馏水将每瓶冻干血清复溶。
密封使用前静置 30 分钟。
轻微搅动使内容物完全溶解。
避免形成泡沫。
不可摇动。
2. 参考独立分析仪实际应用的质控范围。
3. 冷冻任一未使用的原料。
重新使用前,将内容物完全混合。
【所需未提供的产品】容量吸管【赋值】提交给参考实验室的每批实验用人体血清根据国际参考标准进行赋值。
哈尔滨国生生物鸡禽流感血凝说明书哈尔滨国生生物鸡禽流感血凝说明书一、产品概述哈尔滨国生生物鸡禽流感血凝是一种用于检测禽流感病原的检测试剂盒,采用鸡红细胞为受体,配制特异性抗体作为试剂,可通过血凝反应来判断样品中是否存在禽流感病原。
二、产品组成1. 抗鸡红细胞血清:用于抗凝试管内配制抗体;2. 洗涤缓冲液:用于洗涤红细胞与样品;3. 试管:用于反应的容器;4. 衰凝试剂:含特异性抗体和配平蛋白质,用于判断是否存在禽流感病原;5. 正样品:含已知禽流感病原的样品,用于检验试剂的灵敏度和特异性;6. 阴性对照:不含禽流感病原的样品,用于验证试剂的准确性;7. 说明书:详细介绍操作步骤、存储条件及注意事项等。
三、产品性能1. 灵敏性:本试剂对常见的禽流感病原具有较高的灵敏性,可快速准确地进行检测;2. 特异性:本试剂对禽流感病原有较好的特异性,能够排除与其他病原相互干扰;3. 稳定性:本试剂在规定的存储条件下,有效期为一年;4. 准确性:经过严格的质量控制,确保试剂的准确性和可靠性。
四、使用方法1. 取出所需试剂,将血清试剂保存在2-8℃的冰箱中;2. 取出试剂时,将其恢复至室温;3. 样品准备:将待测样品加入洗涤缓冲液中,按比例混合均匀;4. 取一定量的鸡红细胞试剂放入试管中;5. 加入样品,轻轻混匀,避免气泡产生;6. 将试管放置在离心机中,离心5分钟,倒掉上清液;7. 加入一定量的洗涤缓冲液,轻轻混匀,离心5分钟,倒掉上清液;8. 加入适量的血清试剂,轻轻混匀;9. 加入试管中适量的衰凝试剂,轻轻混匀后置于37℃恒温水浴中;10. 观察血凝反应的结果:阳性样品会形成凝血团,阴性样品不会产生凝血团。
五、结果判读1. 阳性样品:样品中存在禽流感病原,会观察到明显的凝血团;2. 阴性样品:样品中不存在禽流感病原,不会产生凝血团;3. 无效样品:操作不当或试剂失效,无法得出准确结果。
六、注意事项1. 本试剂仅供实验室科研使用,禁止用于临床诊断;2. 使用前请仔细阅读说明书,按说明书操作,避免操作错误;3. 使用过程中,请严格遵守无菌操作规范,避免污染样品;4. 请储存在2-8℃的阴凉干燥处,避免阳光直射;5. 试剂过期、变质或出现异常时,请勿使用;6. 请勿将试剂直接接触皮肤和黏膜,如不慎接触,请用清水冲洗。
R A N D X免疫分析专用质控品货号: IAS3114 包装: 5 x 2 ml批号: 1522EC 效期: 2017-04产品描述本品为免疫分析专用质控品,又称免疫特殊质控І,适用于临床化学体外诊断的免疫质控,用于监测免疫测定的正确度或重复度。
朗道供应3个浓度水平(水平1:IAS3113;水平2:IAS3114;水平3:IAS3115)。
安全预防措施和警告本产品仅用于体外诊断。
禁止用口吸。
按照实验室常规预防措施对试剂进行处理。
该质控品采用人基质血清,对所有捐献者的血清均进行了HIV(HIV1、HIV2)抗体、肝炎B表面抗原(HbsAg)和肝炎C病毒(HCV)抗体的测试,发现均呈阴性。
所采用的方法均经FDA认证。
然而,既然没有一种方法能够完全保证其没有传染物质,因此该质控品和所有的病人样品均应当按照能够传播疾病的样品小心处理。
保存和稳定性开瓶后,2~8℃保存。
复溶后的血清如果保存在原始容器,并且无污染,可在2~8℃保存5天,-20℃冷冻保存4周,只能冻融一次。
抗甲状腺球蛋白(Anti-TG)在2~8℃可稳定3天,C肽、类胰岛素一号增长因子(IGF-1)、降钙素原(PCT)在2~8℃可稳定1天,骨钙素在2~8℃可稳定4小时。
甲状旁腺素(PTH)复溶后如果2~8℃保存,要在4小时内检测;若-20℃以下保存,则须在2周内检测。
每次使用只吸取所需用量,剩余的样品不可返回原瓶。
未开瓶,2~8 ℃可保存至效期末。
复溶后的血清在受到细菌污染后,会导致许多组分稳定性的下降, 应该将该瓶样品抛弃,重新复溶一瓶新的血清。
使用说明该免疫分析专用质控品Ⅰ为冻干粉。
1.小心打开瓶盖,往瓶中加入2 ml蒸馏水,在15~25 ℃的条件下复溶,盖上瓶盖,放置30分钟。
轻轻翻转瓶子,确保内容物完全溶解,不要振荡,避免气泡的产生。
2.参照各个分析仪的质控说明。
3.冷藏未使用的材料,再次使用前,确保样品充分混合均匀。
需要自备的材料移液管,蒸馏水赋值每一批质控血清都要送到大量的参考实验室,这些实验室通过独特的统计分析方法得到一个结果进行赋值。
纤维蛋白原凝结时间测定(Fibrinogen coagulative time, FIB)【目的】用于判定血栓前状态或血栓性疾病的必查项目【操作人员】本实验室实验人员。
【原理】采用clauss法,即在待稀释血浆中加入高浓度的凝血酶,血浆凝固时间与血浆纤维蛋白原浓度成反比。
【方法学溯源】:纤维蛋白原测定(Clauss法)原理:凝血酶将可溶性的血浆蛋白纤维蛋白原转化为不溶性的多聚体,纤维蛋白。
当凝血酶浓度较高(约为100NIH/ml)且纤维蛋白原浓度较低(0.05—0.8g/L)时该反应决定于纤维蛋白原浓度。
如在双对数坐标纸上画点,凝血酶凝块时间与纤维蛋白原浓度相比较呈线形关系。
【仪器】:型号:MC-4000 PUS血液凝血分析仪【试剂】:1. 凝血酶试剂(Thrombin Reagent)(1)商标:美创(MDC Hemostasis)(2)包装规格:2.0ml×10瓶(3)成分:冻干牛凝血酶冻干粉(lyophilized preparation of bovine thrombin)(近似100 NIH units/ml)使用前用蒸馏水复溶,轻轻摇动至完全溶解.溶后的凝血酶2~8℃存放可稳定一周,溶解后4小时内-20℃冻存,可以稳定一个月.冻存的凝血酶应37℃快速复溶,避免反复冻溶.2.咪唑缓冲盐水(pH7.4±0.2)135ml/瓶该缓冲液以叠氮钠为防腐剂,叠氮钠如遇酸将产生有毒化合物,因此,含有该试剂的容器/试管及丢弃的试剂均应用大量流水冲洗.此外,亦应避免该试剂在金属管道内沉积.【参考范围】:200~400mg/dl【样本采集】:109 mmol/L 枸橼酸钠与血液按9∶1混合,RCF 2500×g(3000转/分)离心10分钟,分离血浆待检。
室温下两小时内检测,否则冻存。
【操作步骤】1、取50μl血浆加入450μl咪唑盐水(IBS)中,作1:10稀释。
2、取1:10稀释的血浆100μl,37℃预热2分钟,然后加入50μl已预热的凝血酶试剂,仪器自动记录凝固时间(步骤2在血凝仪上完成)【参考范围】200~400mg/dl【注意事项】1.分离的血浆中不应含有细胞成分;2.纤维蛋白原含量低于150mg/dl/L,而血浆FDP含量明显升高时,可致标本的测定结果较实际低。
PAGE 1OF 7
COAGULATION CONTROL - LEVEL 2 (COAG CONTROL 2)
Cat No. CG5022 Lot No. 138CG Size: 12 x 1ml Expiry: 2014-07
INTENDED USE
This product is intended for in vitro diagnostic use and in the quality control of coagulation systems. The Coagulation Controls are for the control of accuracy and precision.
DEVICE DESCRIPTION
The Coagulation Controls are supplied at 3 levels, level 1, 2 and 3. Target values and ranges are supplied for the analytes listed in the values section.
SAFETY PRECAUTIONS AND WARNINGS
The controls are intended for in vitro diagnostic use only. Do not pipette by mouth. Exercise the normal precautions required for handling laboratory reagents and controls.
Human source material which has been added has been tested at donor level for the Human Immunodeficiency Virus (HIV 1, HIV 2) antibody, Hepatitis B Surface Antigen (HbsAg), and Hepatitis C Virus (HCV) antibody and was found to be NON-REACTIVE. FDA approved methods have been used to conduct these tests.
However, since no method can offer complete assurance as to the absence of infectious agents, this material and all patient samples should be handled as though capable of transmitting infectious diseases and disposed of accordingly.
Health and Safety Data sheets are available on request.
STORAGE AND STABILITY
OPENED: Store refrigerated (+2°C to +8°C). APTT, TT, PT, Fibrinogen and Antithrombin III in reconstituted serum are stable for 24 hours at +2°C to +8°C if kept capped in original container and free from contamination. Protein C, Protein S, Plasminogen, and Factors II, V, VII, VIII, IX, X, XI, XII are stable for 8 hours at +2°C to +8°C. Only the required amount of product should be removed. After use, any residual product should NOT BE RETURNED to the original vial.
UNOPENED: Store refrigerated (+2°C to +8°C). Stable to expiration date printed on individual vials.
PREPARATION FOR USE
The Coagulation Controls are supplied lyophilised.
1. Carefully reconstitute each vial of lyophilised control with exactly 1ml of distilled water at +15°C to +25°C. Close
the bottle and allow to stand for 30 minutes before use. Ensure contents are completely dissolved by swirling gently. Avoid the formation of foam. Do not shake the vial.
2. Refer to the Control section of the individual analyser application.
3. Refrigerate any unused material. Prior to reuse, mix the contents of the vial thoroughly.
MATERIALS PROVIDED
Coagulation Control - Level 2 12 x 1ml
MATERIALS REQUIRED BUT NOT PROVIDED Volumetric pipette Distilled water
ASSIGNED VALUES
Each batch of Coagulation Control is submitted to a number of external laboratories. Values are assigned from a consensus of results obtained by these laboratories and internal testing conducted at Randox Laboratories Ltd. The expected range of the mean is provided to aid laboratory until it has established its own mean and SD for its test methods.
11 May ’12 ne。