溶解度与溶质质量分数
- 格式:ppt
- 大小:336.00 KB
- 文档页数:3

溶质质量分数的计算是初中化学基本计算的重要内容,也是化学计算教学的难点之一,现将教学实践中归纳的溶质质量分数计算的方法罗列如下:一、常规物质溶解于水氯化钠、硝酸钾等物质溶解于水时,溶于水中的物质质量即为溶质质量,所加水的质量即为溶剂的质量。
在溶液的饱和与不饱和问题上考虑问题的方法,稍有不同。
例:现将20g硝酸钾加入到80g水中,全部溶解,求所得到的溶液的溶质质量分数?解:所得溶液的溶质质量分数为:20g/(20g+80g)*100%=20%答:(略)二、酸性氧化物或碱性氧化物溶解于水当可溶性的酸性氧化物或碱性氧化物溶解于水时,它们能与水发生化学反应而生成相应的酸或碱,因此,在此类问题的处理上应该考虑到:溶解后溶液中真正的溶质是变化后生成的酸或碱,溶剂的质量少于所加入的水的质量。
例1:8g三氧化硫加入到92g水中完全溶解,求所得溶液的溶质质量分数?解:设反应中生成的硫酸质量为xSO3 + H2O = H2SO480 988g x80/98=8g/x 解得:x=9.8g 所得溶液的溶质质量分数为9.8g/(8g+92g)*100%=9.8% 答:(略)例2:将6.2g氧化钠加入43.2g水中,求完全溶解后所得溶液的溶质质量分数?(注:氧化钙溶于水形成溶液的溶质质量分数的求解与上述情况不完全相同,因为它溶于水形成的氢氧化钙微溶于水,有时不能完全溶解在水中,故在计算此类问题时,我们要注意各物质的质量.)三、结晶水合物溶于水形成溶液结晶水合物溶于水时,“结晶水”与所加入的水一起作溶剂,结晶水合物中的“另一部分”做溶质。
例:现将25g硫酸铜晶体加入到75g水中,晶体完全溶解,求所得溶液的溶质质量分数?解:设溶质的质量为x25g·CuSO4/CuSO4·5H2O=25g·160/250=16g所得溶液的溶质质量分数为: 16g/(25g+75g)·100%=16%答:(略)四、根据溶解度求溶质的质量分数结合溶解度的概念,溶解度(溶质质量)对应的溶剂质量为100g,故根据溶解度求溶质质量分数可以按下式求解饱和溶液的溶质质量分数=溶解度/(100g+溶解度)·100%例:已知20℃时食盐的溶解度为36g,求这一温度下食盐饱和溶液的溶质质量分数?解:20℃时食盐饱和溶液的溶质质量分数为:36g/(100g+36g)·100%=26.5答:(略)五、已知溶液中某种离子与水分子的个数比,求溶液的溶质质量分数。


专题06溶液、溶解度和溶质的质量分数【知识网络】定义:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物组成:溶质和溶剂定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量固体大多数固体物质的溶解度随温度的升高而增大,如KNO3溶解度变化规律:少数固体物质的溶解度受温度的影响很小,如NaCl溶解度极少数固体物质的溶解度随温度的升高而减小,如C a(O H)2常用溶解度曲线表示气体溶解度:随温度升高而减小,随压强增大而增大溶液溶质的质量分数= ×100%配制溶质的质量分数一定的溶液的步骤:计算、称量、溶解定义:固体溶质从饱和溶液中析出的过程方蒸发溶剂,适于溶解度受温度的影响不大的物质结晶法冷却热的饱和溶液,适于溶解度受温度的影响变化大的物质放热,如:NaOH 浓H2SO4溶解现象吸热,如NH4NO3变化不明显,如NaCl乳化现象:洗洁精洗衣物和餐具上油污是发生了乳化现象【考点梳理】考点一、溶液、溶解现象、饱和溶液和不饱和溶液1.溶液(1)定义:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
(2)组成:溶质和溶剂。
(3)特征:溶液具有均一性和稳定性。
均一性指溶液各部分密度、浓度、性质都相同。
稳定性指外界条件不改变,溶液久置不出现沉淀,不分层。
2.溶解现象(1)影响溶解快慢的因素①溶剂的温度:温度越高,溶解越快。
②固体溶质的颗粒大小:颗粒越小,溶解越快。
③搅拌加速溶解。
(2)溶解时的吸热和放热现象物质溶解时,往往会引起温度的改变。
溶解的过程发生两个变化:①溶质的分子或离子向水中扩散的过程,要吸收热量;②溶质的分子或离子与水分子作用形成水合分子或水合离子过程,要放出热量。
当吸热大于放热时,溶液温度降低,反之升高。
(3)溶于水温度升高的物质:氢氧化钠、浓硫酸等,溶于水温度降低的物质:硝酸铵等。
3.正确区分乳化现象和溶解现象(1)乳化是使用乳化剂将植物油(的油珠)分散成无数细小的液滴存在于水中而不能聚集。

【主要内容】一、溶解度(一)固体溶解度1.概念:在一定温度下,某固态物质在100 g溶剂(通常溶剂为水)里达到饱和状态时所溶解的质量。
溶解度的概念包括四个要素:①指明一定温度;②溶剂为100 g;③必须达到饱和状态;④单位为g。
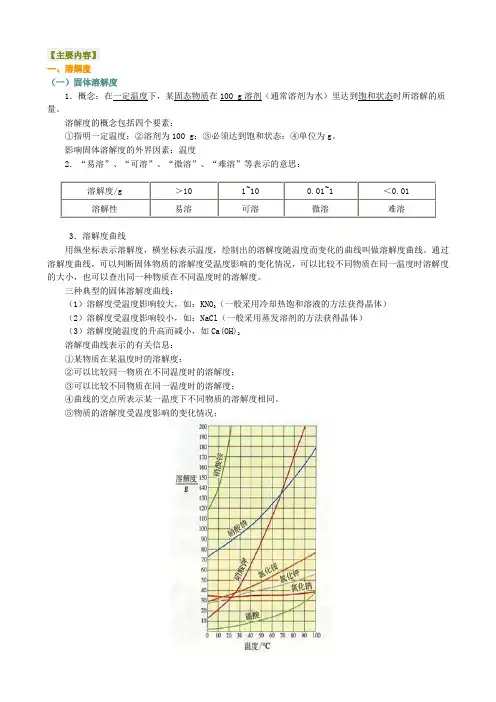
影响固体溶解度的外界因素:温度2.“易溶”、“可溶”、“微溶”、“难溶”等表示的意思:溶解度/g >10 1~10 0.01~1 <0.01溶解性易溶可溶微溶难溶3.溶解度曲线用纵坐标表示溶解度,横坐标表示温度,绘制出的溶解度随温度而变化的曲线叫做溶解度曲线。
通过溶解度曲线,可以判断固体物质的溶解度受温度影响的变化情况,可以比较不同物质在同一温度时溶解度的大小,也可以查出同一种物质在不同温度时的溶解度。
三种典型的固体溶解度曲线:(1)溶解度受温度影响较大,如:KNO3(一般采用冷却热饱和溶液的方法获得晶体)(2)溶解度受温度影响较小,如:NaCl(一般采用蒸发溶剂的方法获得晶体)(3)溶解度随温度的升高而减小,如Ca(OH)2溶解度曲线表示的有关信息:①某物质在某温度时的溶解度;②可以比较同一物质在不同温度时的溶解度;③可以比较不同物质在同一温度时的溶解度;④曲线的交点所表示某一温度下不同物质的溶解度相同。
⑤物质的溶解度受温度影响的变化情况;(二)气体的溶解度1.概念:气体的溶解度是指在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
影响气体溶解度的因素:温度和压强。
一般情况下,气体的溶解度随外界压强的增大而增大;随温度的升高而降低。
气体溶解度在实际测定时比较复杂,非标准状况下的数据还应该换算成标准状况下的值。
固体溶解度和气体溶解度的比较:固体溶解度气体溶解度外界条件在一定温度下在压强为101kPa和一定温度时衡量标准溶剂(通常指水)量为100g 1体积水里溶液状态饱和饱和单位溶解溶质的质量(克g) 溶解气体的体积(无单位)影响其大小温度温度和压强的外界因素二、溶质的质量分数溶液的浓稀、有色溶液的颜色都可以粗略的表示一定量的溶液中含有溶质的多少,溶液中溶质的质量分数可以准确地表示一定量的溶液中含有溶质的多少。

溶解速率公式
溶解度的计算公式:m(溶质)/ m(溶剂) = s(溶解度) / 100g (溶剂)饱和溶液中溶质质量分数= [s/ (100g +s)] * 100%。
溶解度的符号是S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度,物质的溶解度属于物理性质。
物质溶解与否,溶解能力的大小,一方面决定于物质(指的是溶剂和溶质)的本性;另一方面也与外界条件如温度、压强、溶剂种类等有关。
在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同。
通常把某一物质溶解在另一物质里的能力称为溶解性。
例如,糖易溶于水,而油脂不溶于水,就是它们对水的溶解性不同。
溶解度是溶解性的定量表示。
溶解度的变化原理:
气体的溶解度大小,首先决定于气体的性质,同时也随着气体的压强和溶剂的温度的不同而变化。
例如,在20℃时,气体的压强为1.013×105Pa,一升水可以溶解气体的体积是:氨气为702L,氢气为0.01819L,氧气为0.03102L。
氨气易溶于水,是因为氨气是极性分子,水也是极性分子,而且氨气分子跟水分子还能形成氢键,发生显著的水合作用,所以,它的溶解度很大;而氢气、氧气都是非极性分子,所以在水里的溶解度很小。
当压强一定时,气体的溶解度随着温度的升高而减少。
这一点对气体来说没有例外,因为当温度升高时,气体分子运动速率加快,容易自水面逸出。

溶解度和溶质的质量分数(基础)【学习目标】1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。
2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。
3.初步学会配制一定溶质质量分数的溶液。
【要点梳理】要点一、饱和溶液、不饱和溶液1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。
2.不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时的溶液,叫做不饱和溶液。
3.饱和溶液、不饱和溶液的转化方法:大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体):4.判断溶液是否饱和的方法:一般说来,可以向原溶液中再加入少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。
【要点诠释】1.饱和溶液、不饱和溶液概念的理解(1)首先要明确“一定条件”、“一定量的溶剂”。
在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。
如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。
所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。
(2)必须明确是某种溶质的饱和溶液或不饱和溶液。
如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。
2.由于Ca(OH)2的溶解度在一定范围内随温度的升高而减小,因此将Ca(OH)2的不饱和溶液转化为饱和溶液,在改变温度时应该是升高温度;将熟石灰的饱和溶液转化为不饱和溶液,在改变温度时应该是降低温度。
要点二、溶解度、溶解度曲线1.固体的溶解度:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。

溶液的基本概念溶解度【知识梳理】1.溶液(1)概念:一种或几种物质到另一种物质里,形成的的混合物。
(2)组成:溶质:的物质,可以是体,也可以是体或体。
溶剂:的物质,水是常见的溶剂,酒精,汽油也可以做溶剂。
一般来说,如果溶液组成中有水存在,则把水当作溶剂,如果是固体和液体形成溶液,则固体为溶质,液体为溶剂,如果两种液体形成溶液,则量多的为溶剂,量少的为溶质.(3)特征:均一性、稳定性、混合物均一性:溶液中各部分的都相同。
如:稳定性:外界条件(,,气体压强)不变时,溶液不会2、乳浊液由小液滴分散到液体里形成的混合物是乳浊液.由于小液滴是许多分子的集合体,无论在质量还是体积上都比单个分子大的多.所以无法均一地分散到水分子中,因而不稳定,静置一段时间后会分层.乳浊液的应用也十分广泛,日常生活中常遇到的牛奶、油漆、橡胶的乳胶等都是乳浊液.但是这些乳浊液往往都有一个共同的缺点——难以清洗,一旦沾到衣物上,很难被水清洗掉,怎么办泥?其实这个问题也好解决,加点儿乳化剂就可以,常用的乳化剂有肥皂、洗涤剂等,乳化剂能使小液滴分散成无数细小的液滴,而不聚集成油珠.这些细小的液滴比单个分子略大,能随水流走,衣服、餐具上的油污可以用加入洗涤剂的水洗掉,就是这个道理。
3、溶解时的吸热或放热现象:物质NaCl、NH4NO3、NaOH三种物质:溶解后放出热量,使温度升高的是;吸收热量,使温度降低的是;温度没有明显变化的是。
4、饱和溶液和不饱和溶液1)饱和溶液在一定下,向一定量的里加入某种溶质,当溶质时,所得到的溶液叫做这种溶质的饱和溶液。
如:2)不饱和溶液在一定下,向的溶剂里加入某种溶质,当溶质时,所得到的溶液叫做这种溶质的不饱和溶液。
如:3)判断溶液是否饱和:①、溶液中没有固体时,加入,若说明溶液是饱和的;②、溶液中有固体时,看固体质量是否减少,若说明溶液是饱和的;4)③、当溶液中有晶体析出时,析出晶体后的溶液是溶液。
5)饱和溶液与不饱和溶液的转化:饱和溶液不饱和溶液6)浓溶液与稀溶液a)浓溶液是在一定的溶液中含溶质的溶液。

溶解度怎么求
溶解度计算方法
溶解度是什么
温度会影响物质的溶解度,因此对于固体来说,其溶解度一般是在一定温度下来表示的。
在一定温度下,某固态物质在100g 溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
溶解度计算方法
物质的溶解度可以根据溶解度的计算公式来计算,具体为:溶质的质量分数=饱和溶液中溶质的质量/饱和溶液中溶剂的质量×100%。
物质的溶解度不仅与溶质和溶剂的性质有关,也与温度、压力等条件有关。
对于气体来说,其溶解度一般是在一定压强下来表示的。
气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积溶剂里的体积数。
也常用“g/100g溶剂”作单位。
在一定的温度和压力下,物质在一定量的溶剂中溶解的最高量。
一般以100克溶剂中能溶解物质的克数来表示。
溶解度的计算公式:m(溶质)/m(溶剂)=s(溶解度)/100g (溶剂)。
— 1 —。

精品整理页脚内容第十一讲 质量分数的相关计算核心知识1、溶质质量分数定义:溶质质量分数就是溶质质量与溶液质量的比值,其表达式为:%100⨯=溶液质量溶质质量溶质质量分数或2、溶解度与饱和溶液的溶质质量分数的关系在一定温度下,饱和溶液的溶质质量分数可由溶解度得到:3、配制一定质量分数的溶液的计算方法配制前的溶质质量=配制后的溶质质量,有两种情况: (1)用固体配制:固体质量=溶液质量×溶质质量分数;(2)用浓溶液配制稀溶液:浓溶液质量×浓溶液的溶质质量分数 =稀溶液质量×稀溶液的溶质质量分数 4、化学反应中的质量分数计算,核心要点就是找准溶质,并算出溶质和溶液的质量,常用的方法就是质量守恒和由化学方程式计算。
质量分数的基本计算1、将10.8g 固体氢氧化钠完全溶于49.2g 水,配成密度为1.2g/cm 3的溶液,则该溶液的质量分数为多少?2、要配制200g 质量分数为0.9%的NaCl 溶液,需要NaCl 多少g 和H 2O 多少mL ?3、配制980g 10%的稀硫酸需要多少mL 质量分数为98%的浓硫酸?(98%的浓硫酸密度为1.84g/cm 3)4、把200g 质量分数为10%的CaCl 2溶液稀释为4%的溶液,应该加水多少mL ?5、已知某物质的水溶液中有90g 水,取样5g 检测,发现其中有溶质2g ,则原溶液中有溶质多少g ? 溶解度与饱和溶液的质量分数6、已知在20o C 时氯化钠的溶解度为36g ,求20o C 时: (1)9g 氯化钠溶于25g 水中,所得溶液的质量分数; (2)12g 氯化钠溶于25g 水中,所得溶液的质量分数; (3)5g 氯化钠溶于25g 水中所得溶液的质量分数。
7、已知50o C 时氯化铵的溶解度为50g ,则此温度下1800g 氯化铵饱和溶液中含水多少g ?8、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的溶解度为170g ,问:把一瓶10o C 时的硝酸钾饱和溶液升温到80o C 后的溶质质量分数为多少?9、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的溶解度为170g ,问:把一瓶80o C 时的硝酸钾饱和溶液降温到10o C 后的溶质质量分数为多少?有多少g 固体析出?10、已知硝酸钾10o C 时的溶解度为22g ,80o C 时的溶解度为170g 。
滚动小专题(二)溶解度和溶质的质量分数类型1溶解度曲线1.溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是(B)A.升高温度溴酸银的溶解度增大B.40 ℃时溴酸银易溶于水C.90 ℃时溴酸银溶液的溶质质量分数一定小于1.3%D.溴酸银可用降温结晶的方法从溶液中析出2.(2019·广元)如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是(A)A.t1℃时,甲、乙两种物质的溶解度相等B.由t2℃降温到t1℃,甲物质的饱和溶液变为不饱和溶液C.t2℃时,将40 g甲物质加入50 g水中,充分溶解后溶液的质量为90 gD.甲物质中混有少量的乙物质,可用蒸发结晶的方法提纯甲3.(2020·菏泽)如图是甲、乙两种物质的溶解度曲线。
下列说法正确的是(C)A.甲的溶解度比乙的溶解度大B.a2℃时,将30 g甲放入50 g水中充分搅拌可得80 g溶液C.a1℃时,甲、乙两种物质的饱和溶液溶质的质量分数相同D.将a1℃时甲、乙两种物质的饱和溶液升温至a2℃,溶质的质量分数都增大4.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
下列说法正确的是(C)A.甲和丙的溶解度相等B.在t2℃时,将28 g甲物质加入50 g水中,充分溶解后所得溶液的质量为78 gC.将t2℃甲的饱和溶液降温到t1℃,有晶体析出D.将t1℃甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲>乙>丙5.两个烧杯中分别盛装X、Y的饱和溶液,两支试管中分别装有NaOH和NH4NO3固体,向两支试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是(D)A.Y的溶解度曲线为b曲线B.降温可使X的饱和溶液变浑浊C.X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大D.t3℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y6.如图是甲、乙两种物质的溶解度曲线。
溶质质量分数的计算公式和定义
一、溶质质量分数的计算公式和定义
1、公式:溶质的质量分数=溶质质量溶液质量×100%溶质的质量分数=溶质质量溶液质量×100%
2、定义:溶质质量与溶液质量之比,是一种表示溶液浓度的方法,通常以百分数表示。
3、扩展:溶质质量分数和溶解度的区别是,溶质质量分数是指在任意温度、任意溶液下溶质质量和溶液质量的比例,而溶解度是指在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
4、注意:
①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必
须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
二、溶质质量分数相关例题
20℃时,将50g NaCl放入100g水中,充分搅拌后所得NaCl 溶液的溶质质量分数是____(20℃时NaCl的溶解度为36g)。
答案:26.5%
解析:由溶解度概念知,20℃时100g水中最多能溶解36g NaCl,而题目却给出了50g,很显然NaCl未完全溶解,溶液已达到饱和。
故该溶液中 NaCl的质里分数
=36100+36×100%=265%=36100+36×100%=265%。
一、关于溶解度的计算的类型1、溶解度概念:在一定温度下,某物质在100 克溶剂中达到饱和状态时所溶解的溶质质量为该物质在这种溶剂里的溶解度。
溶解度公式:溶解度=m 溶质/m 溶剂 × 100g 注意:(1) 四个关键词:一定的温度,100克溶剂、达到饱和、溶质的质量 (2)溶解度就是一定温度下,100g 溶剂中能溶解的溶质的最大质量 (3)溶解度单位为克(g )2、溶解度曲线:温度为横坐标,溶解度为纵坐标形象地看出物质的溶解度随温度变化情况。
(1) 大多数物质的溶解度随着温度的升高而增大①影响很大,如硝酸钾,表现为曲线陡②影响不大,如氯化钠(食盐),表现为曲线平缓(2) 极少数物质的溶解度随着温度的升高而减小,如氢氧化钙,气体等 二、溶质质量分数的计算 1、溶质质量分数 =0100 溶液质量溶质质量2、溶液质量与体积之间的换算:溶液质量(克)= 溶液体积(毫升)× 溶液密度(克/毫升)3、溶液的稀释:m 浓溶液 × a % = m 稀溶液 × b % (a >b ) 其中:m 稀溶液 = m 浓溶液 + m 水若用溶质质量分数不同(a %、b %)的溶液A 、B ,配制中间溶质质量分数的溶液(c %), 则: m A ×a % + m B ×b % =(m A + m B )×c % 三、溶解度与质量分数的比较。
甲乙溶解度 g0 t 1 t 2 温度/℃305020 40 10初中化学总复习溶解度曲线专题练习9.右图所示曲线a 、b 、c 分别代表A 、B 、C 三种物质的溶解度曲线。
下列说法错误的是( )A .t 1 ℃时,三种物质溶解度大小的顺序是B >C >AB .t 2℃时,A 和B 两种物质的饱和溶液中溶质质量相同C .t 3℃时,在100g 水里分别加入三种物质各mg ,只有b 能形成饱和溶液D .从混有少量C 的A 物质中提取较纯净的A ,最适宜用蒸发溶剂的方法 10.右图是a 、b 、c 三种固体的溶解度曲线,下列说法正确的是( ) A .b 的溶解度一定小于a 的溶解度B .当a 中含有少量b 时,可以用降温结晶的方法提纯aC .通过降低温度可将c 的不饱和溶液变为饱和溶液D .a 的饱和溶液从t 2℃降温至t 1℃时变为不饱和溶液11.有关a 、b 两种物质的溶解度曲线如图所示,下列叙述不正确的是( ) A .a 物质的溶解度随着温度的升高而增大B .在t 2℃时,a 、b 两种物质的溶液中溶质的质量分数一定相等C .将a 、b 两种物质的饱和溶液从t 3℃降温至t 1℃,a 有晶体析出,bD .t 3℃时,a 物质的溶解度大于b 物质的溶解度 12.a 、b 、c 三种物质的溶解度曲线如右图所示。
溶解度、溶质质量分数一、物质的溶解度1.溶解度的定义:在一定温度下,某物质在100 g溶剂(通常为水)里达到饱和状态时,所溶解该溶质的质量,叫做这种物质在这种溶剂里的溶解度,用字母S表示。
例:20℃,食盐的溶解度是36g/100g水,就是指在20℃,食盐在100g水里达到饱和时溶解36g 2.溶解度概念五要素:(1)一定温度;(2)指明溶质和溶剂;(3)100g溶剂;(4)达到饱和状态;(5)溶解度的单位为g/100g水。
3.物质的溶解度表:【练一练】1.正误判断:(1)l00g水中最多溶解38g氯化钠,所以氯化钠在水中的溶解度是38g/100g水。
(2)在10℃时,烧杯内水中最多溶有140g硝酸铵,故硝酸铵在水中的溶解度是140g/100g水。
(3)在60℃,100g水中溶有75g硝酸钾,所以60℃时硝酸钾的溶解度为75g/100g水。
(4)60℃,100g水中最多溶解124g硝酸钾,所以硝酸钾在这温度下的溶解度是124。
2.“60℃时,硝酸钾的溶解度是110 g/100 g水”这句话含义是什么?4.溶解度的影响因素【思考】下列两表分别列出硝酸钾、氢氧化钙在不同温度下的溶解度。
若在坐标系上用线把物质在各个温度下溶解度的点连接起来,就得到了该物质的溶解度曲线。
比较硝酸钾和氢氧化钙溶解度,并在下列坐标系上作出溶解度曲线。
大多数固体物质在水中的溶解度随温度随温度升高而增大,少数固体物质的溶解度随温度升高而减小气体物质在水中的溶解度随温度升高而减小。
气体物质的溶解度,不仅要标明一定温度,还要标明一定压强。
如:在20℃、101kPa 时,氧气在水中的溶解度为4.34×10-3g/100g 水。
(气体的溶解度也可用1体积水中溶解气体体积的最大量来表示)二、有关溶解度的简单计算1.计算公式(只适用于饱和溶液): 基础等量关系:m 溶溶液 = m 溶质+ m 溶剂公式1:=100m Sm 溶质溶剂 变形:100m S m =⨯溶质溶剂公式2:=100+m Sm S溶质溶液2.基础计算题型:题型1:求溶质、溶剂的质量:根据某物质在某温度时的溶解度,可以求出该温度时一定量饱和溶液里所含溶质和溶剂的质量。
溶解度与饱和溶液的质量分数的关系
溶解度是指在一定温度下,单位体积溶剂中最多能溶解的物质的量,通常用单位质量溶剂中溶解物质的质量来表示。
而饱和溶液是指在一定温度下,溶质在溶剂中达到最大溶解度时所形成的溶液。
溶解度与饱和溶液的质量分数有着密切的关系。
在一定温度下,溶解度越大,饱和溶液的质量分数也就越高。
这是因为在相同的温度下,溶解度与溶质在溶剂中的相互作用力有关,而溶质在溶剂中的相互作用力越强,溶解度也就越大。
举个例子,以氯化钠为例,当温度为20℃时,氯化钠在水中的溶解度为36.0g/100mL。
也就是说,在20℃下,100mL的水中最多能溶解36.0g的氯化钠。
当溶解了36.0g的氯化钠后,再往水中加入氯化钠,氯化钠就不会再溶解了,此时形成的溶液就是饱和溶液。
而饱和溶液的质量分数就是36.0g/100mL,也就是说,饱和溶液中氯化钠的质量分数为36.0%。
需要注意的是,溶解度与饱和溶液的质量分数并不是线性关系。
在溶解度较小的情况下,溶解度与质量分数之间的关系可以近似看作线性关系。
但是当溶解度较大时,溶解度与质量分数之间的关系就不再是线性关系了。
溶解度与饱和溶液的质量分数之间存在着密切的关系。
在一定温度下,溶解度越大,饱和溶液的质量分数也就越高。
这对于化学实验
和工业生产都有着重要的意义。
在实验和生产中,需要根据溶解度和饱和溶液的质量分数来确定溶液的浓度,以保证实验和生产的准确性和稳定性。