质量分数、溶解度
- 格式:ppt
- 大小:1.42 MB
- 文档页数:52



溶解度、质量分数、物质的量浓度的计算和换算之南宫帮珍创作一、知识概要(一)有关溶解度的计算在一定温度下的饱和溶液中, 溶质、溶剂、溶液间有一定量的关系.由此可进行以下计算:(1)根据饱和溶液溶质、溶剂的量推算溶解度;(2)根据溶解度求算饱和溶液所含的溶剂和溶质量;(3)根据溶解度求算饱和溶液在蒸发失落一定量溶剂后析出的结晶量;(4)由于物质在分歧温度下溶解度分歧, 可以根据分歧温度下的溶解度求算出一定量饱和溶液由于温度改变(或同时有溶剂量改变), 析出结晶的量.(5)饱和溶液中溶解度与溶质的质量分数的换算.一定温度下, 某饱和溶液溶质的溶解度:解题时要熟练运用下列比列关系:饱和溶液中(二)有关质量分数、物质的量浓度的计算有关质量分数的计算比力简单, 但注意两点:一是含结晶水化合物的浓度均按无水物含量计算;二是有些溶质溶解后与水发生了反应, 其不能直接按原物质的量暗示, 如SO3、Na2O2溶于水, 溶液浓度按H2SO4、NaOH含量计算.与物质的量浓度有关的计算有:(1)配制一定物质的量浓度所需溶质、溶剂量或浓溶液稀释用量的计算;(2)根据所溶溶质的量求算物质的量浓度、离子物质的量浓度;(3)物质的量浓度与质量分数的换算.二、例题分析例1已知某饱和氯化钠溶液体积为VmL溶液密度为dg/cm3, 质量分数为w%, 物质的量浓度为Cmol/L, 溶液中含NaCl的质量为mg.(1)用w暗示在该温度下NaCl的溶解度是____.(2)用m、V暗示溶液的物质的量浓度是____.(3)用w、d暗示溶液的物质的量浓度是____.(4)用c、d暗示溶液的质量分数是____.解析:本题没有给出具体数值, 只给出笼统符号.解题关键是:一要准确掌控饱和溶液溶解度、质量分数的实质区别和相互联系, 二要理解密度是质量分数与物质的量浓度相互换算的桥梁.(1)要求把饱和溶液的质量分数换算为溶解度:(2)要求用VmL溶液中的溶质质量m来暗示物质的量浓度:(3)要求把质量分数(W%)换算为物质的量浓度:(4)要求把物质的量浓度换算为质量分数, 实质是(3)小题的逆运算:例2 用Na2SO3和硫粉在水溶液中加热反应, 可制得Na2S2O3.10℃和70℃时, Na2S2O3在100g水中的溶解度分别为和212g.常温下, 从溶液中析出的晶体是Na2S2O3·5H2O.Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl.现取2SO3, 溶于水, 另取硫粉, 用少许乙醇润湿后(以便硫能被水浸润), 加到上述溶液中.用小火加热至微沸, 反应约1h后过滤.滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体.(1)若加入的硫粉不用乙醇润湿, 对反应的影响是______.(填写选项字母)A.会降低反应速率B.需要提高反应温度C.将增年夜反应体系的pH D.会减少产量(2)反应1h后过滤, 其目的是_______.(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外, 最可能存在的无机杂质是_______.它是由_______发生的.如果滤液中该杂质的含量不很低, 其检测的方法是:______.(4)设Na2SO3跟硫粉完全反应, 当将滤液蒸发浓缩后, 冷却至70℃, 溶液的体积约30mL, 该溶液是否到达饱和?试通过计算说明(70℃时, Na2S2O3饱和溶液的密度为/cm3).(5)若要计算在100℃下将溶液蒸发至体积为, 再冷却至10℃时所能获得的Na2S2O3·5H2O的质量, 你认为_______.(填写一个选项的字母)A.前面提供的数据已经足够B.还需要提供100℃时溶液的密度(/cm3)C.还需要提供结晶后剩余溶液的体积()(6)根据第(5)小题你的选择(如选A则直接计算, 如选B或C则可选用其数据), 计算从10℃, 溶液中结晶而出的Na2S2O3·5H2O的质量.解析:(1)硫不溶于水, 微溶于酒精.题给信息“用乙醇润湿后的硫能被水浸润”, 若不用乙醇润湿硫粉, 则硫肯定与水溶液中的Na2SO3“接触不良”而降低反应速率, 并会减少产量, 谜底应选A、D.(2)Na2SO3+S=Na2S2O3n(S)=5/32=0.16(mol),n(Na2SO3)=15.1/126=0.12(mol)硫粉过量.反应1h后过滤, 其目的是除去过量的硫粉.(3)由于Na2SO3不稳定, 在关闭容器中于100℃溶液中坚持沸腾下反应长达1h, 很容易被空气氧化成Na2SO4都不溶于水, 但BaSO3溶于酸而BaSO4不溶于酸, 加稀HCl即可检测出.但本反应中生成的S2O32—在酸性条件下会分解析出S, 干扰SO42—的检测, 所以检脸SO42—的方法应该是:取少许溶液, 加稀盐酸致酸性后, 过滤除去S, 再加BaCl2溶液.(4)(解法一)计算生成的Na2S2O3在70℃时饱和溶液应有的体积, 将它跟题设30mL相比力.若反应获得的Na2S2O3在70℃时配成饱和溶液, 其体积为x, 则因<30mL所以蒸发后的溶液尚未到达饱和.(解法二)计算70℃时30mL饱和溶液中应含Na2S2O3的质量, 将它跟反应获得的Na2S2O3的质量相比力.若该溶液是饱和溶液, 其所含Na2S2O3的质量为x, 则<24g, 溶液尚未到达饱和.(5)前题中已知生成的Na2S2O3的质量为, 如果要求得10℃时30mL溶液所析出的Na2S2O3·5H2O的质量, 还应该知道溶液中水的质量, 而溶液中水的质量=溶液质量-Na2S2O3的质量, 溶液的质量=溶液的体积(30mL)×溶液的密度.因此, 还需要知道100℃时溶液的密度, 应选B项.(6)设反应获得的Na2S2O3·5H2O的质量为x, 则x中Na2S2O3溶液中水的质量=30×1.14-18.9=15.3(g)根据10℃时的溶解度, 析出晶体后的溶液一定是饱和溶液, 则有解得:(g)三、练习与检测1.t℃时, Na2CO3的溶解度为Ag, 现有饱和Na2CO3溶液(100+A)g, 其溶质的质量分数为a%, 向溶液中投入无水Na2CO3固体Ag, 静置后析出少量晶体(Na2CO3·10H2O), 加水使晶体全部溶解, 所得溶液仍为饱和溶液, 加入的水是( )A.100g B.(100+A)g2.有X、Y、Z三种盐, 已知:(1)25℃时, X饱和溶液其溶质质量分数为15%;(2)25℃时, 在100g质量分数为10%的Y溶液中加入5gY (无水盐)后, 恰好到达饱和;(3)25℃时, 将一定量Z溶液蒸发失落水再恢复到25℃,或坚持在25℃向其中加入的结晶水合物(Z·9H2O, 摩尔质量=240), 都恰好形成饱和溶液.则25℃时, X、Y、Z的溶解度(指无水盐)年夜小顺序正确的是[ ]A.X>Y>Z B.Z>Y>XC.Y>Z>X D.Z>X>Y3.取50mL2mol/L的硫酸溶液, 跟金属锌充沛反应, 加热蒸发水, 并冷却至10℃时, 可析出ZnSO4·7H2O几多克(10℃时ZnSO4溶解度为32g, 硫酸密度/cm3)?4.A、B两种化合物的溶解度曲线如下图所示, 现要用结晶法从A、B混合物中提取A(不考虑A、B共存时, 对各自溶解度的影响)(1)取50g混合物, 将它溶于100g热水, 然后冷却至20℃.若要使A析出而B不析出, 则混合物中B的质量分数(B%)最高不能超越几多?(写出推理及计算过程)(2)取Wg混合物, 将它溶于100g热水, 然后冷却至10℃.若仍要使A析出而B不析出, 请写出在下列两种情况下, 混合物中A的质量分数(A%)应满足什么关系式?(以W、a、b暗示, 只需将谜底填写在下列横线的空白处.)当w<a+b时____当w>a+b时____5.常温下A和B两种气体组成混合物气体(A的相对分子质量年夜于B的相对分子质量), 经分析, 混合气体中只含有氮和氢两种元素;而且, 不论A和B以何种比例混合, 氮和氢的质量比总年夜于14/3.由此可确定A为____, B为____.其理由是____.若上述混合气体中氮和氢的质量比为7∶1, 则在混合气体中A和B的物质的量之比为____;A在混合气体中的体积分数为____%.参考谜底1.A;2.D;3.;4.(1)在20℃时, 若要B不析出, 该溶液中B的质量不能超越20g, 由于A、B质量共50g, 所以这时A的质量超越30g, 年夜于它的溶解度, A析出, 符合题意.即50g×B%≤20g, B%≤40%. 2)当W<a+b时, A%>a/w;当W>a+b时, A%≥W-b/W;5.NH3 N2纯NH3气体中氮和氢的质量比为14/3, 在纯NH3中混入任何比例的N2都将使氮和氢的质量比年夜于14/3 4∶1 80%.物质的量浓度的计算例析有关物质的量浓度的计算是近年的高考热点之一, 此类题着重考核对基本概念的理解水平和笼统思维能力.因此, 在解答这类题时, 要有扎实的基础知识, 能灵活运用有关化学知识全面分析问题.下面就有关物质的量浓度的计算例析如下:一、求溶液中某离子的物质的量浓度例1(1990年高考题)若20g密度为dg/cm3的硝酸钙溶液中含C..根据界说可得:=2.5d(mol/L)故谜底为C.二、求气体溶于水后的溶液物质的量浓度例2(1991年高考题)在标准状况下, 将VLA气体(摩尔质量为Mg/mol)溶于水中, 所得溶液密度为dg/mL, 则此溶液的物质的量浓度为[ ]A.Vd/(MV+2240)mol/LB.1000Vd/(MV+2240)mol/LC.1000VdM/(MV+2240)mol/LD.()dmol/L解析:题中所得溶液的溶质就是气体A, 溶液的体积:则根据界说可得:谜底为B.三、结合化学方程式求解例3(1996年高考题)用的BaCl2溶液恰好使相同沉淀, 则三种硫酸盐溶液的物质的量浓度之比是( )A.3∶2∶2 B.1∶2∶3C.1∶3∶3 D.3∶1∶1解析:根据题意, 由于与同量BaCl2反应的另三种溶液体积相同, 所以三种硫酸盐溶液的物质的量浓度之比, 实质即是介入反应的三种盐的物质的量之比, 把各反应方程式为BaCl2的系数化为1, 即BaCl2+ZnSO4=BaSO4↓+ZnCl2BaCl2+K2SO4=BaSO4↓+2KCl四、已知溶液的质量分数求物质的量浓度例4(1992年高考题)某温度下22%NaNO3溶液150mL, 加入100g水稀释后溶液的质量分数酿成14%, 求原溶液的物质的量浓度.解析:令原溶液的质量为xg, 则根据溶液稀释前后溶质质量不变得:22%×x=14%(100+x)解得x=175g直接运用有关界说得五、溶解度、质量分数与物质的量浓度之间的换算例5(1993年高考题)相对分子质量为M的某物质在室温下的溶解度为sg/100g水, 此时饱和溶液的密度为dg/mL, 则该饱和溶液的物质的量浓度是 [ ]六、求稀释后溶液的物质的量浓度例6(1989年上海高考题)VmLAl2(SO4)3溶液中含Al3+ag,再根据稀释前后溶质的物质的量坚持不变求得:故谜底为C.使用物质的量浓度公式请注意以下几点:(1)欲取一定物质的量的溶质, 或者称取它的质量, 或量取它的体积.因此, 应该熟练掌握物质的量(mol)与物质质量(g)、物质体积(V)之间的换算.主要包括:(2)物质的量浓度跟溶液中溶质的质量分数相比, 它的突出优点是便于知道或比力溶液中溶质的粒子数.根据n B =c B×V可知:①相同物质的量、相同体积的任何溶液中, 所含溶质的物质的量或基本单位(粒子)数相同.②两种分歧的溶液, 只要物质的量浓度和溶液体积乘积相等, 所含溶质的物质的量或基本单位(粒子)数也相同.③两种分歧的溶液, 若物质的量浓度和溶液体积的乘积不相等, 则所含溶质的物质的量或基本单位(粒子)数跟物质的量浓度和溶液体积之积成正比.例如, 在相同体积2H5OH溶液和葡萄糖(C6H12O6)溶液中,C2H5OH和C6H12O6物质的量相同, 所含C2H5OH和C6H12O6分子数也相同;1L、0.4 mol/LC2H5OH溶液和2L、6H12O6溶液中, C B×V之积相同, C2H5OH、C6H12O6物质的量及C2H5OH、C6H12O6分子数也相同;同体积1mol/LC2H5OH溶液和6H12O6溶液中, c B×V之积相差10倍,C2H5OH和C6H12O6物质的量之比或分子个数之比均为10∶1.配制物质的量浓度溶液的实验误差小结一、计算是否准确若计算的溶质质量(或体积)偏年夜, 则所配制的溶液浓度也偏年夜;反之浓度偏小.例1 要配制100mL1mol/LCuSO4溶液, 需称取硫酸铜晶体16g.分析把硫酸铜的质量误认为就是硫酸铜晶体的质量(CuSO4·5H2O应为25g), 招致计算值偏小, 造成所配溶液浓度偏小.二、称、量是否无误在称量或量取过程中, 若其值偏年夜, 则所配溶液的浓度也偏年夜;反之偏小.例2 要配制100mL1mol/L的NaOH溶液, 需在白纸上称4gNaOH固体, 而且称量速度较慢.分析NaOH具有腐蚀性, 不成放在白纸上而应放在烧杯或概况皿中进行称量.若称量速度较慢, 会招致NaOH部份潮解甚至蜕变, 而且还会有少量NaOH粘附在纸上, 结果会造成所配溶液浓度偏低.例3 称量时天平未调零.分析若此时天平的重心偏向左端, 会招致称量值偏小, 所配溶液的浓度也偏小;若重心偏向右端, 则结果恰好相反.例4 称量时托盘天平的砝码已被污染.分析因为砝码被污染, 质量会变年夜, 致使称量值变年夜, 因而所配溶液的浓度会偏高.例5 用量筒取液体溶质, 读数时仰视或俯视.分析读数时若仰视, 则观察液面低于实际液面, 因量筒的读数由下往上, 从小到年夜, 从而会招致观察体积小于真实体积, 故所配溶液的浓度会偏高;读数时若俯视, 结果恰好相反.例6 使用量筒量取液体溶质后再洗涤量筒2~3次, 并把洗涤液也转入烧杯中, 或用移液管(除标写“吹”字外)移液时把尖嘴处的残留液也吹入烧杯中.分析因在制造量筒、移液管及滴定管时, 已把仪器内壁或尖嘴处的残留量扣除, 故而上述把持均使溶质偏多、所配溶液的浓度偏高.三、溶质有无损失在溶液配制过程中, 若溶质无损失, 则所配溶液的浓度无偏差;若溶质有损失, 则浓度变小.例7 A.溶解(或稀释)溶质搅拌时有少量液体溅出;B.只洗涤烧杯未洗涤玻璃棒;C.未把洗涤液转入容量瓶;D.转移洗涤液时有少量液体溅出容量瓶外.分析以上四种情况溶质均有损失, 所配制的溶液浓度城市偏低.例8 (1)溶解或稀释溶质时烧杯尚未干燥;(2)移液时容量瓶尚未干燥;(3)定容时有少量蒸馏水滴到瓶外.分析以上三种情况溶质均无损失, 最终溶液的体积是不变的, 因此所配溶液浓度没有改变.例9 把溶液由烧杯转入容量瓶中时, 由于不小心使得少量溶液溅出瓶外, 然后再补加少量溶质.分析因补加的溶质量往往其实不即是损失的溶质量, 结果仍会招致所配溶液浓度偏年夜或偏小.四、定容有无偏差定容加水时如因失慎超越了容量瓶的标线, 则所配溶液的浓度偏小;反之偏年夜.例10 定容时仰视或俯视.分析若定容时仰视, 观察液面会低于实际液面.当液面实际已达标线时, 观察者仍会认为液面还没有到达标线, 所以会继续加水, 招致实际液面超越标线, 因而所配溶液浓度偏小;若俯视, 结果刚好相反.例11 定容时由于没使用胶头滴管致使液面超越标线, 这时再用胶头滴管吸取少量液体, 使液面重新到达标线.分析当液面超越标线时, 溶液浓度已变小, 此时无论从中再取出几多溶液都无法使其浓度到达预定值, 只有重新配制.例12 定容时盖上瓶盖, 摇匀后发现液面低于标线, 再继续滴加蒸馏水使液面重新到达标线.分析这样把持, 溶液的浓度会偏低.之所以造成振荡后液面低于标线的现象, 是因为有少量的溶液因润湿磨口处而损耗, 但溶液的浓度是不变的, 故不需再加水.五、温度是否一致容量瓶上所标示的温度一般为室温(20℃), 若定容时溶液的温度高于室温, 会造成所配溶液浓度偏高;反之浓度偏低.例13 洗涤液没有放置至室温就转入容量瓶中定容.分析溶解或稀释过程中常陪伴热效应, 对放热的过程, 如不放置至室温会造成浓度偏年夜, 对吸热的过程结果则会相反.例14 称量固体溶质或量取液体溶质后直接在容量瓶中配制.分析溶解或稀释过程中发生的热效应会使容量瓶的体积发生变动, 致使容量瓶的实际容量其实不即是室温时的容量, 所以浓度会改变.另外, 若发生年夜量的热, 有时会招致容量瓶破裂.要减小实验误差, 除要求计算准确、称量无误、把持规范外, 还应选择合适的仪器, 克服年夜意的习惯, 防止过失性的毛病.容量瓶的使用容量瓶的使用之一1.使用容量瓶前检查它是否漏水方法如下:往瓶内加水, 塞好瓶塞, 用食指顶住瓶塞, 另一只手托住瓶底, 把瓶倒立过来, 观察瓶塞周围是否有水漏出.如果不漏水, 把瓶塞旋转180°后塞紧, 仍把瓶倒立过来, 再检验是否漏水, 经检查不漏水的容量瓶才华使用.2.配制溶液(1)如果试样是固体, 把称好的试样溶解在烧杯里;如果试样是液体, 需用移液管或量筒量取移入烧杯里, 然后再加少量蒸馏水, 用玻璃棒搅动, 使它混合均匀.应特别注意在溶解或稀释时有明显的热量变动, 就必需待溶液的温度恢复到室温后才华向容量瓶中转移.(2)把溶液从烧杯移到容量瓶里, 并屡次洗涤烧杯, 把洗涤液也移入容量瓶, 以保证溶质全部转移到容量瓶里.缓慢地加入蒸馏水, 到接近标线2~3cm处, 用滴管滴加蒸馏水到标线(小心把持, 切勿超越标线).(3)盖好瓶塞, 用食指顶住瓶塞, 用另一只手的手指托住瓶底, 把容量瓶倒转和摇动屡次, 使溶液混合均匀.容量瓶使用完毕, 应洗净、晾干(玻璃磨砂瓶塞应在瓶塞与瓶口处垫张纸条, 以免瓶塞与瓶口粘连).容量瓶的使用之二使用前要检查是否漏水.向瓶中加水到标线附近, 盖好瓶塞,用布将瓶外的水揩干.左手食指按住瓶塞, 右手手指托住瓶底边缘, 将瓶倒立2min, 观察瓶塞周围有无水渗出.如不漏, 把瓶放正,将瓶塞转动180°后再倒过来检查一遍.配制溶液时, 先把容量瓶洗净, 再把溶解后冷到室温的溶液按图中所示倒入容量瓶中, 用蒸馏水把烧杯洗涤三次, 洗出液都倒入容量瓶中.加水至瓶体积的2/3时, 摇动容量瓶, 使溶液混合均匀.加水到快接近标线时, 改用滴管慢慢滴加, 直到溶液凹液面的最低点与标线相切为止.盖好瓶塞, 将瓶倒转几次, 使瓶内溶液混合均匀.容量瓶不允许用瓶刷刷洗, 一般用水冲刷, 若洗不净, 倒入洗液摇动或浸泡, 再用水冲刷.它不能加热, 也不生长期盛放溶液.使用容量瓶的注意事项(1)使用前要检验是否漏水.法式是:加水→倒立, 观察→瓶塞旋转180°→倒立, 观察.(2)容量瓶不能用于溶解溶质, 更不能用玻璃棒搅拌.因此溶质要先在烧杯内溶解, 然后再转移到容量瓶中.(3)不能将热的溶液转移到容量瓶中, 更不能给容量瓶加热.如果溶质在溶解时是放热的, 则须待溶液冷却后再移液.(4)配制一定体积的溶液, 须选用与该溶液体积相同规格的容量瓶.经常使用的有50mL、100mL、250mL、500mL、1000mL等规格.(5)观察所加液体是否达容量瓶的刻度线, 一定要平视, 使液面的最低点刚好与刻度线相平.(6)如果加水定容时超越了刻度线, 不能将超越的部份再吸走, 必需重新配制.因为吸走一部份液体虽然溶液的体积到达了要求, 但吸走的部份液体带走了一部份溶质, 使所配溶液的浓度偏低.创作时间:二零二一年六月三十日(7)容量瓶通常不用于贮存试剂, 因此, 配制好的溶液要倒创作时间:二零二一年六月三十日。

溶解度曲线和溶质质量分数溶解度曲线和溶质质量分数是描述溶质在溶剂中溶解程度的重要指标。
溶解度曲线是通过测定不同温度下溶质在溶剂中的溶解度,绘制出来的一条曲线。
而溶质质量分数则是表示溶质在溶液中所占的质量比例。
首先,溶解度曲线可以为我们提供关于溶质溶解程度随温度变化的关键信息。
通过对不同温度下溶解度的实验测量和记录,我们可以绘制出一条溶解度曲线。
这条曲线可以告诉我们,在不同温度下溶质溶解度的变化趋势。
通过观察溶解度曲线,我们可以了解到溶质在溶剂中的溶解度与温度的关系。
通常情况下,溶质在溶剂中的溶解度随着温度的升高而增加,但也存在一些特殊情况,如在某些情况下溶解度会随着温度的升高而减小。
这些特性对于实际应用中的溶解过程和分离纯化等工艺过程非常重要。
其次,溶质质量分数是指溶质在溶液中质量与溶液总质量的比值。
溶质质量分数是用来表示溶质在溶液中所占的相对比例。
通常以百分数的形式表示,比如溶质质量分数为10%表示溶质占溶液总质量的10%。
溶质质量分数的计算可以通过实验测量溶质和溶液的质量,然后将溶质的质量除以溶液的总质量,再乘以100%得到。
溶质质量分数的大小可以反映溶质在溶液中的相对浓度,对于溶液的配制、浓度的调整以及反应过程的控制都有着重要的作用。
在化学实验和工业生产中,溶解度曲线和溶质质量分数都是非常关键的参数。
通过实验测定和分析这些参数,我们可以深入了解溶质在溶剂中的溶解行为和溶液中溶质的浓度,进一步指导实验设计和工艺优化。
总之,溶解度曲线和溶质质量分数是研究和描述溶质在溶剂中溶解程度的重要工具。
溶解度曲线可以揭示溶质溶解度随温度变化的规律,而溶质质量分数则是表示溶质在溶液中所占比例的关键参数。
这些参数在实验设计和工艺过程中起到了至关重要的作用,促进了化学实验和工业生产的发展。

溶解度和质量分数的关系英文回答:Solubility, expressed in grams of solute per 100 grams of solvent, is a measure of the maximum amount of solute that can be dissolved in a given solvent at a specific temperature. Mass fraction, on the other hand, is the ratio of the mass of solute to the total mass of the solution.The relationship between solubility and mass fraction can be derived as follows:Let's assume we have a solution with a mass of 100 grams, containing x grams of solute.Solubility (S) = x / 100。
Mass fraction (w) = x / (100 + x)。
To find the relationship between S and w, we can setthe two equations equal to each other:S = w / (1 w)。
Solving for w, we get:w = S / (1 + S)。
This equation shows that the mass fraction is directly proportional to the solubility. As the solubility increases, the mass fraction also increases.中文回答:溶解度,以每 100 克溶剂中溶质的克数表示,是特定温度下可在给定溶剂中溶解的最大溶质量的度量。

溶解度和溶质的质量分数【学习目标】1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。
2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。
3.初步学会配制一定溶质质量分数的溶液。
【要点梳理】要点一、饱和溶液、不饱和溶液(专题课堂《溶解度》一)1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。
2.不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时的溶液,叫做不饱和溶液。
3.饱和溶液、不饱和溶液的转化方法:大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体):4.判断溶液是否饱和的方法:一般说来,可以向原溶液中再加入少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。
【要点诠释】1.饱和溶液、不饱和溶液概念的理解(1)首先要明确“一定条件”、“一定量的溶剂”。
在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。
如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。
所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。
(2)必须明确是某种溶质的饱和溶液或不饱和溶液。
如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。
2.由于Ca(OH)2的溶解度在一定范围内随温度的升高而减小,因此将Ca(OH)2的不饱和溶液转化为饱和溶液,在改变温度时应该是升高温度;将熟石灰的饱和溶液转化为不饱和溶液,在改变温度时应该是降低温度。
要点二、溶解度、溶解度曲线1.固体的溶解度:(专题课堂《溶解度》二)在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。

溶解度和溶质的质量分数(基础)撰稿:熊亚军审稿:于洋【学习目标】1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。
2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。
3.初步学会配制一定溶质质量分数的溶液。
【要点梳理】要点一、饱和溶液、不饱和溶液(高清课堂《溶解度》一)1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。
2.不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时的溶液,叫做不饱和溶液。
3.饱和溶液、不饱和溶液的转化方法:大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体):4.判断溶液是否饱和的方法:一般说来,可以向原溶液中再加人少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。
【要点诠释】1.饱和溶液、不饱和溶液概念的理解(1)首先要明确“一定条件”、“一定量的溶剂”。
在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。
如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。
所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。
(2)必须明确是某种溶质的饱和溶液或不饱和溶液。
如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。
2.由于Ca(OH)2的溶解度在一定范围内随温度的升高而减小,因此将Ca(OH)2的不饱和溶液转化为饱和溶液,在改变温度时应该是升高温度;将熟石灰的饱和溶液转化为不饱和溶液,在改变温度时应该是降低温度。
要点二、溶解度、溶解度曲线1.固体的溶解度:(高清课堂《溶解度》二)在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。

第 1 页 共 1 页 物质的量浓度、质量分数、溶解度间的换算
由定义出发,运用公式:c =n V 、质量分数=溶质的质量溶液的质量
×100%进行推理,注意密度的桥梁作用,不要死记公式。
(1)物质的量浓度(c )与溶质质量分数(w )的换算
体积为V ,密度为ρ g·cm -3的溶液,含有摩尔质量为M g·mol -1的溶质m g ,溶质的质量分
数为w ,则溶质的物质的量浓度c 与溶质的质量分数w 的关系是:c =n V =m M V =m MV =1 000ρw V MV
=1 000ρw M ,反之,w =cM 1 000ρ。
(2)物质的量浓度(c )与溶解度(S )的换算
若某饱和溶液的密度为ρ g·cm -3,溶质的摩尔质量为M g·mol -
1,溶解度为S g ,则溶解度与
物质的量浓度的表达式分别为:S =100cM 1 000ρ-cM
,c =n V =S M 100+S 1 000ρ= 1 000ρS M (100+S )。


溶解度和质量分数
溶解度和质量分数是描述溶液中溶质溶解程度的两个重要概念:
1.溶解度:溶解度是指在一定温度和压力下,单位溶剂中最多可溶解的溶质
的量。
通常用单位质量的溶剂可以溶解的溶质的质量(例如克/升或克/毫
升)来表示。
溶解度与溶质种类、溶剂性质、温度和压力等因素有关,通
常在给定的温度和压力下是一个固定值。
2.质量分数:质量分数是指溶液中溶质的质量与整个溶液的总质量之比。
质
量分数通常用百分比或小数表示,计算公式为:质量分数 = (溶质的质
量 / 溶液的总质量)× 100%。
质量分数可以用来描述溶质在溶液中的
相对含量,是一个常用的浓度单位。
在实际应用中,可以通过实验确定某种物质在特定条件下的溶解度,并根据溶解度计算溶液中溶质的质量分数,从而了解溶质在溶剂中的溶解行为和溶液的浓度。
这些概念在化学、生物化学、药物学等领域中有着重要的应用。
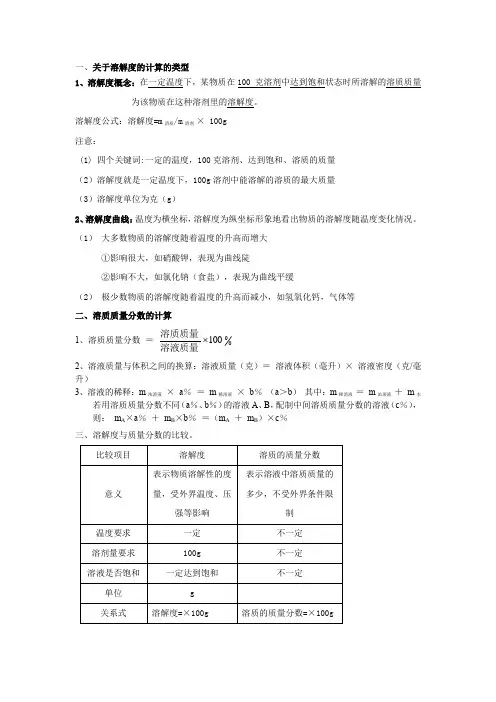
一、关于溶解度的计算的类型1、溶解度概念:在一定温度下,某物质在100 克溶剂中达到饱和状态时所溶解的溶质质量为该物质在这种溶剂里的溶解度。
溶解度公式:溶解度=m 溶质/m 溶剂 × 100g 注意:(1) 四个关键词:一定的温度,100克溶剂、达到饱和、溶质的质量 (2)溶解度就是一定温度下,100g 溶剂中能溶解的溶质的最大质量 (3)溶解度单位为克(g )2、溶解度曲线:温度为横坐标,溶解度为纵坐标形象地看出物质的溶解度随温度变化情况。
(1) 大多数物质的溶解度随着温度的升高而增大①影响很大,如硝酸钾,表现为曲线陡②影响不大,如氯化钠(食盐),表现为曲线平缓(2) 极少数物质的溶解度随着温度的升高而减小,如氢氧化钙,气体等 二、溶质质量分数的计算 1、溶质质量分数 =0100 溶液质量溶质质量2、溶液质量与体积之间的换算:溶液质量(克)= 溶液体积(毫升)× 溶液密度(克/毫升)3、溶液的稀释:m 浓溶液 × a % = m 稀溶液 × b % (a >b ) 其中:m 稀溶液 = m 浓溶液 + m 水若用溶质质量分数不同(a %、b %)的溶液A 、B ,配制中间溶质质量分数的溶液(c %), 则: m A ×a % + m B ×b % =(m A + m B )×c % 三、溶解度与质量分数的比较。
甲乙溶解度 g0 t 1 t 2 温度/℃305020 40 10初中化学总复习溶解度曲线专题练习9.右图所示曲线a 、b 、c 分别代表A 、B 、C 三种物质的溶解度曲线。
下列说法错误的是( )A .t 1 ℃时,三种物质溶解度大小的顺序是B >C >AB .t 2℃时,A 和B 两种物质的饱和溶液中溶质质量相同C .t 3℃时,在100g 水里分别加入三种物质各mg ,只有b 能形成饱和溶液D .从混有少量C 的A 物质中提取较纯净的A ,最适宜用蒸发溶剂的方法 10.右图是a 、b 、c 三种固体的溶解度曲线,下列说法正确的是( ) A .b 的溶解度一定小于a 的溶解度B .当a 中含有少量b 时,可以用降温结晶的方法提纯aC .通过降低温度可将c 的不饱和溶液变为饱和溶液D .a 的饱和溶液从t 2℃降温至t 1℃时变为不饱和溶液11.有关a 、b 两种物质的溶解度曲线如图所示,下列叙述不正确的是( ) A .a 物质的溶解度随着温度的升高而增大B .在t 2℃时,a 、b 两种物质的溶液中溶质的质量分数一定相等C .将a 、b 两种物质的饱和溶液从t 3℃降温至t 1℃,a 有晶体析出,bD .t 3℃时,a 物质的溶解度大于b 物质的溶解度 12.a 、b 、c 三种物质的溶解度曲线如右图所示。
愴解决和质董今敖的针專【罟司n株】1. 学会浓溶液稀释的计算。
2. 知道配制某一溶质的质量分数的溶液的方法和步骤。
3. 稳固对溶解度的涵义的理解。
4. 理解溶解度计算的根本思路。
一、配制溶质质量分数一定的溶液1. 用固体配制溶液:①步骤:计算、称量、溶解。
②所用仪器:托盘天平、胶头滴管、量筒、药匙、烧杯、玻璃棒。
例:配制溶液的质量分数为10%的氯化钠溶液50g.步骤:〔1〕计算:溶质的质量:50gxl0% = 5g;溶剂的质量:50g—5g=45g:水的体积:二込\g/ niL〔2〕称量:用托盘天平称量5g氯化钠倒入烧杯中,用50mL M简量取45mL水倒入烧杯中. 〔3〕溶解:用玻璃棒搅拌,加速固体物质的溶解速率,待氯化钠完全溶解得到的溶液即为10%的氯化钠溶液50g.实验操作步骤如以下图所示.2. 用浓溶液配制稀溶液:①步骤:计算、量取、溶解。
②所用仪器:胶头滴管、量筒、烧杯、玻璃棒。
二、有关溶液的计算依据溶液浓缩方法:参加溶质,蒸发溶剂,参加髙浓度的浓溶液.溶液稀释方法:参加溶剂,参加低浓度的稀溶液。
1. 加溶剂稀释和蒸发溶剂浓缩〔没有晶体析岀〕的计算依据,变化前后溶液中溶质的质量相等,可用以下关系式表示:也卄二加2><闪2,三量通过方程可求另一量.2. 加溶质增浓的计算:参加溶质溶解后,溶质和溶液质量都增加.原溶质质量+参加的洛质质量原溶液质量+参加的洛液的质量3.两种浓度不同的同种溶质的溶液混合后,所得的溶液中溶质的质量分数一圧大于小浓度,小于大浓度的溶质的质量分数。
溶液1中洽质质量+»容液2中溶质质量溶液1的质量+溶液2的质量溶液中溶质质虽:二溶液质量x 该溶液中溶质的质量分数.三、溶解度与饱和溶液中溶质、溶液、溶剂的关系一泄温度下,一世量的溶剂中所溶解物质的质量是一立的,反之,任意量的饱和溶 液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一左的,如果耙一定温度下溶剂的 量规立为100g,此时所溶解溶质形成饱和溶液时的质量称为溶解度。
溶解度、溶质质量分数一、物质的溶解度1.溶解度的定义:在一定温度下,某物质在100 g溶剂(通常为水)里达到饱和状态时,所溶解该溶质的质量,叫做这种物质在这种溶剂里的溶解度,用字母S表示。
例:20℃,食盐的溶解度是36g/100g水,就是指在20℃,食盐在100g水里达到饱和时溶解36g 2.溶解度概念五要素:(1)一定温度;(2)指明溶质和溶剂;(3)100g溶剂;(4)达到饱和状态;(5)溶解度的单位为g/100g水。
3.物质的溶解度表:【练一练】1.正误判断:(1)l00g水中最多溶解38g氯化钠,所以氯化钠在水中的溶解度是38g/100g水。
(2)在10℃时,烧杯内水中最多溶有140g硝酸铵,故硝酸铵在水中的溶解度是140g/100g水。
(3)在60℃,100g水中溶有75g硝酸钾,所以60℃时硝酸钾的溶解度为75g/100g水。
(4)60℃,100g水中最多溶解124g硝酸钾,所以硝酸钾在这温度下的溶解度是124。
2.“60℃时,硝酸钾的溶解度是110 g/100 g水”这句话含义是什么?4.溶解度的影响因素【思考】下列两表分别列出硝酸钾、氢氧化钙在不同温度下的溶解度。
若在坐标系上用线把物质在各个温度下溶解度的点连接起来,就得到了该物质的溶解度曲线。
比较硝酸钾和氢氧化钙溶解度,并在下列坐标系上作出溶解度曲线。
大多数固体物质在水中的溶解度随温度随温度升高而增大,少数固体物质的溶解度随温度升高而减小气体物质在水中的溶解度随温度升高而减小。
气体物质的溶解度,不仅要标明一定温度,还要标明一定压强。
如:在20℃、101kPa 时,氧气在水中的溶解度为4.34×10-3g/100g 水。
(气体的溶解度也可用1体积水中溶解气体体积的最大量来表示)二、有关溶解度的简单计算1.计算公式(只适用于饱和溶液): 基础等量关系:m 溶溶液 = m 溶质+ m 溶剂公式1:=100m Sm 溶质溶剂 变形:100m S m =⨯溶质溶剂公式2:=100+m Sm S溶质溶液2.基础计算题型:题型1:求溶质、溶剂的质量:根据某物质在某温度时的溶解度,可以求出该温度时一定量饱和溶液里所含溶质和溶剂的质量。