溶质质量分数与溶解度的关系知识分享
- 格式:ppt
- 大小:346.50 KB
- 文档页数:10


七 溶解度与溶质的质量分数一、我们学了什么:1.饱和溶液和不饱和溶液⑴一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的的溶液叫做这种溶质的的不饱和溶液;不能再溶解某种溶质的溶液叫做这种溶质的的饱和溶液。
饱和溶液和不饱和溶液的判断依据;“一定温度、一定量溶剂”里是否能继续溶解该溶质。
⑵当温度、溶剂的量改变时,饱和溶液和不饱和溶液之间可以相互转化:不饱和溶液饱和溶液注意:改变温度法,适用于溶解度随温度升高而增大的固体溶质;对于溶解度受温度影响变化不大的物质,如NaCl ,该方法不适用;对于溶解度随温度升高而减小的物质,如Ca(OH)2,则转化情况与上述方法相反。
2.固体物质的溶解度⑴定义:在一定温度下,某物质在100g 溶剂里达到饱和状态时所溶解的质量,叫做这种溶质在这种溶剂里的溶解度。
注意:四个关键词必须同时满足,溶解度才有意义:①条件:在一定温度下--------可依此画出溶解度随温度变化的曲线。
②标准:在100g 溶剂里。
③状态:达到饱和状态时。
④单位:质量常用单位“克”。
⑵影响因素:内因:由溶质、溶剂本身的性质决定。
3.气体物质的溶解度⑴定义;该气体在压强为101kPa ,一定温度时,在1体积水中达到饱和状态时所溶解的体积。
注意:定义中的几个关键词:①一定温度下;②101 kPa ;③1体积水中;④饱和时的气体体积数。
⑵影响因素:内因:气体和水本身的性质。
外因:①温度:随温度升高气体溶解度减小;②压强:随压强增大溶解度增大。
4.溶解性和溶解度的比较:⑴区别:溶解性:是说明物质溶解能力的定性方法,是物质的一种物理性质。
溶解度:是衡量一定温度下物质在某种溶剂里溶解性大小的尺度,是溶解性的定量表示方法。
⑵联系:加溶质、蒸发溶剂或降温 加溶质或升温 外因:温度 大多数固态物质的溶解度随温度的升高而升高; 少数物质(如NaCl )的溶解度受温度的影响很少; 也有极少数物质[Ca(OH)2]的溶解度随温度的升高而降低。



初三化学:溶质的质量分数↓溶液中溶质的质量分数的计算及相关的计算公式①溶液质量=溶质质量+溶剂质量=溶液体积×溶液密度②溶质的质量分数=溶质质量÷溶液质量×100%=溶质质量÷(溶质质量+溶剂质量)×100%③溶质质量=溶液质量×溶质的质量分数=(溶质质量+溶剂质量)×溶质的质量分数注意:⒈溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶质质量和溶液质量。
溶质的质量分数一般用百分比表示。
⒉溶质的质量分数的数学表达式中溶质质量与溶液质量的单位必须统一。
⒊数学表达式中溶质的质量是指被溶解的溶质质量,没有被溶解的或结晶析出的固体质量不能算为溶质、溶液的质量。
↓溶液稀释的计算由于溶液稀释前后,溶质的质量分数不变,所以若设浓溶液的质量为A g,溶质的质量分数为a%,加水稀释成溶质为b%的稀溶液B g,则有关系式:A g×a%=B g×b%,其中B=A+m水。
↓溶液增浓的计算⑴向原溶液中添加溶质由于溶液增加溶质后,所得溶液中溶质的质量=原溶液中溶质的质量+增加的溶质质量,而所得溶液的质量=原溶液的质量+增加的溶质质量。
所以,若设原溶液质量为A g,溶质的质量分数为a%,加溶质B g后变成溶质的质量分数为b%的溶液,则有关系式:A g ×a %+B g =(A g +B g)×b % 或 %gg gg 100⨯++⨯=B A B a%A b%。
⑵将原溶液蒸发掉一部分溶剂由于溶液蒸发溶剂前后,溶质的质量不变。
所以若设原溶液的质量为A g ,溶质的质量分数为a %,蒸发掉B g 溶剂后变成溶质的质量分数为b %的溶液,则有关系式:A g ×a % =(A g -B g)×b % 或 %gg g 100⨯-⨯=B A a%A b%。
⑶与浓溶液混合由于混合物溶液的总质量等于两混合组分溶液的质量之和,混合后的溶液中溶质质量等于两混合组分的溶质质量之和。

初中化学溶质的质量分数知识点总结溶质的质量分数是指溶质在溶液中的质量与溶液总质量之比。
在初中化学学习中,主要涉及了以下几个知识点:1.溶液和溶质的概念:溶液是溶质与溶剂混合后形成的均匀透明的物质。
溶质是指在溶液中可以溶解的物质,溶剂是指能够溶解其他物质的物质。
2.质量分数的概念:质量分数是溶质在溶液中所占的质量与溶液总质量之比。
3.质量分数的计算公式:质量分数(w)=溶质的质量(m)/溶液的总质量(M)×100%。
4.质量分数的表示方法:质量分数可以用百分数(%)或小数表示,百分数表示的质量分数是将分数乘以100后加上百分号;小数表示的质量分数是将分子上所有的数值写在分母下面。
5.溶液的稀溶液和浓溶液:根据溶解度的程度,溶液可以分为稀溶液和浓溶液。
稀溶液中溶质的质量分数较低,浓溶液中溶质的质量分数较高。
6.质量分数的意义:质量分数可以描述溶液中溶质的含量,通过质量分数可以了解溶液的浓度。
质量分数越高,表示溶液中溶质的含量越多;质量分数越低,表示溶液中溶质的含量越少。
7.质量分数的变化:质量分数会随着溶质的溶解和溶液的稀释而发生变化。
当溶质溶解时,溶液的质量增加,导致溶质的质量分数降低;当溶液稀释时,溶液的总质量增加,而溶质的质量基本保持不变,导致溶质的质量分数升高。
8.质量分数的实验测定:可以通过实验方法来测定溶质的质量分数。
一种常见的实验方法是加热蒸发法,先加热溶液使其部分蒸发,再测定残液中溶质的质量和溶液的总质量,通过计算可以得到溶质的质量分数。
9.质量分数在实际生活中的应用:质量分数的概念在实际生活中有着广泛的应用,比如药物浓度的计算、饮料和果汁的稀释、食品中添加剂的控制等。
综上所述,初中化学中关于溶质的质量分数的知识点主要包括溶液和溶质的概念、质量分数的计算公式与表示方法、溶液的稀溶液和浓溶液、质量分数的意义、质量分数的变化、质量分数的实验测定以及质量分数在实际生活中的应用等方面。

溶质的质量分数[科学探究]一、探究硝酸钾的溶解度大小与温度的定量关系1.提出问题:温度与硝酸钾的溶解度大小定量关系怎样? 2,设计实验:(1)实验器材:托盘天平、大试管、玻璃棒、大烧杯、蒸发皿、铁架台、酒精灯、硝酸钾、蒸馏水等。
(2)实验时注意:①为保持温度恒定,应该用水浴加热;②为便于计算,水可定量为10毫升(可看成10克); ③加入KNO 3粉末的质量应精确称量。
(3)为测不同温度下的溶解度,可分别选择20℃、40℃、60℃等。
3.根据实验所得的数据,可计算出硝酸钾在某一温度时的溶解度。
如果用S 表示溶解度,m 质表示溶液中溶质质量,m 剂表示溶液中溶剂质量, 则有: S =剂质m m ×100克二、根据溶解度的计算1.根据溶解度的概念可知,要计算物质的溶解度,溶液一定要是 饱和 的。
2.由于在饱和溶液中,溶液、溶剂和饱和溶液的质量比是确定的,因此溶解度跟饱和溶液中的溶质、溶剂和溶液质量之间存在着对应的定量关系:剂质m m =克100S 或液质m m =SS 克100【例1】10℃时,将50克氯化铵溶于水,正好制成200克饱和溶液,求此温度下氯化铵的溶解度。
【例2】 已知20℃时硝酸钾的溶解度是31.6克,求此温度下的40克水溶解多少克硝酸 钾才能得到饱和溶液。
【例3】0℃时,硝酸铵的溶解度是192克,现要配制此温度下的硝酸铵饱和溶液500 克,需要硝酸铵和水各多少克?【例4】20℃时,氯化钠的溶解度为36克,现有20℃时100克氯化钠溶液,其中已溶解氯化钠20克,问此溶液是否饱和?如果不饱和,可以采取什么方法使其成为20℃时的饱和溶液?【例5】要配制50℃时氯化钾饱和溶液(50℃时氯化钾的溶解度是42.6克)。
(1)25克氯化钾应溶解在多少克水里? (2)在25克水里能溶解多少克氯化钾?(3)配制71.3克饱和溶液,需氯化钾和水各多少克?【课内练习】1.60℃时,硝酸钾的溶解度为110克,回答下列问题:(1)60℃时,把30克硝酸钾加到50克水里,能得到 克硝酸钾的 溶液; (2)60℃时,把30克硝酸钾加到20克水里,能得到 克硝酸钾的 溶液; (3)60℃时,84克硝酸钾饱和溶液里含有 克水和 克硝酸钾。


溶解度和质量分数的关系英文回答:Solubility, expressed in grams of solute per 100 grams of solvent, is a measure of the maximum amount of solute that can be dissolved in a given solvent at a specific temperature. Mass fraction, on the other hand, is the ratio of the mass of solute to the total mass of the solution.The relationship between solubility and mass fraction can be derived as follows:Let's assume we have a solution with a mass of 100 grams, containing x grams of solute.Solubility (S) = x / 100。
Mass fraction (w) = x / (100 + x)。
To find the relationship between S and w, we can setthe two equations equal to each other:S = w / (1 w)。
Solving for w, we get:w = S / (1 + S)。
This equation shows that the mass fraction is directly proportional to the solubility. As the solubility increases, the mass fraction also increases.中文回答:溶解度,以每 100 克溶剂中溶质的克数表示,是特定温度下可在给定溶剂中溶解的最大溶质量的度量。

一、关于溶解度的计算的类型1、溶解度概念:在一定温度下,某物质在100 克溶剂中达到饱和状态时所溶解的溶质质量为该物质在这种溶剂里的溶解度。
溶解度公式:溶解度=m 溶质/m 溶剂 × 100g 注意:(1) 四个关键词:一定的温度,100克溶剂、达到饱和、溶质的质量 (2)溶解度就是一定温度下,100g 溶剂中能溶解的溶质的最大质量 (3)溶解度单位为克(g )2、溶解度曲线:温度为横坐标,溶解度为纵坐标形象地看出物质的溶解度随温度变化情况。
(1) 大多数物质的溶解度随着温度的升高而增大①影响很大,如硝酸钾,表现为曲线陡[②影响不大,如氯化钠(食盐),表现为曲线平缓(2) 极少数物质的溶解度随着温度的升高而减小,如氢氧化钙,气体等 二、溶质质量分数的计算 1、溶质质量分数 =00100 溶液质量溶质质量2、溶液质量与体积之间的换算:溶液质量(克)= 溶液体积(毫升)× 溶液密度(克/毫升)3、溶液的稀释:m 浓溶液 × a % = m 稀溶液 × b % (a >b ) 其中:m 稀溶液 = m 浓溶液 + m 水若用溶质质量分数不同(a %、b %)的溶液A 、B ,配制中间溶质质量分数的溶液(c %), 则: m A ×a % + m B ×b % =(m A + m B )×c % 三、溶解度与质量分数的比较。
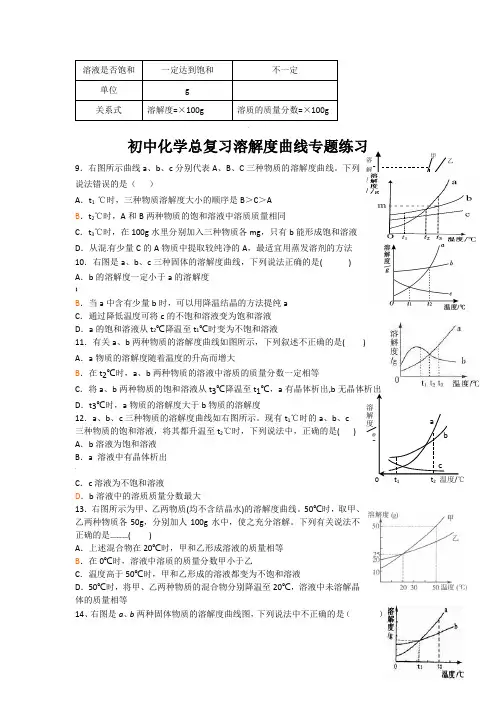
比较项目:溶解度溶质的质量分数意义表示物质溶解性的度量,受外界温度、压强等影响表示溶液中溶质质量的多少,不受外界条件限制温度要求 一定 不一定溶剂量要求100g…不一定溶液是否饱和一定达到饱和不一定单位 g关系式溶解度=×100g溶质的质量分数=×100g.初中化学总复习溶解度曲线专题练习9.右图所示曲线a 、b 、c 分别代表A 、B 、C 三种物质的溶解度曲线。
下列说法错误的是( )A .t 1 ℃时,三种物质溶解度大小的顺序是B >C >AB .t 2℃时,A 和B 两种物质的饱和溶液中溶质质量相同C .t 3℃时,在100g 水里分别加入三种物质各mg ,只有b 能形成饱和溶液D .从混有少量C 的A 物质中提取较纯净的A ,最适宜用蒸发溶剂的方法 10.右图是a 、b 、c 三种固体的溶解度曲线,下列说法正确的是( ) A .b 的溶解度一定小于a 的溶解度 】B .当a 中含有少量b 时,可以用降温结晶的方法提纯aC .通过降低温度可将c 的不饱和溶液变为饱和溶液D .a 的饱和溶液从t 2℃降温至t 1℃时变为不饱和溶液11.有关a 、b 两种物质的溶解度曲线如图所示,下列叙述不正确的是( ) A .a 物质的溶解度随着温度的升高而增大B .在t 2℃时,a 、b 两种物质的溶液中溶质的质量分数一定相等C .将a 、b 两种物质的饱和溶液从t 3℃降温至t 1℃,a 有晶体析出,b 无晶体析出D .t 3℃时,a 物质的溶解度大于b 物质的溶解度 12.a 、b 、c 三种物质的溶解度曲线如右图所示。
溶解度、溶质质量分数一、物质的溶解度1.溶解度的定义:在一定温度下,某物质在100 g溶剂(通常为水)里达到饱和状态时,所溶解该溶质的质量,叫做这种物质在这种溶剂里的溶解度,用字母S表示。
例:20℃,食盐的溶解度是36g/100g水,就是指在20℃,食盐在100g水里达到饱和时溶解36g 2.溶解度概念五要素:(1)一定温度;(2)指明溶质和溶剂;(3)100g溶剂;(4)达到饱和状态;(5)溶解度的单位为g/100g水。
3.物质的溶解度表:【练一练】1.正误判断:(1)l00g水中最多溶解38g氯化钠,所以氯化钠在水中的溶解度是38g/100g水。
(2)在10℃时,烧杯内水中最多溶有140g硝酸铵,故硝酸铵在水中的溶解度是140g/100g水。
(3)在60℃,100g水中溶有75g硝酸钾,所以60℃时硝酸钾的溶解度为75g/100g水。
(4)60℃,100g水中最多溶解124g硝酸钾,所以硝酸钾在这温度下的溶解度是124。
2.“60℃时,硝酸钾的溶解度是110 g/100 g水”这句话含义是什么?4.溶解度的影响因素【思考】下列两表分别列出硝酸钾、氢氧化钙在不同温度下的溶解度。
若在坐标系上用线把物质在各个温度下溶解度的点连接起来,就得到了该物质的溶解度曲线。
比较硝酸钾和氢氧化钙溶解度,并在下列坐标系上作出溶解度曲线。
大多数固体物质在水中的溶解度随温度随温度升高而增大,少数固体物质的溶解度随温度升高而减小气体物质在水中的溶解度随温度升高而减小。
气体物质的溶解度,不仅要标明一定温度,还要标明一定压强。
如:在20℃、101kPa 时,氧气在水中的溶解度为4.34×10-3g/100g 水。
(气体的溶解度也可用1体积水中溶解气体体积的最大量来表示)二、有关溶解度的简单计算1.计算公式(只适用于饱和溶液): 基础等量关系:m 溶溶液 = m 溶质+ m 溶剂公式1:=100m Sm 溶质溶剂 变形:100m S m =⨯溶质溶剂公式2:=100+m Sm S溶质溶液2.基础计算题型:题型1:求溶质、溶剂的质量:根据某物质在某温度时的溶解度,可以求出该温度时一定量饱和溶液里所含溶质和溶剂的质量。
溶解度和溶质的质量分数(基础)责编:熊亚军【学习目标】1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。
2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。
3.初步学会配制一定溶质质量分数的溶液。
【要点梳理】要点一、饱和溶液、不饱和溶液(高清课堂《溶解度》一)1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。
2.不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时的溶液,叫做不饱和溶液。
3.饱和溶液、不饱和溶液的转化方法:大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体):4.判断溶液是否饱和的方法:一般说来,可以向原溶液中再加入少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。
【要点诠释】1.饱和溶液、不饱和溶液概念的理解(1)首先要明确“一定条件”、“一定量的溶剂”。
在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。
如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。
所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。
(2)必须明确是某种溶质的饱和溶液或不饱和溶液。
如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。
2.由于Ca(OH)2的溶解度在一定范围内随温度的升高而减小,因此将Ca(OH)2的不饱和溶液转化为饱和溶液,在改变温度时应该是升高温度;将熟石灰的饱和溶液转化为不饱和溶液,在改变温度时应该是降低温度。
要点二、溶解度、溶解度曲线1.固体的溶解度:(高清课堂《溶解度》二)在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
溶解度与饱和溶液的质量分数的关系
溶解度指在特定温度下,溶剂中能够溶解的最大溶质物质量。
饱和溶液是指在特定温度下,已经溶解了最大量溶质的溶液。
溶解度与饱和溶液的质量分数之间存在一定关系。
在溶解度的条件下,即溶质物质量达到最大可溶解量,饱和溶液的质量分数就是溶解度值。
如果将溶质物质量增加到超过溶解度,溶液将变得不稳定,超过溶解度的溶质将会析出,而溶液的质量分数将小于溶解度值。
例如,NaCl在25摄氏度下的溶解度为36.0 g/100 mL。
如果我们在25摄氏度下将40 g NaCl溶解在100 mL水中,那么这个溶液就是一个非常浓的饱和溶液,其中NaCl的质量分数为40%。
但是如果我们加入更多的NaCl,溶解度将会被超过,并且溶液中的一部分NaCl将会析出,导致溶液的质量分数小于40%。