钠、铝知识点和方程式总结
- 格式:doc
- 大小:82.01 KB
- 文档页数:5

金属钠与铝的化学方程式总结一、钠及钠的化合物1.呼吸面具中发生的反应化学:2Na 2O 2+2H 2O=4NaOH+O 2↑2Na 2O 2+2CO 2 =2Na 2CO 3+O 22、钠在空气中缓慢氧化化学: 4Na+O 2=2Na 2O (白色固体,不稳定)3、点燃(写出生成物的颜色)化学: 2Na+O 2 = Na 2O 2 (淡黄色固体,稳定)4、同学们,钠和水的反应你会了吗?5、钠投入到硫酸铜溶液中(写出反应的现象:有气体生成 、还有蓝色絮状沉淀)化学: 2Na + 2 H 2O + CuSO 4=Cu(OH)2↓+H 2 ↑ + Na 2SO 4离子:2Na +2H 2O +Cu 2+ +2OH - = 2 Na + + Cu(OH)2↓ + H 2 ↑6、钠投入到氯化铁溶液中(写出反应的现象:有气体生成,有红褐色沉淀)化学:6Na + 6H 2O + 2FeCl 3=2Fe(OH)3↓+3H 2 ↑ + 6NaCl离子: 6Na + 6H 2O + 2Fe 3+ = 2Fe(OH)3↓+ 3H 2 ↑ + 6Na +7、氧化钠和水反应化学: Na 2O+H 2O=2NaOH离子: Na 2O+H 2O=2Na ++2OH -8、过氧化钠和水反应化学: 2Na 2O 2+2H 2O=4NaOH+O 2↑离子: 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑9、氧化钠和二氧化碳反应化学: Na 2O+CO 2=Na 2CO 310、过氧化钠和二氧化碳反应(用双线桥法标出电子转移情况)化学:2Na 22 2 23211化学: Na 2O+2HCl=2NaCl+H 2O离子: Na 2O+2H +=2Na ++H 2O12、过氧化钠和盐酸反应化学:2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑离子: 2Na2O2+4H+=4Na++2H2O+O2↑13、碳酸钠和盐酸反应(1)向碳酸钠溶液加入少量盐酸化学:Na2CO3+HCl =NaHCO3 +NaCl 离子: CO32-+H+=HCO3-(2)向碳酸钠溶液加入过量盐酸化学:Na2CO3+2HCl=2NaCl+H2O+CO2↑离子: CO32-+2H+= H2O+CO2↑14、向碳酸氢钠溶液加入盐酸反应化学:NaHCO3+HCl=NaCl+H2O+CO2↑离子:HCO3-+H+= H2O+CO2↑a、分别向碳酸钠和碳酸氢钠溶液中加入盐酸,碳酸氢钠先放出气体。

知识归纳:高中化学钠铝铁及化合物思维导图与化学方程式总结今天给大家分享钠、铝、铁的化合物相关知识~一、钠的化合物1. Na2O(1)Na2O与水的反应Na2O+H2O==2NaOH(2)Na2O与CO2的反应Na2O+CO2==Na2CO3(3)Na2O + SO2= Na2SO3(4)与酸发生反应Na2O+2HCl==2NaCl+H2O2. Na2O2中氧元素为-1价,Na2O2既有氧化性又有还原性。
(1)过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)2Na2O2+2H2O==4NaOH+O2↑NaOH溶液反应HCO3-+OH-==H2O+CO32-与Ca(OH)2溶液反应Ca(OH)2+Na2CO3==CaCO3↓+2NaOH也能反应生成CaCO3沉淀Ca2++CO32-==CaCO3↓与CaCl2溶液反应不反应有CaCO3沉淀用途发酵粉、灭火剂、治疗胃酸过多(有胃溃疡时不能用)发酵粉、灭火剂、治疗胃酸过多(有胃溃疡时不能用)相互转化Na2CO3+CO2+H2O==2NaHCO32NaHCO3==Na2CO3+H2O+CO2↑NaHCO3+NaOH==Na2CO3+H2ONaHCO3+NaOH==Na2CO3+H2O附:钠及其化合物思维导图二、铝的化合物1.Al2O3的性质Al2O3俗名矾土,氧化铝是一种白色难溶物,其熔点很高,可用来制造耐火材料如坩锅、耐火管、耐高温的实验仪器等。
Al2O3是两性氧化物,既能与强酸反应,又能与强碱反应Al2O3+ 6HCl====2AlCl3+3H2O(Al2O3+6H+====2Al3++3H2O)Al2O3+ 2NaOH====2NaAlO2+H2O(Al2O3+2OH-====2AlO2-+H2O)2. 氢氧化铝 Al(OH)3氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。
氢氧化铝可用来制备铝盐,作吸附剂等的原料。

元素化合物钠铝知识点总结本文将介绍元素化合物钠铝的相关知识,包括其基本性质、化学反应、应用领域等内容。
希望能为读者提供全面深入的了解。
1. 钠铝的基本性质1.1 钠铝的物理性质钠铝是一种金属元素化合物,其外观为银白色的固体。
钠在周期表中位于第11位,铝位于第13位,它们所形成的化合物通常为NaAl。
根据化学式来看,我们知道钠铝化合物是由钠(Na)和铝(Al)两种金属元素组成的。
其中,钠的原子序数为11,铝的原子序数为13。
1.2 钠铝的化学性质钠铝在常温下是稳定的,但是在高温下会发生一些化学反应。
例如,当钠铝与氧气发生反应时,会生成氧化钠和氧化铝。
其反应方程式为:4Na + O2 → 2Na2O4Al + 3O2 → 2Al2O3除此之外,钠铝还可以与酸类物质发生反应,产生氢气。
例如,当钠铝与盐酸(HCl)发生反应时,会产生氯化钠和氢气,反应方程式如下:2Na + 2HCl → 2NaCl + H22Al + 6HCl → 2AlCl3 + 3H21.3 钠铝的物理性质钠铝具有良好的导电性和导热性,因此在电子工业和航空航天等领域有着重要的应用。
此外,钠铝还具有较高的熔点和沸点,因此可以在高温环境下使用。
2. 钠铝的化学反应2.1 钠铝的氧化反应当钠铝被氧化剂氧气氧化时,会生成相应的氧化物。
例如,钠铝与氧气反应会生成NaN3和Al2O3。
反应方程式如下:4Na + 3O2 → 2Na2O4Al + 3O2 → 2Al2O3除了与氧气发生氧化反应外,钠铝还可以与其他氧化剂发生反应。
例如,当钠铝与过氧化氢(H2O2)反应时,会生成氧化钠和氧化铝:2Na + H2O2 → 2NaOH + H2↑2Al + 3H2O2 → 2Al(OH)3 + 3H2↑2.2 钠铝的还原反应在还原反应中,钠铝可以将其他物质的氧化物还原为原始物质。
例如,当钠铝与氧化铁(Fe2O3)发生反应时,会生成氧化钠和铁:6Na + Fe2O3 → 2Fe + Na2O + 3Na2O另外,钠铝还可以将氯气(Cl2)还原为氯化钠(NaCl):2Na + Cl2 → 2NaCl3. 钠铝的应用领域3.1 电子工业钠铝具有良好的导电性和导热性,因此在电子器件中有着重要的应用。

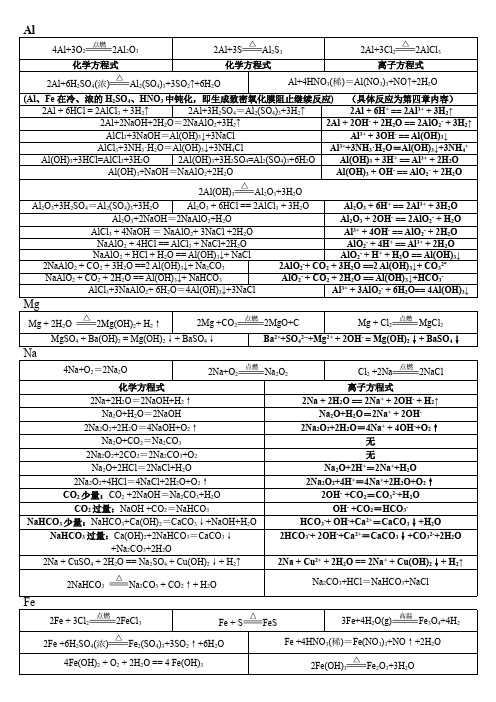
化学方程式和离子方程式整理(离子检验、卤素、钠、镁、铝) 1.铵根的鉴定(浓氢氧化钠溶液、加热)__________________________________________2.硫酸根的鉴定(稀盐酸、氯化钡)__________________________________________3.氯气的实验室制备(用浓盐酸、加热、一半HCl被氧化)________________________________________,___________________________________ 4.氯气的工业制备(电解氯化钠溶液)________________________________________,____________________________________ 5.铁在氯气中燃.(棕褐色烟)________________________________________6.铜在氯气中燃烧(棕黄色烟)_________________________________________7.工业制氯化氢(苍白色火焰)________________________________________8.氯气和水的反应(注意可逆)________________________________________,____________________________________ 9.氯气溶于氢氧化钠溶液(尾气吸收)________________________________________,_____________________________________ 10.工业制漂白粉(漂白粉有效成分为次氯酸钙)________________________________________11.漂白粉在空气中易变质(同时也是漂白粉的利用方式之一)_________________________________________12.次氯酸的不稳定性(见光分解)__________________________________________13.氯气通入溴化钾溶液中(工业制溴单质的原理)__________________________________________,____________________________________ 14.氯气通往碘化钾溶液中(工业制碘单质的原理)__________________________________________,___________________________________ 15.溴水滴入碘化钾溶液中__________________________________________,____________________________________ 16.氯、溴、碘离子的鉴定___________________________,__________________________,_______________________ 17.氯化银、溴化银、碘化银见光分解___________________________,__________________________,______________________ 18.钠在空气中缓慢氧化(生成白色固体)_____________________________________19.钠在空气中燃烧(生成淡黄色固体)____________________________________20.钠与水反应(红、嘶、浮、游、熔)______________________________________,______________________________________ 21.钠与硫酸铜溶液反应(先水后盐)______________________________________,_____________________________________ 22.工业制备钠(电解熔融氯化钠)______________________________________23.过氧化钠与水反应_________________________________________24.过氧化钠与二氧化碳反应(可用于呼吸面具)__________________________________________25.碳酸钠溶液与氯化钙溶液反应________________________________________,____________________________________ 26.碳酸钠溶液与氢氧化钙溶液反应(工业制烧碱时,用石灰乳)_______________________________________,_____________________________________ 27.碳酸钠溶液中缓慢滴入少量盐酸并不断搅拌(无二氧化碳产生)_____________________________________,_____________________________________ 28.碳酸钠溶液中加入过量盐酸(有二氧化碳产生)______________________________________,___________________________________ 29.碳酸钠溶液中通入二氧化碳气体(转化为碳酸氢钠)_______________________________________,__________________________________ 30.碳酸氢钠固体受热分解(不稳定)________________________________________31.碳酸氢钠溶液与盐酸反应(比碳酸钠更快产生气体)________________________________________,__________________________________ 32.碳酸氢钠溶液与氢氧化钠溶液反应________________________________________,__________________________________ 33.碳酸氢钠溶液与少量氢氧化钙溶液反应(2:1反应)_______________________________________,____________________________________ 34.碳酸氢钠溶液与过量氢氧化钙溶液反应(1:1反应)______________________________________,_____________________________________ 35.侯氏制碱法原理(第一步生成小苏打,第二步灼烧小苏打得纯碱)_______________________________________,____________________________________ 36.硫酸氢钠溶液与少量氢氧化钡溶液反应(2:1反应)______________________________________,_____________________________________ 37.硫酸氢钠溶液与过量氢氧化钡溶液反应(1:1反应)______________________________________,______________________________________ 38.从海水中提取镁(按书上,分六步)________________________________________,_________________________________________________________________________,_________________________________________________________________________,_________________________________ 39.镁在空气中点燃生成氧化镁(还生成少量的氮化镁)________________________________________40.镁在氮气中燃烧_______________________________________41.镁在二氧化碳气体中燃烧(生成两种固体)________________________________________42.加热分解氢氧化镁或碳酸镁制氧化镁(作耐火材料)________________________________________,_____________________________________ 43.从铝土矿提取铝(涉及四个反应)_______________________________________,_____________________________________,_______________________________________,_____________________________________ 44.氧化铝的两性(可溶于盐酸、氢氧化钠溶液)____________________________________,__________________________________________________________________________,_______________________________________ 45.氢氧化铝的两性(可溶于盐酸、氢氧化钠溶液)____________________________________,__________________________________________________________________________,_______________________________________ 46.氯化铝溶液中加入过量的氨水(实验室制氢氧化铝)_____________________________________,_____________________________________ 47.偏铝酸钠溶液中通入过量的二氧化碳气体(若二氧化碳少量,则生成碳酸钠)_____________________________________,___________________________________________________________________________,______________________________________ 48.氯化铝溶液中逐滴加入氢氧化钠溶液(先有沉淀,后又溶解)_____________________________________,____________________________________________________________________________,______________________________________ 49.氯化铝溶液与过量氢氧化钠溶液反应______________________________________,_______________________________________ 50.氯化铝溶液与偏铝酸钠溶液的反应(铝离子与偏铝酸根不能大量共存)______________________________________,________________________________________ 51.偏铝酸钠溶液中逐滴加入盐酸(先有沉淀,后又溶解)_______________________________________,_______________________________________ _______________________________________,_______________________________________ 52.偏铝酸钠溶液与过量盐酸反应_______________________________________,________________________________________ 53.铝溶于盐酸_______________________________________,_______________________________________ 54.铝溶于氢氧化钠溶液_______________________________________,_____________________________________ 55.铝粉与氧化铁粉在高温下发生铝热反应(用于焊接钢轨,也可冶炼难熔金属)___________________________________________。

金属钠与铝的化学方程式总结一、钠及钠的化合物1.呼吸面具中发生的反应化学:2Na 2O 2+2H 2O=4NaOH+O 2↑2Na 2O 2+2CO 2 =2Na 2CO 3+O 22、钠在空气中缓慢氧化化学: 4Na+O 2=2Na 2O (白色固体,不稳定)3、钠在空气或氧气中加热或点燃(写出生成物的颜色)化学: 2Na+O 2 = Na 2O 2 (淡黄色固体,稳定)4、钠与水的反应(写出反应的现象) 化学: 2Na+2H 2O=2NaOH+H 2 ↑离子:2Na+2H 2O=2Na ++2OH -+H 2 ↑同学们,钠和水的反应你会了吗?5、钠投入到硫酸铜溶液中(写出反应的现象:有气体生成 、还有蓝色絮状沉淀)化学: 2Na + 2 H 2O + CuSO 4=Cu(OH)2↓+H 2 ↑ + Na 2SO 4离子:2Na +2H 2O +Cu 2+ +2OH - = 2 Na + + Cu(OH)2↓ + H 2 ↑红:生成碱性物质,使酚酞变红点燃浮:钠的密度比水的密度小游:生成了气体,推动小球四处游动响:反应放热,是周围的水迅速汽化 熔:钠的熔点低于1000C6、钠投入到氯化铁溶液中(写出反应的现象:有气体生成,有红褐色沉淀)化学:6Na + 6H2O + 2FeCl3=2Fe(OH)3↓+3H2 ↑ + 6NaCl离子: 6Na + 6H2O + 2Fe3+ = 2Fe(OH)3↓+ 3H2 ↑ + 6Na+7、氧化钠和水反应化学: Na2O+H2O=2NaOH离子: Na2O+H2O=2Na++2OH -8、过氧化钠和水反应化学: 2Na2O2+2H2O=4NaOH+O2↑离子: 2Na2O2+2H2O=4Na++4OH-+O2↑9、氧化钠和二氧化碳反应化学: Na2O+CO2=Na2CO310、过氧化钠和二氧化碳反应(用双线桥法标出电子转移情况)失去2×e-化学:2Na2O2+2CO2 =2Na2CO3+O 2得到2×e-11、氧化钠和盐酸反应化学: Na2O+2HCl=2NaCl+H2O 离子: Na2O+2H+=2Na++H2O 12、过氧化钠和盐酸反应化学:2Na2O2+4HCl=4NaCl+2H2O+O2↑离子: 2Na2O2+4H+=4Na++2H2O+O2↑13、碳酸钠和盐酸反应(1)向碳酸钠溶液加入少量盐酸化学:Na2CO3+HCl =NaHCO3 +NaCl 离子: CO32-+H+=HCO3-(2)向碳酸钠溶液加入过量盐酸化学:Na2CO3+2HCl=2NaCl+H2O+CO2↑离子: CO32-+2H+= H2O+CO2↑14、向碳酸氢钠溶液加入盐酸反应化学:NaHCO3+HCl=NaCl+H2O+CO2↑离子:HCO3-+H+= H2O+CO2↑a、分别向碳酸钠和碳酸氢钠溶液中加入盐酸,碳酸氢钠先放出气体。
钠及其化合物的方程式总结一、Na 单质1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、钠块在空气中变暗 :4Na + O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O + O 2 2Na 2O 24、金属锂在空气中燃烧 :4Li + O 2 2Li 2O5、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2NaOH + H 2 ↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑ 二、Na 2O 、Na 2O 2的相关反应:1、碱性氧化物Na 2O 与水的反应 :Na 2O +H 2O =2NaOH2、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,可用于漂白) 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH -+O 2↑3、碱性氧化物Na 2O 与CO 2的反应Na 2O + CO 2 = Na 2CO 34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、Na 2O + SO 2 = Na 2SO 3 Na 2O 2 + SO 2 = Na 2SO 46、Na 2O + 2HCl = 2NaCl + H 2O7、2Na 2O 2 +4HCl = 4NaCl + 2H 2O + O 2 ↑ 三、NaHCO 3与Na 2CO 31、小苏打受热分解: 2NaHCO 3Na 2CO 3 + H 2O +CO 2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO 3 + NaOHNa 2CO 3 + H 2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO 3+NaOH = Na 2CO 3+H 2O HCO 3-+OH - = H 2O +CO 32- 4、向NaOH 溶液中通入少量CO 2 :2NaOH + CO 2 = Na 2CO 3 + H 2O△△△△5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑7、Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2 =CaCO3↓+2 Na ClNaHCO3溶液与CaCl2 不反应铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O6、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O 2NaAlO2+3H2↑2Al+2OH-+2H2O 2AlO2-+3H2↑7、铝和浓硝酸共热:Al+6HNO3 Al(NO3)3+3NO2↑+3H2O Al+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2O Al+4H++NO3-Al3++NO ↑+2H2O9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu 2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4 Al2(SO4)3+3H2O Al2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2O Al2O3+2OH-2AlO2-+H2O3、电解氧化铝的熔融液:2Al 2O 3 4Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应: 2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应: Al(OH)3 +NaOHNaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合: Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓ SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性: Al 2(SO 4)3+6H 2O2Al(OH)3 +3H 2SO 4 Al 3++3H 2OAl(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液: Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓ Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH2NaAlO 2+3Na 2SO 4+4H 2O Al 3++4OH -AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O2Al 3++3SO 42-+3Ba 2++8OH -2AlO 2-+3BaSO 4 ↓+4H 2O7、向明矾溶液中加入少量的氢氧化钡溶液: 3Ba(OH)2 +2KAl(SO 4)22Al(OH)3 ↓+3BaSO 4 ↓+K 2SO 43Ba 2++6OH -+2Al 3++3SO 42-3BaSO 4 ↓+2Al(OH)3 ↓冰晶石电解8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O Al(OH)3+NaOH AlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl AlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O AlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓铁及其化合物的化学方程式和离子方程式一、Fe单质1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3 ·H2O]4、高温条件铁与氧气(Fe过量)反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2 ↑ Fe+2H+Fe2++H2 ↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2 ↑+6H2O9、少量的铁与浓硝酸共热:Fe+6HNO3(浓) Fe(NO3)3+3NO2 ↑+3H2O Fe+6H++3NO3-Fe3++3NO2 ↑+3H2O10、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑ +2H2O Fe+4H++NO3-Fe3++NO ↑+2H2O11、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O 3Fe+8H++2NO3-3Fe2++2NO +4H2O12、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu Fe+Cu2+Fe2++Cu13、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag Fe+2Ag+Fe2++2Ag14、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2 Fe+2Fe3+3Fe2+二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O2 2Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O FeO+2H+Fe2++H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)Fe(NO3)3+NO2 ↑+2H2O FeO+4H++NO3-Fe3++NO2 ↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O 3FeO+10H++NO3-3Fe3++NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O Fe3O4+8H+Fe2++2Fe3++4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO4(浓)3Fe2(SO4)3+SO2 ↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO3(浓)3Fe(NO3)3+NO2 ↑+5H2OFe3O4+10H++NO3-3Fe3++NO↑ +5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O3Fe3O4+28H++NO3-9Fe3++NO ↑+14H2O7、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O Fe3O4+8H+3Fe2++I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O Fe2O3+6H+2Fe3++3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O Fe2O3+6H++2I-2Fe2++I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O Fe(OH)2+2H+Fe2++2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3(浓)Fe(NO3)3+NO2 ↑+3H2OFe(OH)2+4H++NO3-Fe3++NO2 ↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑ +8H2O3Fe(OH)2+10H++NO3-3Fe3++NO↑ +8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe 2Al+3Fe2+2Al3++3Fe2、锌与氯化亚铁溶液反应:Zn+FeCl2ZnCl2+Fe Zn+Fe2+Zn2++Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3 ↓ 12Fe2++3O2+6H2O8Fe3++4Fe(OH)3 ↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O 4Fe2++O2+4H+4Fe3++2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-6、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-7、氯化亚铁溶液呈酸性:FeCl2+2H2O Fe(OH)2+2HCl Fe2++2H2O Fe(OH)2+2H+8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2 ↓+2NaCl Fe2++2OH-Fe(OH)2 ↓9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl Fe2++2NH3·H2O Fe(OH)2↓+2NH4+10、氯化亚铁溶液中加入四羟基铝酸钠溶液:FeCl2+2Na[Al(OH)4] Fe(OH)2 ↓+2Al(OH)3 ↓+2NaClFe2++2[Al(OH)4]-+4H2O2Al(OH)3 ↓+Fe(OH)2 ↓11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓Ag++Cl-AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl Fe2++S2-FeS↓13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4(浓)Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3(浓)Fe(NO3)3+NO2↑+H2OFe2++2H++NO3-Fe3++H2O+NO2↑15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O3Fe2++10H++NO3-3Fe3++NO↑ +5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O 2Fe2++H2O2+2H+2Fe3++2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3 ↓+8NaCl+O2 ↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O218、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO19、硫酸酸化的酸性高锰酸钾与氯化亚铁溶液反应5FeCl2+KMnO4+4H2SO4=3FeCl3+Fe2(SO4)3+MnSO4 +KCl+4H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O七、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl2Zn+2Fe3+2Fe2++Zn2+2、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe 3Zn+2Fe 3+3Zn 2++2Fe3、铁与氯化铁溶液反应:Fe +2FeCl 33FeCl2Fe+2Fe3+3Fe2+4、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+5、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl2Fe3++SO2+2H2O2Fe2++4H++SO42-6、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl Fe3++3OH-Fe(OH)3↓8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl Fe3++3NH3·H2O Fe(OH)3↓+3NH4+9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑2Fe3++3CO32-+3H2O2Fe(OH)3↓+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑Fe3++3HCO3-2Fe(OH)3↓+3CO2↑11、向氯化铁溶液中加入四羟基合氯酸钠溶液:FeCl3+3Na[Al(OH)4] Fe(OH)3↓+3Al(OH)3↓+3NaClFe3++3[Al(OH)4]-Fe(OH)3↓+3Al(OH)3↓12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓ +2HCl 2Fe 3++H 2S 2Fe 2++S ↓+2H +14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl 2Fe3++2I-2Fe2++I215、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓ +2NaCl 2Fe3++S2-2Fe2++S ↓16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓ +6NaCl 2Fe3++3S2-2FeS+S ↓17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl 2Fe3++2I-2Fe2++I218、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓ +Fe(NO3)3Ag++Cl-AgCl↓19、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl Fe3++3SCN-Fe(SCN) 320、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3。
金属相关方程式总结一、钠和钠的化合物1、钠与水反应:2Na+2H2O = 2NaOH+H2↑;2Na+2H2O = 2Na++2OH-+H2↑2、钠与氧气反应:①常温反应:4Na+O2 = 2Na2O ②点燃或加热:2Na+O2燃点Na2O23、钠与盐酸等酸反应:2Na+2HCl = 2NaCl +H2↑;2Na+2H+ =2Na++H2↑4、钠与氯气的反应:2Na+Cl2燃点2NaCl5、钠与硫的反应:2Na+S Na2S6、钠与碱溶液的反应实际上是与钠跟水的反应:2Na+2H2O = 2NaOH+H2↑7、钠与盐溶液的反应①NaCl溶液:实际上是与水反应,反应的化学方程式:2Na+2H2O = 2NaOH+H2↑②CuSO4溶液:2Na+CuSO4 +2H2O = Cu(OH)2↓+H2↑ + Na2SO4③NaHSO4溶液:2Na + 2NaHSO4 = 2Na2SO4 + H2↑④通常钠不能从盐溶液中置换出金属;若盐为熔融状态,钠可以置换出较不活泼的金属,如:4Na + TiCl4(熔融)= 4 NaCl + Ti8、金属钠露置在空气中的变化过程:4Na+O2 =2Na2O ;Na2O+H2O = 2NaOH ;2NaOH+CO2=Na2CO 3+H2O9、氧化钠和水的反应:Na2O+H2O=2NaOH10、氧化钠和盐酸的反应:Na2O+2HCl =2NaCl+H2O11、氧化钠和二氧化碳的反应:Na2O+CO2 =Na2CO312、过氧化钠和水的反应:2Na2O2+2H2O=4NaOH+O2↑13、过氧化钠和二氧化碳的反应:2Na2O2+2CO2=2Na2CO3+O214、过氧化钠和盐酸的反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑15、氧化钠和过氧化钠转化:2Na2O+O22Na2O2高中化学必备16、碳酸钠和盐酸反应:①Na2CO3+HCl(少)=NaHCO3+NaCl②Na2CO3+2HCl(多)=2NaCl+H2O+CO2↑17、碳酸钠和氢氧化钙反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH18、碳酸钠和可溶性盐反应:Na2CO3+CaCl2=CaCO3↓+2NaClNa2CO3+BaCl2=BaCO3↓+2NaCl19、碳酸氢钠和盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑20、碳酸氢钠和氢氧化钠:NaHCO3+NaOH=Na2CO3+H2O;HCO3-+OH-=CO32-+H2O21、碳酸氢钠和氢氧化钙反应:2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2ONaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O22、碳酸氢钠和盐反应:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑23、碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑24、碳酸氢钠和碳酸钠的相互转化:Na2CO3+H2O+CO2=2NaHCO3(溶液中的反应)2NaHCO3Na2CO3+H2O+CO2↑;NaHCO3+NaOH=Na2CO3+H2O25、碳酸氢钠制法:NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl(侯氏制碱法中的一步)二、铝和铝的化合物1、铝与氧气反应:4Al+3O22Al2O32、铝与盐酸等酸的反应:2Al+6HCl=2AlCl3+3H2↑3、铝与氢氧化钠溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑4、氧化铝和盐酸反应:Al2O3+6HCl=2AlCl3+3H2O5、氧化铝和氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O6、氢氧化铝制备:Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4Al3++3NH3•H2O=Al(OH)3↓+3NH4+7、氢氧化铝和酸的反应:Al(OH)3+3HCl=AlCl3+3H2O8、氢氧化铝和氢氧化钠的反应:Al(OH)3+NaOH=NaAlO2+2H2O9、氢氧化铝不稳定性:2Al(OH)3Al2O3+3H2O10、铝盐和弱碱反应:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl11、铝盐和强碱反应:AlCl3+3NaOH(少量)=Al(OH)3↓+3NaCl(不用此方法制备Al(OH)3)AlCl3+4NaOH(碱过量)=NaAlO2+3NaCl+2H2O12、偏铝酸盐和弱酸反应:2NaAlO2+3H2O+CO2(少量)= 2Al(OH)3↓+ Na2CO3NaAlO2+2H2O+CO2(过量)=Al(OH)3↓+ NaHCO313、偏铝酸盐和强酸反应:NaAlO2+H2O+HCl(少量)=Al(OH)3↓+NaClNaAlO2+4HCl(过量)= AlCl3+NaCl+2H2O14、偏铝酸盐和铝盐反应:3NaAlO2+ AlCl3+6H2O = 4Al(OH)3↓+3NaCl三、铁和铁的化合物1、铁与氧气反应:3Fe+2O2Fe3O42、铁与水蒸气反应:3Fe+4H2O(g)高温Fe3O4+4H2↑3、铁与盐酸等非氧化性酸反应:Fe+2HCl=FeCl2+H2↑4、铁的氧化物分别与酸反应:FeO+2H+=Fe2++H2O;Fe2O3+6H+=2Fe3++3H2OFe3O4+8H+=Fe2++2Fe3++4H2O5、铁的氧化物与还原剂反应:Fe x O y+yCO 高温xFe+yCO26、氢氧化铁与酸反应:Fe(OH)3+3HCl=FeCl3+3H2O7、铁的氢氧化物制备:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4FeCl3+3NaOH= Fe(OH)3↓+3NaCl8、氢氧化亚铁转化为氢氧化铁:4Fe(OH)2+O2+2H2O= 4Fe(OH)3(白↓→灰绿→红褐色)9、氢氧化铁受热分解:2Fe(OH)3Fe2O3+3H2O10、Fe3+的检验:Fe3++3SCN- =Fe(SCN)3(血红色)11、Fe3+的氧化性:2Fe3++Fe=3Fe2+;2Fe3++Cu=2Fe2++Cu2+12、Fe2+的还原性:2Fe2++Cl2=2Fe3++2Cl-(Fe2+检验)13、Fe2+的检验:先加KSCN无明显现象,再加氯水,溶液变为血红色。
钠及其化合物的化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+CuOH2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2AlOH3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOH2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O CuOH2↓+Na2SO45、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2AlOH3↓+6NaCl6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2CuOH2↓+2Na2SO4+O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4AlOH3↓+12NaCl+3O2↑6、向氯化铝溶液中加过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4FeOH3↓+4Na2SO4+O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO39、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO311、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:AlOH3+NaOH NaAlO2+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO324、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+CuOH2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH FeOH3↓+3NaCl26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH AlOH3↓+3NaCl27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:CaHCO32+NaOH CaCO3↓+NaHCO3+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:CaHCO32+2NaOH CaCO3↓+Na2CO3+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:MgHCO32+2NaOH MgOH2↓+2NaHCO335、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:MgHCO32+4NaOH MgOH2↓+Na2CO3+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO32、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+CaOH2CaCO3↓+2NaOH2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOH4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaCl5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO38、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO39、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2AlOH3↓+6NaCl+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2FeOH3↓+6NaCl+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOH2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3AlOH3↓+3NaCl+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3FeOH3↓+3NaCl+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+CaOH2 =CaCO3↓+NaOH+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液: 2NaHCO3+CaOH2 =CaCO3↓+Na2CO3+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O铝及其化合物的化学方程式 一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 32、铝在氯气中燃烧:2Al +3Cl 22AlCl 33、铝和硫共热:2Al +3S Al 2S 34、铝与稀硫酸反应:2Al +3H 2SO 4Al 2SO 43 +3H 2 ↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O2NaAlO 2+3H 2 ↑6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2SO 43 +3SO 2 ↑+6H 2O7、铝和浓硝酸共热:Al +6HNO 3AlNO 33 +3NO 2 ↑+3H 2O8、铝和稀硝酸反应:Al +4HNO 3AlNO 33 +NO ↑+2H 2O8、铝和硝酸银溶液反应:Al +3AgNO 3AlNO 33 +3Ag 9、铝与硫酸铜溶液反应:2Al +3CuSO 4Al 2SO 43 +3Cu10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe 11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu 13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2SO 43 +3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH 2NaAlO 2+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2AlOH 3 +3H 2SO 4Al 2SO 43 +6H 2O2、氢氧化铝与氢氧化钠溶液反应:AlOH 3 +NaOHNaAlO 2+2H 2O3、加热氢氧化铝:2AlOH 3 Al 2O 3+3H 2O四、硫酸铝冰晶石电解1、硫酸铝溶液与氯化钡溶液混合:Al2SO43+3BaCl22AlCl3+3BaSO4↓2、硫酸铝的水溶液呈酸性:Al2SO43+6H2O2AlOH3+3H2SO43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2SO43+6NaOH3Na2SO4+2AlOH3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2SO43+8NaOH2NaAlO2+3Na2SO4+4H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2SO43+3BaOH22AlOH3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2SO43+4BaOH2BaAlO22+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3BaOH2+2KAlSO422AlOH3↓+3BaSO4↓+K2SO48、向明矾溶液中加入足量的氢氧化钡溶液:KAlSO42+2BaOH2KAlO2+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2SO43+6NH3·H2O2AlOH3↓+3NH42SO410、向硫酸铝溶液中加入碳酸钠溶液:Al2SO43+3Na2CO3+3H2O2AlOH3↓+3Na2SO4+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2SO43+6NaHCO32AlOH3↓+3Na2SO4+6CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2SO43+3Na2S+6H2O2AlOH3↓+3Na2SO4+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2SO43+6NaHS+6H2O2AlOH3↓+3Na2SO4+6H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2SO43+3Na2SiO3+6H2O2AlOH3↓+3Na2SO4+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2SO43+6NaAlO2+12H2O3Na2SO4+8AlOH3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AIOH3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O AlOH3↓+NaCl↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2AlOH3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O AlOH3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2SO43+6NaAlO2+12H2O3Na2SO4+8AlOH3↓7、向偏铝酸钠溶液中加氯化铵:NaAlO2+NH4Cl+H2O AlOH3↓+NaCl+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3AlOH3↓+FeOH3↓+3NaCl铁及其化合物的化学方程式一、铁1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2Fe2O3·H2O4、高温条件铁与氧气反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4Fe2SO43+3SO2↑+6H2O9、过量的铁与浓硫酸共热:Fe+2H2SO4FeSO4+SO2↑+2H2O10、少量的铁与浓硝酸共热:Fe+6HNO3FeNO33+3NO2↑+3H2O11、过量的铁与浓硝酸共热:Fe+4HNO3FeNO32+2NO2↑+2H2O12、少量的铁与稀硝酸反应:Fe+4HNO3FeNO33+NO↑+2H2O13、过量的铁与稀硝酸反应: 3Fe+8HNO33FeNO32+2NO ↑+4H2O14、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu15、铁与硝酸银溶液反应:Fe+2AgNO3FeNO32+2Ag16、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O22Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4Fe2SO43+SO2↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3FeNO33+NO2↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33FeNO33+NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO43Fe2SO43+SO2↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO33FeNO33+NO2↑+5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39FeNO33+NO ↑+14H2O6、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:FeOH2+H2SO4FeSO4+2H2O2、氢氧化亚铁与浓硫酸反应:2FeOH2+4H2SO4Fe2SO43+SO2↑+6H2O3、氢氧化亚铁与浓硝酸反应:FeOH2+4HNO3FeNO33+NO2↑+3H2O4、氢氧化亚铁与稀硝酸反应:3FeOH2+10HNO33FeNO33+NO↑+8H2O5、氢氧化亚铁在空气中被氧化:4FeOH2+O2+2H2O4FeOH36、氢氧化亚铁隔绝空气加热:FeOH2FeO+H2O7、氢氧化亚铁在空气中加热:4FeOH2+O22Fe2O3+4H2O六、氢氧化铁1、氢氧化铁与稀硫酸反应:2FeOH3+3H2SO4Fe2SO43+6H2O2、氢氧化铁溶于氢碘酸:2FeOH3+6HI2FeI2+I2+6H2O3、加热氢氧化铁:2FeOH3Fe2O3+3H2O七、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe2、锌与氯化亚铁反应:Zn+FeCl2ZnCl2+Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4FeOH3↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl36、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr37、氯化亚铁溶液呈酸性:FeCl2+2H2O FeOH2+2HCl8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH FeOH2↓+2NaCl9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O FeOH2↓+2NH4Cl10、氯化亚铁溶液中加入偏铝酸钠溶液:FeCl2+2NaAlO2+4H2O FeOH2↓+2AlOH3↓+2NaCl11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3FeNO32+2AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4Fe2SO43+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:FeNO32+2HNO3FeNO33+NO2↑+H2O15、硝酸亚铁溶液与稀硝酸反应:3FeNO32+10HNO33FeNO33+NO ↑+5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4FeOH3↓+8NaCl+O2↑18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2FeOH3↓+5NaCl+4HClO八、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl22、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe3、铁与氯化铁溶液反应:Fe+2FeCl33FeCl24、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl25、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl6、氯化铁溶液呈酸性:FeCl3+3H2O FeOH3+3HCl7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH FeOH3↓+3NaCl8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O FeOH3↓+3NH4Cl9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2FeOH3↓+6NaCl+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3FeOH3↓+3NaCl+3CO2↑11、向氯化铁溶液中加入偏铝酸钠溶液:FeCl3+3NaAlO2+6H2O FeOH3↓+3AlOH3↓+3NaCl12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O FeOH3↓+3NaCl+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓+2HCl14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓+2NaCl16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓+6NaCl17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl18、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓+FeNO3319、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN FeSCN3+3KCl20、氧化镁投入到氯化铁溶液中: 3MgO+2FeCl3+3H2O3MgCl2+2FeOH321、氢氧化镁投入到氯化铁溶液中:3MgOH2+2FeCl33MgCl2+2FeOH3。
化学方程式和离子方程式钠及其化合物一、钠1、钠在氧气中燃烧:2Na+O 2Na2O22、钠在氯气中燃烧:2Na+Cl 22NaCl3、钠常温条件下和氧气反应:4Na+O 22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H +2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl 44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO 2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H +2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl 3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO 22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H +4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH -Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH -5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH -2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO 2Na2CO3+H2O2OH-+CO 2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO 2NaHCO3 OH-+CO 2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO 2Na2SO3+H2O2OH-+SO 2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO 2NaHSO3 OH-+SO 2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH -2PO43-+3H2O 12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH -NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH -2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO 2Na2SiO3+H2O2OH-+SiO 2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH -SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O H++OH -H2O 17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH -CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH -S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH -HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH -H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH -PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH -AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH -AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH -Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH -Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH -Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH -AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH -NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH -NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH -CO32-+NH3↑+2H2O 31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH -CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH -CaCO3+CO32-+2H2O 34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH -Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O Mg2++2HCO32-+4OH -Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO 3AgCl↓+NaNO3Cl-+Ag +AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO 4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl 2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H +HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H +CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O CO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H +CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O HCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl 3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl 3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH -CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH -CaCO3↓+CO32-+2H2O 9、碳酸氢钠受热分解:2NaHCO 3Na2CO3+CO2↑+H2O镁及其化合物一、镁1、镁在氧气中燃烧:2Mg+O 22MgO2、镁在氯气中燃烧:Mg+Cl 2MgCl23、镁在氮气中燃烧:3Mg+N 2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO 22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H +Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl 32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl 33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO 4MgSO4+CuMg+Cu2+Mg2++Cu 13、镁和浓硫酸反应:Mg+2H2SO 4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO 3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO 33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H +Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O 4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H +Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl 33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO 32AgCl ↓+Mg(NO3)2Cl-+Ag +AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH -Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O==Mg(OH)2↓+2Al(OH)3↓+2NaCl Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl 2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO 3-+4OH-===Mg(OH)2↓+2CO32-+2H2O 4、碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O Mg2++2HCO 3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO 2↑+H2O 铝及其化合物一、铝1、铝在氧气中燃烧:4Al+3O 22Al2O32、铝在氯气中燃烧:2Al+3Cl 22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH +2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO 4Al2(SO4)3+3H2OAl2O3+6H +2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O3、电解氧化铝的熔融液:2Al2O 34Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2OAl(OH)3+3H+Al3++3H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-==2AlO2-+3BaSO4↓+4H2O 7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O 9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O==2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O==2Al(OH)3↓+3Na2SO4+3H2S↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O==2Al(OH)3↓+3Na2SO4+6H2S↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O==2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-冰晶石电解2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O===3Al(OH)3↓+Fe(OH)3↓+3NaCl 3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
钠铝及重要化合物知识点小结(★为必背方程式)一、钠及其化合物(一)钠 Na1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
★2、单质钠的化学性质: ① 钠与O 2反应常温下:4Na + O 2=2Na 2O ★(新切开的钠放在空气中容易变暗)加热时:2Na + O 2==Na 2O 2 ★(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na 2O 2。
)钠在空气中的变化过程:Na ―→Na 2O ―→NaOH ―→Na 2CO 3·10H 2O (结晶)―→Na 2CO 3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na 2O ),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH 易潮解),最终变成白色粉未(最终产物是Na 2CO 3)。
② 钠与H 2O 反应2Na +2H 2O =2NaOH +H 2↑ ★离子方程式:2Na ++2H 2O =2Na ++2OH -+H 2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH 遇酚酞变红”。
③ 钠与盐溶液反应如钠与CuSO 4溶液反应,应该先是钠与H 2O 反应生成NaOH 与H 2,再和CuSO 4溶液反应,有关化学方程式: 2Na +2H 2O =2NaOH +H 2↑ CuSO 4+2NaOH =Cu(OH)2↓+Na 2SO 4 总的方程式:2Na +2H 2O +CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑★实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K 、Ca 、Na 三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应④ 钠与酸反应:2Na +2HCl =2NaCl +H 2↑(反应剧烈) 离子方程式:2Na +2H +=2Na ++H 2↑3、钠的存在:以化合态存在。
4、钠的保存:保存在煤油或石蜡中。
5、工业制钠:电解熔融的NaCl :2NaCl(熔融) 2Na + Cl 2↑★6、钠的用途:① 在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;② 钠钾合金是快中子反应堆的热交换剂;③ 钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。
(二)氧化钠和过氧化钠1、Na 2O 2O + H 2O == 2NaOH , ★Na 2O + CO 2 == Na 2CO 3, ★ Na 2O + 2HCl == 2NaCl + H 2O .★另外:加热时,2Na 2O + O 2 == 2Na 2O 22、Na 2O 2:淡黄色固体是过氧化物,易与水和二氧化碳反应。
2Na 2O 2 + 2H 2O == 4NaOH + O 2 ★;2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 ★(作供氧剂)。
因此Na 2O 2常做生氧剂,同时,Na 2O 2还具有强氧化性,有漂白作用。
如实验:Na 2O 2和水反应后的溶液中滴加酚酞,变红后又褪色。
通电白色固体,是碱性氧化物,具有碱性氧化物的通性:(三)钠盐:Na与NaHCO的性质比较★注意几个实验的问题:1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。
★2、Na2CO3溶液与稀HCl的反应①:向Na2CO3溶液中滴加稀HCl,先无气体,后有气体,如果n(HCl)小于n(Na2CO3)时反应无气体放出。
发生的反应:先Na2CO3 + HCl == NaCl + NaHCO3,后NaHCO3 + HCl == NaCl + H2O +CO2↑★②向稀HCl中滴加Na2CO3溶液,先有气体,反应是:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑★3、Na2CO3溶液和NaHCO3溶液的鉴别:取两种试液少量,分别滴加CaCl2或BaCl2溶液,有白色沉淀的原取溶液为Na2CO3,另一无明显现象的原取溶液为NaHCO3★4、侯氏制碱法(了解就行)反应式:NaCl + NH3 + CO2 + H2O == NaHCO3 + NH4Cl.注意:在生产中应先在饱和的NaCl溶液中先通入NH3,后通入CO2,NaHCO3晶体析出过滤,在滤液中加入NaCl细末和通NH3析出NH4Cl晶体为副产品。
NH4Cl晶体析出后的母液进行循环试用,提高原料的利用率。
(四)氢氧化钠NaOH:俗称烧碱、火碱、苛性钠,易潮解,有强腐蚀性,具有碱的通性。
二、铝及其化合物(一)铝的性质1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。
有良好的导电、导热性和延展性。
2、化学性质:铝是较活泼的金属。
① 通常与氧气易反应,生成致密的氧化物起保护作用。
4Al + 3O 2 == 2Al 2O 3★。
同时也容易与Cl 2、S 等非金属单质反应。
② 与酸反应:非强氧化性酸反应时放出氢气。
( 2Al +6H +=2Al 3++3H 2↑ )③ 与强碱溶液反应:2Al + 2NaOH + 2H 2O == 2NaAlO 2 + 3H 2↑( 2Al +2OH -+2H 2O =2AlO 2-+3H 2↑)★ ④ 与某些盐溶液反应:如能置换出CuSO 4、AgNO 3等溶液中的金属。
(二)氧化铝(Al 2O 3)白色固体,熔点高(2054℃),沸点2980℃,常作为耐火材料;是两性氧化物。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物。
Al 2O 3 + 6HCl == 2AlCl 3 + 3H 2O ★ ,Al 2O 3 + 2NaOH == 2NaAlO 2 + H 2O 。
★Al 2O 3是工业冶炼铝的原料,由于氧化铝的熔点高,电解时,难熔化,因此铝的冶炼直到1886年美国科学家霍尔发现在氧化铝中加入冰晶石(Na 3AlF 6 ),使氧化铝的熔点降至1000度左右,铝的冶炼才快速发展起来,铝及其合金才被广泛的应用。
2Al 2O 34Al + 3O 2↑。
(三)氢氧化铝(Al(OH)3)白色难溶于水的胶状沉淀,是两性氢氧化物。
加热易分解。
两性氢氧化物:既能与强酸又能与强碱反应生成盐和水的氢氧化物。
Al(OH)3 + 3HCl == AlCl 3 + 3H 2O, ★ Al(OH)3 + NaOH == NaAlO 2 + 2H 2O .★2Al(OH)3 Al2O 3 +3 H 2O ★(四)铝的冶炼(了解就行)铝是地壳中含量最多的金属元素,自然界中主要是以氧化铝的形式存在。
工业生产的流程:铝土矿(主要成分是氧化铝)→用氢氧化钠溶解过滤→向滤液中通入二氧化碳酸化,过滤→氢氧化铝→氧化铝→铝。
主要反应:Al 2O 3 + 2NaOH == 2NaAlO 2 + H 2O ,CO 2 + 3H 2O + 2NaAlO 2 == 2Al(OH)3↓+ Na 2CO 3 , 2Al(OH)3 △Al 2O 3 +3 H 2O ,2Al 2O 3通电4Al + 3O 2↑。
(五)铝的用途:铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金,铝合金强度高,密度小,易成型,有较好的耐腐蚀性。
迅速风靡建筑业。
也是飞机制造业的主要原料。
(六)明矾的净水(了解):化学式:KAl(SO 4)2·12H 2O ,它在水中能电离:KAl(SO 4)2 == K + + Al 3+ + 2SO 42-。
铝离子与水反应,生成氢氧化铝胶体,具有很强的吸附能力,吸附水中的悬浮物,使之沉降已达净水目的。
Al 3+ + 3H 2O == Al(OH)3 (胶体)+ 3H + 。
知识整理:① Al(OH)3)的制备:在氯化铝或硫酸铝溶液中加足量氨水。
AlCl 3 + 3NH 3·H 2O == Al(OH)3↓+ 3NH 4Cl ★ Al 2(SO 4)3+6NH 3·H 2O==2Al(OH)3↓+3(NH 4)2SO 4 ★ ② 实验:A 、向氯化铝溶液中滴加氢氧化钠溶液,现象是先有沉淀,后溶解。
反应式:先Al 3+ + 3OH - == Al(OH)3↓, 后Al 3+ + 4OH - == AlO 2- + 2H 2O 。
B 、向氢氧化钠溶液中滴加氯化铝溶液,现象是开始无沉淀,后来有沉淀,且不溶解。
反应式:先Al 3+ + 4OH - == AlO 2- + 2H 2O ,后Al 3+ + 3AlO 2- + 6H 2O == 4Al(OH)3↓。
② 实验(了解):向偏铝酸钠溶液中通二氧化碳,有沉淀出现。
CO 2 + 3H 2O + 2NaAlO 2 == 2Al(OH)3↓+ Na 2CO 3。
通电△③将氯化铝溶液和偏铝酸钠溶液混和有沉淀出现。
Al3+ + 3AlO2- + 6H2O == 4Al(OH)3↓。
(了解)④实验:A、向偏铝酸钠溶液中滴加稀盐酸,先有沉定,后溶解。
(了解)反应的离子方程式:AlO2- + H+ + H2O == Al(OH)3 ,Al(OH)3 + 3H+ == Al3+ + 2H2O 。
B、向稀盐酸中滴加偏铝酸钠溶液,先无沉淀,后有沉淀且不溶解。
反应的离子方程式:AlO2- + 4H+ == Al3+ + 2H2O ,3AlO2- + Al3+ + 6H2O == 4Al(OH)3↓。