3-氧化反应
- 格式:ppt
- 大小:604.50 KB
- 文档页数:46

三价砷的氧化数据1. 介绍三价砷是一种常见的元素,具有广泛的应用和研究价值。
本文将探讨三价砷的氧化数据,包括其氧化态、氧化反应以及相关的实验数据等内容。
2. 三价砷的氧化态三价砷的氧化态一般为+3,即As(III)。
在这种氧化态下,三价砷的化学性质与其他氧化态有所不同,因此研究其氧化数据对于深入了解三价砷的性质具有重要意义。
3. 氧化反应三价砷可以通过氧化反应转化为其他氧化态。
以下是一些常见的三价砷氧化反应:3.1 氧气氧化三价砷可以与氧气发生氧化反应,生成五价砷(As(V))。
该反应可以用以下方程式表示:2As(III) + 3O2 → 2As(V) + 3O2-3.2 氧化剂氧化除了氧气,一些氧化剂也可以将三价砷氧化为五价砷。
常见的氧化剂包括过氧化氢、高锰酸钾等。
以下是一个过氧化氢氧化三价砷的反应方程式: 2As(III) + 3H2O2 → 2As(V) + 3H2O4. 实验数据研究三价砷的氧化数据需要进行实验来获取相关数据。
以下是一些相关实验数据的例子:4.1 氧化反应速率通过测量三价砷氧化反应的速率,可以获得其氧化动力学数据。
例如,可以使用紫外-可见光谱法跟踪三价砷氧化反应的进程,并根据反应速率得出相关数据。
4.2 氧化产物分析通过对氧化反应产物的分析,可以了解三价砷从三价到五价的转化过程。
例如,可以使用X射线吸收光谱(XAS)等方法对氧化产物进行表征和分析。
5. 结论三价砷的氧化数据对于研究其性质和应用具有重要意义。
通过实验可以获得相关数据,进一步深入了解三价砷的氧化反应和转化机制。
这些数据对于环境污染控制、药物研发等领域都具有重要的应用价值。
通过深入研究三价砷的氧化数据,可以为相关领域的进一步研究和应用提供重要参考依据。
参考文献1.Smith, J. D., & Johnson, T. M. (2018). Arsenic redox dynamics insoils: A review. Environmental pollution, 234, 181-194.2.Manning, B. A., & Fendorf, S. (2004). Reduction of arsenic(V) bydissimilatory iron(III) reducing bacteria. Geochimica etCosmochimica Acta, 68(11), 2467-2478.3.Oremland, R. S., & Stolz, J. F. (2005). Arsenic, microbes andcontaminated aquifers. Trends in microbiology, 13(2), 45-49.。

氧化反应方程式
氧化反应方程式是描述物质在与氧气反应时发生氧化的化学方程式。
具体的反应方程式取决于反应物的种类和反应条件。
以下是一些常见物质的氧化反应方程式的示例:
1.金属的氧化反应方程式(生成金属氧化物):铁+ 氧气->
二氧化铁 4Fe + 3O2 -> 2Fe2O3
2.非金属物质的氧化反应方程式:硫 + 氧气 -> 二氧化硫 S +
O2 -> SO2
3.碳氢化合物的氧化反应方程式:甲烷 + 氧气 -> 二氧化碳 +
水 CH4 + 2O2 -> CO2 + 2H2O
4.无机化合物的氧化反应方程式:二氧化硫+ 氧气-> 三氧
化硫 SO2 + O2 -> SO3
请注意,这些方程式是示例。
氧化反应的方程式会根据具体的反应物和反应条件而有所不同。
此外,方程式中的系数应根据生成物的摩尔比例进行平衡,以确保质量守恒和电荷守恒。


50个氧化还原反应方程式本文将为您呈现50个氧化还原反应方程式,并对每个反应进行详细解释。
氧化还原反应是化学中最重要的类型之一,在这些反应中,电子的转移导致物质的氧化和还原。
这些反应在生活中随处可见,从燃烧到电池都离不开氧化还原反应的参与。
请阅读以下内容,了解更多关于氧化还原反应的知识。
1. 单质的氧化1.氢气(H2)与氧气(O2)生成水(H2O):2H2+O2→2H2O解释:在这个反应中,氢发生了氧化,由0价变为+1价;而氧发生了还原,由0价变为-2价。
2. 单质的还原2.氯气(Cl2)与钾(K)生成钾氯化合物(KCl):Cl2+2K→2KCl解释:在这个反应中,氯发生了还原,由0价变为-1价;而钾发生了氧化,由0价变为+1价。
3. 非金属元素的氧化3.硫(S)与氧气(O2)生成二氧化硫(SO2):S+O2→SO2解释:在这个反应中,硫发生了氧化,由0价变为+4价;而氧发生了还原,由0价变为-2价。
4. 非金属元素的还原4.氢气(H2)与氟气(F2)生成氢氟酸(HF):H2+F2→2HF解释:在这个反应中,氢发生了还原,由0价变为+1价;而氟发生了氧化,由0价变为-1价。
5. 金属的氧化5.铁(Fe)与氧气(O2)生成铁(III) 氧化物(Fe2O3):4Fe+3O2→2Fe2O3解释:在这个反应中,铁发生了氧化,由0价变为+3价;而氧发生了还原,由0价变为-2价。
6. 金属的还原6.铜(II) 氯酸盐(CuCl2)与锌(Zn)生成铜和锌(II) 氯酸盐(ZnCl2):Zn+CuCl2→ZnCl2+Cu解释:在这个反应中,锌发生了还原,由0价变为+2价;而铜发生了氧化,由+2价变为0价。
7. 氧化物的分解7.二氧化二氮(N2O4)分解成二氧化氮(NO2):N2O4→2NO2解释:在这个反应中,二氧化二氮发生了分解,产物是两个氮原子的含有不同电荷的离子。
8. 氢化物的分解8.氯化铝(AlCl3)与水(H2O)分解成盐酸(HCl)和三氯化铝(AlCl3):AlCl3+H2O→HCl+Al(OH)3解释:在这个反应中,水发生了分解,产生了酸和碱。

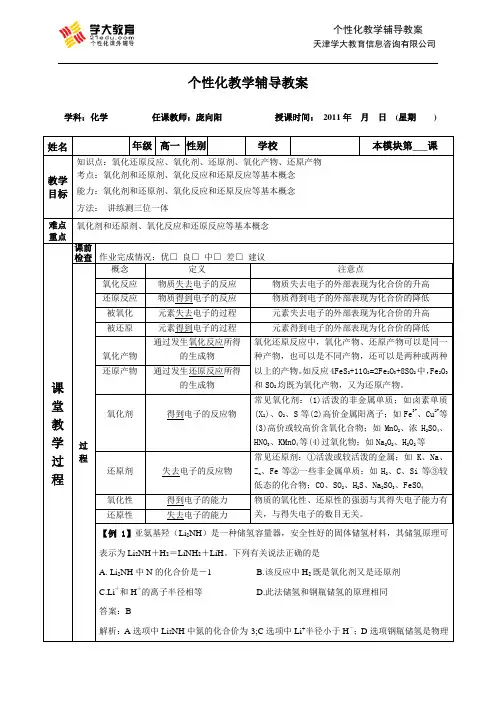
个性化教学辅导教案学科:化学任课教师:庞向阳授课时间:2011年月日(星期) 姓名年级高一性别学校本模块第___课教学目标知识点:氧化还原反应、氧化剂、还原剂、氧化产物、还原产物考点:氧化剂和还原剂、氧化反应和还原反应等基本概念能力:氧化剂和还原剂、氧化反应和还原反应等基本概念方法:讲练测三位一体难点重点氧化剂和还原剂、氧化反应和还原反应等基本概念课堂教学过程课前检查作业完成情况:优□良□中□差□建议__________________________________________过程概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低氧化产物通过发生氧化反应所得的生成物氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。
如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。
还原产物通过发生还原反应所得的生成物氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Z n、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。
还原性失去电子的能力【例1】亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。

![[北科大]无机化学实验:3 氧化还原反应(实验报告)](https://uimg.taocdn.com/c1e327df804d2b160a4ec049.webp)


化合物1,2,3-三唑氧化还原反应是一种重要的有机合成反应,常常用于合成药物、农药等化合物。
在这篇文章中,我将为您全面解析这一反应的原理、应用和意义。
一、化合物1,2,3-三唑氧化还原反应的原理化合物1,2,3-三唑氧化还原反应是指在1,2,3-三唑环上发生氧化还原反应,通常是在有机化学合成中发生的一类重要反应。
它的原理主要是在1,2,3-三唑环上引入氧化还原基团,从而实现有机化合物的合成和功能改变。
二、化合物1,2,3-三唑氧化还原反应的应用1. 药物合成化合物1,2,3-三唑环是许多药物分子的重要结构单元,通过1,2,3-三唑氧化还原反应,可以合成具有特定药理活性的化合物,并且具有良好的生物利用度和药效学特性。
2. 农药合成1,2,3-三唑氧化还原反应也在农药合成中扮演着重要角色,通过引入氧化还原基团,可以赋予农药分子特定的杀虫、杀菌活性,从而提高农药的效果和安全性。
三、化合物1,2,3-三唑氧化还原反应的意义1. 拓展有机合成方法化合物1,2,3-三唑氧化还原反应为有机合成提供了新的方法和途径,丰富了有机合成的工具和手段,为合成复杂有机分子提供了新的思路和可能性。
2. 提高化合物的功能性通过化合物1,2,3-三唑氧化还原反应引入不同的氧化还原基团,可以赋予有机分子不同的化学和生物活性,从而提高化合物的功能性和应用价值。
总结化合物1,2,3-三唑氧化还原反应作为一种重要的有机合成反应,不仅在药物、农药等领域具有重要的应用价值,而且拓展了有机合成的方法和手段,为合成具有特定功能的有机分子提供了新的可能性。
通过对该反应原理、应用和意义的全面探讨,相信您已经对这一重要的有机合成反应有了更深入的了解。
个人观点和理解化合物1,2,3-三唑氧化还原反应作为一种重要的有机合成反应,在化学合成领域具有广泛的应用前景和研究价值。
在未来,该反应依然会在化学合成领域发挥重要作用,为合成具有特定功能的有机分子提供新的思路和途径。
IO3-和NaHSO3反应方程式是一种亚硫酸钠和高碘酸盐之间的还原-氧化反应。
在这个反应中,亚硫酸钠(NaHSO3)将氧化性较强的高碘酸盐(IO3-)还原为碘离子(I-),并且自身被氧化为硫酸根离子(SO4^2-)。
这种反应在化学实验室和工业生产中被广泛应用,同时也具有一定的理论研究价值。
让我们简要了解一下亚硫酸钠和高碘酸盐的化学特性。
亚硫酸钠是一种无机化合物,化学式为NaHSO3,常见的形式是白色结晶性固体。
它是一种较强的还原剂,通常用于食品加工和医药工业中作为抗氧化剂和防腐剂。
高碘酸盐(IO3-)则是一种离子化合物,其中碘的氧化态为+5。
它是一种强氧化剂,常用于化学分析和催化剂制备中。
接下来,我们将讨论IO3-和NaHSO3反应方程式的具体过程。
在这个反应中,亚硫酸钠的分子中的亚硫酸根离子HCO3-发生氧化,使得其氧化态由+4升高至+6,同时高碘酸盐中的碘氧化态由+5降低至+1,生成了碘离子I-。
反应的化学方程式可以表示为:NaHSO3 + IO3- → Na+ + SO4^2- + I- + H2O通过观察上述反应方程,我们可以看到亚硫酸钠发生了氧化反应,而高碘酸盐发生了还原反应。
这种反应过程是一种典型的氧化还原反应,符合氧化数的变化规律。
除了化学方程式,我们还可以通过实验数据和理论计算来进一步探讨这一反应的深入机理。
通过对反应过程中物质的摩尔比例和生成物的质量来进行实验分析,从而验证反应方程式的准确性。
理论计算可以帮助我们理解化学键的断裂和形成过程,以及反应速率和热力学参数的计算,从而全面理解这一化学反应的物理意义。
IO3-和NaHSO3反应方程式是一种重要的氧化还原反应,通过深入探讨其化学方程式和反应机理,我们可以更好地理解氧化还原反应的基本原理和应用。
这种反应也为化学工业和理论研究提供了有价值的参考和研究对象。
在我个人看来,对于化学反应方程式的深入理解是化学学习中的重要环节,通过实验和理论分析,我们可以揭示化学反应的奥秘,从而推动化学科学的发展和应用。
clo3负与vo2正反应方程式一、概述1.1 研究背景在化学实验中,我们经常会遇到氧化还原反应。
氧化还原反应是化学反应中最常见的一种类型,也是我们生活中不可或缺的一部分。
氧化还原反应中,氧化剂和还原剂起着至关重要的作用,它们之间的反应方程式也是化学实验中的重要内容之一。
1.2 研究意义clo3负和vo2正之间的反应方程式不仅可以帮助我们更深入地理解氧化还原反应的机理,还可以为相关领域的研究提供重要参考,促进相关知识的传播和应用。
二、实验目的2.1 探究clo3负与vo2正之间的氧化还原反应特点,分析其反应机理。
2.2 编写clo3负与vo2正反应的化学方程式。
三、实验方法3.1 设备及试剂设备:实验室玻璃仪器、反应管、试剂瓶。
试剂:clo3负溶液、vo2正溶液。
3.2 实验步骤步骤一:取适量clo3负溶液倒入反应管中。
步骤二:加入适量vo2正溶液并观察反应过程。
步骤三:记录反应现象并进行实验分析。
四、实验结果与分析4.1 实验结果在实验过程中,我们观察到clo3负溶液与vo2正溶液发生了明显的氧化还原反应,其中出现了颜色变化、气体生成等现象。
4.2 实验分析根据实验结果,我们可以推断出clo3负和vo2正之间存在氧化还原反应。
通过进一步的分析和计算,我们可以得出clo3负与vo2正之间的反应方程式为:2clo3负 + 3vo2正→ 2cl- + 3vo2+ + clo2↑。
五、实验结论经过实验观察和分析,我们得出了clo3负与vo2正之间的氧化还原反应方程式,并对实验结果进行了合理的解释。
通过本次实验,我们深入了解了氧化还原反应的特点和机理,为进一步研究和应用提供了重要参考。
六、拓展应用6.1 在环境领域的应用通过clo3负与vo2正之间的氧化还原反应,可以对水库中的有毒物质进行处理和分解,净化水质,保护环境。
6.2 在化工领域的应用clo3负与vo2正反应方程式可以应用于化工生产中的氧化反应,为相关产业的发展提供重要支持。