无机化学 氢和氢化物 PPT课件
- 格式:ppt
- 大小:1.09 MB
- 文档页数:10

第十章 氢、碱金属和碱土金属一、1、氢气的制备:实验室:Zn+2HCl=ZnCl2+H2↑军事上:CaH2 +2H2O → Ca (OH )2 + 2H2↑2、氢化物氢化物共分为离子型、共价型、过渡型离子型氢化物是极强的还原剂:TiCl4+4NaH Ti +4NaCl +2H2↑ LiH 能在乙醚中同B3+ Al3+ Ga3+ 等的无水氯化物结合成复合氢化物,如氢化铝锂的生成。
4LiH + AlCl3乙醚 Li[AlH4] + 3LiCl 氢化铝锂遇水发生猛烈反应Li[AlH4]+4H2O=LiOH↓+Al(OH)3↓+4H2↑二、 碱金属与碱土金属(铍、镁除外)元素溶于液氨,生成溶剂合电子和阳离子成具有导电性的深蓝色溶液。
碱金属 M(S) + (x+y)NH3 M+(NH3)x + e-(NH3)y碱土金属 M(S) + (x+2y)NH3 M2+(NH3)x + 2e-(NH3)2KNO3+10K=6K20+N2↑碱土金属氧化物也可以由他们的碳酸盐或硝酸盐加热分解得到。
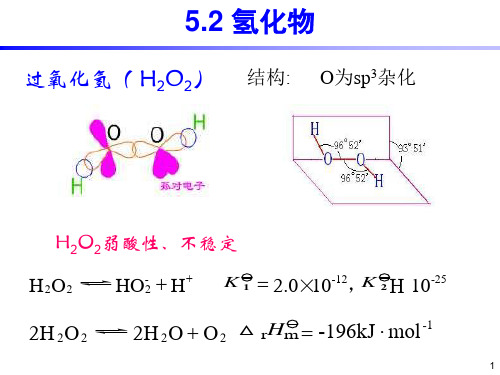
CaCO3CaO +CO2↑ 2Sr(NO3)22SrO +4NO2+O2↑过氧化物与超氧化物过氧化物是含有过氧基(—O —O —)的化合物,可看作是H2O2的衍生物。
除铍外,所有碱金属和碱土金属都能形成离子型过氧化物。
2Na +O2 Na2O2 除锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。
K +O2=KO2臭氧化物在低温下通过O3与粉末状无水碱金属(除Li 外)氢氧化物反应,并用液氨提取,即可得到红色的MO3固体:3MOH(S)+2O3(g)=2MO3(s)+MOH ·H2O(s)+1/2O2(g)三、氢氧化物碱金属和碱土金属的氧化物(除BeO 、MgO 外)与水作用,即可得到相应的氢氧化物,并伴随着释放出大量的热:M2O +H2O=2MOHMO+H2O=M(OH)2碱金属和碱土金属的氢氧化物的碱性碱金属和碱土金属氢氧化物[除Be (OH )2外]均成碱性,同族元素氢氧化物碱性均随金属金属元素原子序数的增加而增强。