中山大学无机化学精品课程第15章硼族元素
- 格式:ppt
- 大小:1.61 MB
- 文档页数:61
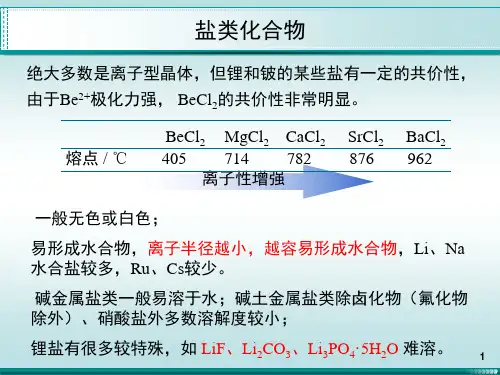

第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O ,四水硼砂(kernite ):Na 2B 4O 7·4H 2O ,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。

一硼单质及其化合物制作成员:摆宫泽贾震韦仕富(1) 硼单质硼单质可以分为晶体和无定形两大类。
晶体硼呈灰黑色,硬度极高,导电性差,但它的电导率却随着温度的升高而增大,从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反响活性较低,无定形硼相对活泼。
①硼单质的晶体构造晶体硼单质根本构造单元为正二十面体,12个硼原子占据着多面体的顶点。
α—菱形硼:B12构造单元间的硼硼化学键属于三中心二电子键。
由片层间B12构造单元按面心立方最密堆积方式形成晶体,其中所以硼原子间均形成共价键,使单质硬度大,导热能力强,导电能力弱。
β—菱形硼:构造更复杂,其中含B84构造单元。
②硼单质的化学性质1 常温下与F2化合:2B+3F2=2BF32 在空气中燃烧,放出大量热:4B+3O2=2B2O33 由于硼氢键的键能很大,所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
4 赤热下,无定形硼与水蒸气反响:2B+6H2O(g)=2B(OH)3+2H25 在高温下硼能同N2,S,*2等非金属单质反响2B+N2=2BN2B+3Cl2=2BCl22B+3S=B2S36 在高温下硼也能同金属反响生成金属硼化物,如NbB4,ZrB2,LaB6等。
硼化物一般具有高硬度高熔点。
7 无定形硼不与非氧化性酸作用,但可以与热浓H2SO4,热的HNO3反响:B+3HNO3(浓〕=B(OH)3+3NO2↑2B+3H2SO4(浓〕=2B(OH)3+3SO2↑8 有氧化剂存在时,硼和强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O③硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5•H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7•10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反响一步制得硼酸:Mg2B2O5•H2O+2H2SO4=2H3BO3+2MgSO4●(2) 硼氢化合物称为硼烷,的有:B2H6,B4H10,B5H9,B8H16,B8H18等,BnHn+4和BnHn+6共20 多种。



第讲硼族元素全解硼族元素是周期表中位于第三主族的化学元素。
该族元素的原子结构特点、物理化学性质等方面有很多值得关注的地方。
原子结构特点硼族元素的原子结构特点有以下几点:原子半径硼族元素的原子半径在同一周期中逐渐减小,在同一族中则随着核电荷数增加而逐渐减小。
电子亲和能硼族元素的电子亲和能呈右下方向递减的趋势,其中铍的电子亲和能最小,铟的电子亲和能最大。
电离能硼族元素的电离能值,随着核电荷数增加而逐渐增大,在同一周期中的电离能值逐渐增大。
值得注意的是,三价铍电离能较小,因为可能存在相对稳定的三价氧化物,使得它不容易丧失一个电子。
化合价电子数硼族元素的化合价电子数为3个,因此大多数化合物都为三配位,分子为平面三角形或三棱柱形。
值得注意的是,硼族元素同样也会形成四、五、六价化合物。
物理化学性质硼族元素的物理化学性质主要表现为以下几个方面:电子构型硼族元素的电子构型为ns2np1,其中n依次为2、3、4、5、6,p轨道只有一个未被占据,因此硼族元素属于典型的半金属元素。
化合反应•与非金属的反应:硼族元素可与氧、氮等非金属元素发生化学反应,并有产物生成。
•与金属的反应:大多数硼族元素均能够和金属反应,生成非常具有特异性的异构体。
物理性质•密度:硼族元素的密度随着原子序数的增加而逐渐增大。
•熔点:硼族元素的熔点随着原子序数的增加而先增后降。
•固定化学反应:硼族元素的固定化学反应能力很强,是化学反应中经常用到的一种试剂。
典型代表元素硼族元素中,最典型的代表元素为硼、铝、镓和铟。
硼硼的存在形式有硼酸、硼砂和硼烷等。
其烷基化合物中的双止键和三角形构型具有独特的结构。
硼制品被广泛地应用于一些领域,如玻璃、烟花、橡胶和塑料的生产等。
铝铝是第三大产量金属,铝和铝合金引人瞩目的特性是轻、硬、耐腐蚀、导电和热传导性好。
因此铝及其合金被广泛应用于汽车、航空和建筑等各个领域。
镓镓是一种蓝黑色的金属元素,也称为“未来金属”。
其压电和半导体性质被广泛地运用于电子技术领域,如生物医学、计算和通讯应用等。




第13章硼族元素硼 1. 硼与氮气:2B+N2高温2BN2. 硼与浓硫酸:2B+3H2SO4(浓) △2B(OH)3+3SO2↑3. 碘化硼分解:2BI31000K Ta2B+3I24. 乙硼烷与氧气:B2H6+3O2自然B2O3+3H2O5. LiBH4+2H2O=LiBO2+4H2↑6. 三氧化二硼与水:3B2O3+3H2O(g)=2B3O3(OH)3(g)7. 氟化硼与水:BF3+3H2O=B(OH)3+3HF氟化硼与氟化氢:BF3+HF=H[BF4]8. 硼与硫:2B+3S高温B2S39. 硼与氯气:2B+3Cl2高温2BCl310. 硼与水:2B+6H2O(g)=2B(OH)3+3H211. Na2B4O7+H2SO4+5H2O=4H3BO3+Na2SO412. 硼酸受热分解:2H3BO3△B2O3+3H2O13. 三氧化二硼与镁:B2O3+3Mg高温2B+3MgO14. 硼与浓硝酸:B+3HNO3(浓) △B(OH)3+3NO2↑15. 硼与浓硫酸:2B+3H2SO4(浓) △2B(OH)3+3SO2↑16. 硼与氢氧化钠:2B+2NaOH+3KNO熔融2NaBO2+3KNO2+H2O17. 三氯化硼与氢气:2BCl3+6H无声放电B2H6+6HCl18. 3LiAlH4+4BCl乙醚中2B2H6+3LICl+3AlCl319. 乙硼烷与氯气:B2H6(g)+6Cl2(g)=2BCl3(l)+6HCl(g)20. 乙硼烷与甲醇:B2H6+6CH3OH=2B(OCH3)3+6H221. 4NaH+B(OCH3)3=NaBH4+3NaOCH322. 三氧化二硼与水:B2O3+3H2O=2H3BO3(aq)23. 三氧化二硼与氧化铜:B2O3+CuO熔融Cu(BO2)2(蓝色)24. 三氧化二硼与氧化铁:3B2O3+Fe2O3熔融2Fe(BO2)3(黄色)25. 硼酸与水:B(OH)3+H2O=[B(OH)4]-+H+26. 硼酸与乙醇:B(OH)3+3C2H5OH浓H2SO4(C2H5O)3B+3H2O27. [B4O5(OH)4]2-+5H2O=2H3BO3+2[B(OH)4]-28. 氟化硼与氨气:BF3(g)+NH3=H3N→BF331. 三氯化硼与水:BCl3+3H2O=B(OH)3+3HCl32. 硼与氟气:2B+3F2=2BF333. 硼酸与磷酸:B(OH)3+H3PO4=BPO4+3H2O34. 偏硼酸钠与过氧化氢:NaBO2+H2O2=NaBO3·H2O35. B2O3+8CaF2+8H2SO4(浓)+3H2O=2B(OH)3+16HF+8CaSO4铝 1. 铝与氢氧化钠:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H22. 偏铝酸钠与氯化铵:NaAlO2+NH4Cl+H2O=Al(OH)3+NH3+NaCl3. Al2O3+2NaOH+3H2O加压煮沸2Na[Al(OH)4]4. 2Na[Al(OH)4]+CO2=2Al(OH)3↓+Na2CO3+H2O5. 氢氧化钠受热分解:2Al(OH)3△Al2O3+3H2O6. 电解三氧化二铝:2Al2O3通电熔融冰晶石4Al+3O2↑7. 铝与氯气:2Al+3Cl2△2AlCl38. 六水氯化铝受热分解:AlCl3·6H2O△Al(OH)2Cl+4H2O+2HCl↑9. 铝离子与氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+10. Na[Al(OH)4]+NH4Cl=Al(OH)3↓+NaCl+NH3+H2O11. 铝与三氧化二铁:2Al+Fe2O3点燃镁条2Fe+Al2O312. 铝与盐酸:2Al+6HCl(aq)=2AlCl3+3H2↑13. 铝与硫单质:2Al+3S高温Al2S314. 氯化铝与氢化锂:3nLiH+nAlCl乙醚中(AlH3)n+3nLiCl15. 氢氧化铝与氢氧化钠:Al(OH)3+NaOH(aq)=Na[Al(OH)4]镓(Ga)1.镓与稀硫酸:2Ga+3H2SO4(稀)=Ga2(SO4)3+3H2↑2.镓与浓硝酸:Ga+6HNO3(浓)=Ga(NO3)3+3NO2↑+3H2O铟(In)1.铟与稀硫酸:2In+3H2SO4(稀)=In2(SO4)3+3H2↑铊(Tl)1.氢氧化铊与氯化钠:TlOH+NaCl=TlCl+NaOH2.三氯化铊与碘化钾:TlCl3+3KI=TlI+I2+3KCl3.三氯化铊与硫化钠:2TlCl3+3Na2S=Tl2S↓+2S↓+6NaCl4.氯化铊与氯气:TlCl+Cl2=TlCl35.铊与稀硫酸:2Tl+H2SO4(稀)=Tl2SO4+H2↑6.铊与稀硝酸:Tl+2HNO3(稀)=TlNO3+NO2↑+H2O7.硫酸铊与硫酸亚铁:Tl2(SO4)3+4FeSO4=Tl2SO4+2Fe2(SO4)38.硝酸铊与二氧化硫:Tl(NO3)3+SO2+2H2O=TlNO3+H2SO4+2HNO39.铊离子与硫离子:2Tl3++3S2-=Tl2S↓+2S↓10.。