中山大学无机化学精品课程-第12章-氧族元素
- 格式:ppt
- 大小:1.75 MB
- 文档页数:78


无机化学——氧族元素无机化学,氧族元素氧族元素是周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素的电子构型都是 ns2 np4,因此它们在化学性质上有些相似。
本文将重点讨论氧族元素的性质和应用。
首先,氧族元素的化学性质主要受到它们的电子构型的影响。
由于氧族元素的 np4 外层电子非常稳定,因此它们都倾向于接受两个电子,形成-2 价的阴离子。
这使得氧族元素在化合物中通常呈现-2 价,例如氧化物(O2-)、硫化物(S2-)等。
然而,这并不意味着氧族元素只能形成-2 价,它们还可以形成其他价态,如+4、+6等。
氧族元素参与的化学反应主要包括氧化反应和还原反应。
它们在氧化反应中往往是氧化剂,能够接受电子使其他物质发生氧化。
例如,氧气(O2)是最常见的氧化剂,可以与其他物质反应生成氧化产物。
氧化剂的强弱顺序为:O2>S>Se>Te>Po。
在还原反应中,氧族元素的化合物可以接受电子,发生还原。
例如,硫酸(H2SO4)可以被还原成二氧化硫(SO2)。
氧族元素在生物和环境中起着非常重要的作用。
氧是地球上最常见的元素之一,占据大气中的21%。
它是细胞呼吸和许多生物代谢反应的关键组分,在维持生命中起着至关重要的作用。
此外,氧还参与水的形成和氧化燃烧等重要过程。
硫是地球上第10常见的元素,在自然界中以硫化物和硫酸盐的形式广泛存在。
硫化物在地下矿床中存在,如铅、锌和铜的硫化物,通过提取和加工可以得到对应的金属。
硫酸是一种重要的化学品,在工业生产中广泛应用,如肥料、造纸、皮革制品等。
硒在生物体内有重要的生理作用,是人体中一种必需的微量元素。
它参与抗氧化作用和免疫反应,对维持机体正常生理功能起着重要的作用。
然而,长期摄入过多的硒会导致中毒,因此硒的摄入量需要控制在适当的范围内。
碲是一种具有金属和非金属特性的半金属元素。
它在半导体工业中有重要应用,用于制造太阳能电池和热敏电阻等器件。
此外,碲还具有光电效应和光敏化学反应的特性,在一些领域具有潜在的应用前景。






无机化学《氧族元素》教案教学要求]1. 掌握臭氧、过氧化氢的结构和性质。
2. 掌握硫化氢的特性及硫化物的水溶性。
3. 了解掌握硫的氧化物、含氧酸及其盐的结构、一般性质及用途。
[ 教学重点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构、制备和性质[ 教学难点]1. 氧的单质及双氧水的结构、制备和性质2. 硫的单质及重要化合物的结构和性质[ 教学时数]6 学时[ 教学内容]1. 氧族元素的通性2. 氧及其化合物3. 硫及其化合物15-1 氧族元素的通性一、氧族元素的存在氧族元素有氧、硫、硒、碲和钋五种元素。
氧是地球上含量最多,分布最广的元素。
约占地壳总质量的46.6% 。
它遍及岩石层、水层和大气层。
在岩石层中,氧主要以氧化物和含氧酸盐的形式存在。
在海水中,氧占海水质量的89% 。
在大气层中,氧以单质状态存在,约占大气质量的23% 。
硫在地壳中的含量为0.045% ,是一种分布较广的元素。
它在自然界中以两种形态出现棗单质硫和化合态硫。
天然的硫化合物包括金属硫化物、硫酸盐和有机硫化合物三大类。
最重要的硫化物矿是黄铁矿FeS2,它是制造硫酸的重要原料。
其次是黄铜矿CuFeS2、方铅矿PbS 、闪锌矿ZnS 等。
硫酸盐矿以石膏CaSO 4· 2H 2 O 和Na2SO 4 · 10H 2 O 为最丰富。
有机硫化合物除了存在于煤和石油等沉积物中外,还广泛地存在于生物体的蛋白质、氨基酸中。
单质硫主要存在于火山附近。
二、氧族元素的基本性质氧族元素的一些基本性质性质氧硫硒碲原子序数原子量价电子构型常见氧化态815.992s 2 2p 4-2,-1,01632.063s 2 3p 4-2,0,+2,+4,+63478.964s24p 4-2,0,+2,+4,+652127.605s 2 5p 4-2,0,+2,+4,+6共价半径/pmM 2 - 离子半径/pm第一电离能/(kJ/mol)第一电子亲合能/(kJ/mol) 第二电子亲合能/(kJ/mol) 单键解离能/(kJ/mol)电负性(Pauling 标度) 661401314141-7801423.441041841000200-5902262.58117198941195-4201722.55137221869190-2951262.10三、氧族元素的电极电势氧的电势图:2.07 0.68 1.77φ A θ / V O 3 ——— O 2——— H 2 O 2 ——— H 2 O1.24 –0.08 0.87φ B θ / V O 3 ——— O 2 ——— HO 2 -——— OH –硫的电势图:2.05 0.20 0.40 0.50 0.14φ A θ / V S 2 O 82 -——— SO 4 2 -——— H 2 SO 3 ——— S 2 O 3 2 - ——— S ——— H 2 S-0.92 -0.58 -0.74 -0476φ B θ / V SO 4 2 - ——— SO 3 2 - ——— S 2 O 3 2 -——— S ——— S 2 -15-2 氧及其化合物一、单质氧自然界中的氧含有三种同位素,即16 O 、17 O 和18 O ,在普通氧中,16 O 的含量占99.76% ,17 O 占0.04% ,18 O 占0.2% 。

第十二章 氧族元素Chapter 12 The Oxygen Family ElementsOxygen (O) Sulfur (S) Selenium (Se) Tellurium (Te) Polonium (Po)也称为成矿元素 (ore-forming elements),because many metal ores are oxides and sulfides. Electron configuration: n s 2 n p 4§12-1 氧及其化合物 Oxygen and its Compounds一、The Simple Substance1.除了He 、Ne 、Ar 以外,氧与所有元素化合,只有与氟化合时,才呈还原性,在与化合物PtF 6反应时,也呈还原性。
2.最常见的氧化数为-2,还有+2 (OF 2),+4 [O (O 2)],+1 (O 2F 2),-1 (H 2O 2) 3.氧的单键离解能为142kJ·mol -1,而硫的单键离解能为268kJ·mol -1。
解释:(1) 氧的原子半径小,孤对电子对之间有较大的排斥作用;(2) 氧原子没有空的d 轨道,不能形成d -p π键,所以O -O 单键较弱。
对于O 2分子而言,除了σ键外,还有二个三电子π键,)(O 2D = 494 kJ·mol -1所以O 2→2O 比较困难,要求加热到2000℃ ,且要求紫外光照射。
4.氧元素在地球上的丰度最高,达58% (以mol 计),16O (993759%),17O (0.037%),18O(0.204%);14O ,15O ,19O 为人工合成的同位素,t 1/2为数十秒。
二、The Compounds :1.[-2] O.S.最重要的化合物是水。
水在任何生命体中占50~90%。
水在人体血液中占80%,在肌肉中占35%,若一个人活到 七十岁,那么他一生饮水约为25吨。

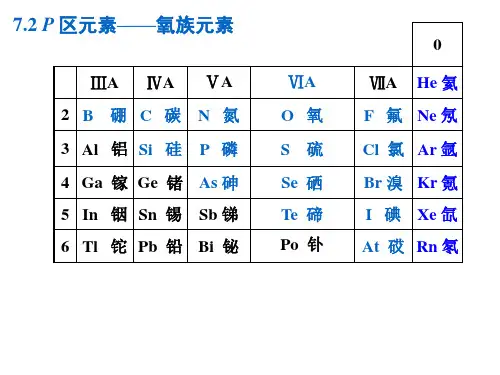
第十三章氧族元素本章摘要1. 氧氧气和氧化物臭氧过氧化氢氧元素的成键特征2. 硫和硫化物单质硫硫化氢和氢硫酸硫化物3. 硫的含氧化合物S(IV)的含氧化合物S(VI)的含氧化合物硫的其它价态含氧化合物4. 硒和碲单质氢化物氧化物与含氧§0. 概述氧族元素位于第VIA族,有氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五种元素价电子构型:ns2np4,可形成X2-氧O:存在形式O2(大气圈)、H2O (水圈)、SiO2及硅酸盐,其它含氧化合物(岩石圈)。
丰度48.6 %,居第1 位。
硫S:天然单质硫矿;硫化物矿。
方铅矿PbS,闪锌矿ZnS;硫酸盐矿:石膏CaSO4·2H2O,芒硝Na2SO4·10H2O,重晶石BaSO4,天青石SrSO4,占0.048% 居第16位硒Se:硒铅矿PbSe,硒铜矿CuSe碲Te:碲铅矿PbTe 为10–6~10–7%钋Po:放射性元素,本章不做介绍。
§1. 氧一.氧气和氧化物1 氧气的制备加热含氧化合物制氧气2BaO2→(加热)2BaO + O22NaNO3→(加热)2NaNO2 + O2最常见的是催化分解KClO3,工业上制取O2的方法是分馏液化空气。
b.p. N2 77 K , O2 90 K2 氧气的性质O2为非极性分子,常温下,无色无味无臭气体,在H2O 中溶解度很小。
mp.为90 K ,液体淡蓝色,bp.为54 K ,呈淡蓝色固体。
* 和大多数单质直接化合成氧化物2 Mg + O2——2 MgOS + O2——SO2* 和大多数非金属氢化物反应2 H2S + O2——2 S + 2 H2O2 H2S + 3O2——2 SO2 + 2 H2O4 NH3 + 3 O2——2 N2 + 6 H2O4 NH3 +5 O2——4 NO +6 H2O* 和低价氧化物反应生成高价氧化物2 CO + O2——2 CO2* 和硫化物反应2 Sb2S3 + 9 O2——2 Sb2O3 + 6 SO23 氧化物的酸碱性* 酸性氧化物包括绝大多数非金属氧化物,某些高价金属氧化物,如Mn2O7,CrO3等* 碱性氧化物多数金属氧化物属于碱性氧化物。