蔗糖是非电解质;难溶于水的盐,如BaSO4、CaCO3是电解质。 (4)溶于水能导电的化合物不一定是电解质。如CO2水溶液能导
电,但不是CO2分子本身电离产生离子,而是它与水反应生成的 H2CO3电离出自由移动的离子,所以H2CO3是电解质,CO2不是电解 质。
探究一
探究二
素养脉络
随堂检测
素能应用
知识铺垫
新知预习
自主测试
1.导电性实验证明:NaCl、NaOH、H2SO4的水溶液能够导电,蔗 糖、酒精的水溶液不导电。
2.常见的酸有HCl、H2SO4、HNO3(写化学式),常见的碱有 NaOH、KOH、Ba(OH)2和Ca(OH)2。
3.NaCl、Na2SO4等属于正盐,而NaHSO4属于酸式盐。
探究一
探究二
素养脉络
随堂检测
素能应用
典例2写出下列物质在水溶液中的电离方程式:
①Ba(OH)2: 。 ②KHSO4: 。 ③HNO3: 。 ④Na2CO3: 。 答案①Ba(OH)2=Ba2++2OH②KHSO4=++H++SO42③HNO3=H++NO3④Na2CO3=2Na++CO32-
探究一
项错误;水是电解质,B项正确;电解质导电是有条件的,电解质在水 中不一定能导电,如硫酸钡,在水中导电的化合物也不一定是电解 质,如二氧化碳,C项错误;NaNO3溶液能导电,所以NaNO3是电解 质,D项错误。
探究一
探究二
素养脉络
随堂检测
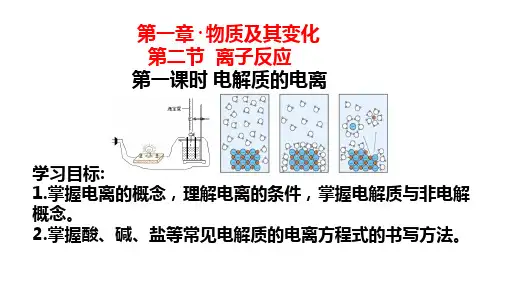
电离方程式的书写 问题探究 根据探究一中的【问题探究】可知:NaCl固体不导电,NaCl溶液 或熔融NaCl可导电,据此探究下列问题: 1.NaCl固体为电解质,但其不能导电。这是为什么? 提示NaCl固体中的阴、阳离子不能自由移动。 2.NaCl溶液可导电,将NaCl固体溶于水,发生了怎样的变化? 提示将NaCl固体溶于水,在水分子的作用下,Na+和Cl-扩散到水分 子之间,变得能自由移动。