如图所示,导线插入相同浓度的不同溶液时,灯泡的 亮度不同,为什么会出现这种现象?若将上述溶液稀 释相同倍数,亮度的变化又不同,出现这种现象又是 为什么呢?这节课我们就来学习相关内容。
1.了解弱电解质的电离平衡常数的概念和电离平衡 常数与电离程度的关系。 2.理解影响弱电解质电离平衡的因素对电离平衡移 动的影响。(重点) 3.了解常见弱酸、弱碱的电离平衡常数大小,能比 较它们的电离能力强弱。
加NaOH
增大
减小 减小 增大 减小
锌粒
增大
减小 减小 增大 减小
升温
增大
增大 增大 增大 减小
1.弱电解质的电离平衡 2.弱电解质电离程度的表示 3.影响电离平衡的因素
(1)定义
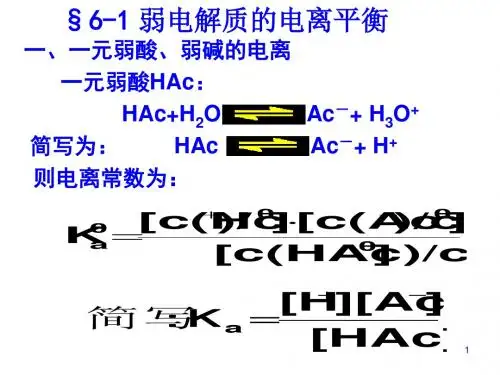
(2)特点 (1)电离度 (2)电离平衡常数
(1)温度:越高越电离
(2)浓度:越稀越电离
1.(双选)醋酸溶液加水稀释,在稀释过程中 ( BD )
阿伦尼乌斯与电离理论 阿伦尼乌斯的最大贡献是1887
年提出电离学说,它突破了当时的科 学界普遍认为离子是在电流的作用 下产生的金科玉律, 提出“电解质 在溶液中能自动电离出正、负离子 ; 溶液越稀,电离程度就越大”。
这一学说是物理化学发展初期的重大发现,对 溶液性质的解释起过重要的作用。它是物理和化学 之间的一座桥梁。
4.21×10-3
0.100 0.09866 1.34×10-3 1.34×10-3 1.82×10-5
1.34×10-2
二、弱电解质电离程度的表示
1.电离度 (1)概念:
当弱电解质在溶液中达到平衡时,溶液中已经电
离的电解质分子数占原来总分子数的百分数。 (2)适用范围:处于电离平衡状态的弱电解质。
弱电解质浓度越大,电离度越小。 电离平 衡常数的大小与溶液的浓度无关。 越稀越电离