栏 目 链 接
五、设计实验验证时注意等物质的量浓度和等pH的两种 酸的性质差异。
实验设计思路:以证明某酸(HA) 是弱酸为例
栏 目 链 接
尝试
应用 2.常温下,下列有关酸HA的叙述中,不能说明HA是弱 酸的是( ) ②测0.01 mol/L
栏 目 链 接
①取0.1 mol/L HA溶液,其溶液pH为2 NaA溶液,其溶液pH大于7 泡发光很暗 HA酸加水量多
第三章
水溶液中的离子平衡第一节
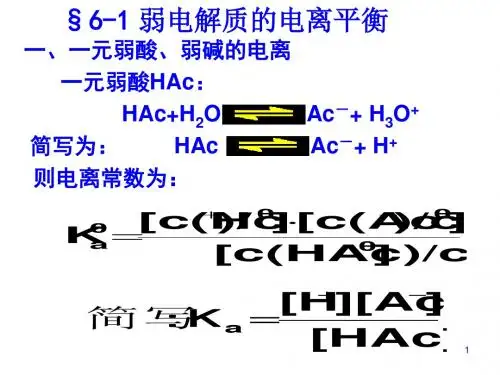
第一节 弱电解质的电离
第2课时 弱电解质的电离
栏 目 链 接
1.掌握弱电解质的电离平衡。
2.了解影响电离平衡的因素。
3.了解电离常数的意义。
栏 目 链 接
栏 目 链 接
要点一
1.概念
弱电解质的电离平衡
在一定条件(如温度、浓度一定)下,弱电解质在溶液中 电离成离子 __________的速率和 离子结合成分子 __________ 的速率相等,电离过程 就达到了平衡状态。 2.电离平衡的建立过程(用vt图象描述)
栏 目 链 接
多元弱酸各步电离常数大小的比较为K1≫K2≫K3,因此
多元弱酸的酸性主要由第一步电离所决定 (八字诀:分步进 行,一步定性)。
栏 目 链 接
四、一元强酸与一元弱酸的比较
♨ 特别提示:判断一种酸是强酸还是弱酸时,实质是 看它在水溶液中的电离程度,完全电离即为强酸,不完全电 离即为弱酸。
mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱
酸盐,所以能说明HA是弱酸,故不选;③用HA溶液做导电 性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,
栏 目 不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选; 链 ④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多, 接