热学-兰州大学物理学院
- 格式:doc
- 大小:76.00 KB
- 文档页数:11


【关键字】大学兰州大学基地班“热学”课程教学大纲一、“热学”课程的教学基本要求“普通物理学”课程是理科物理类专业的重要基础课,由力学、热学(分子物理学)、电磁学、光学和原子物理学这五个部分组成。
各个部分单独设课,“热学(分子物理学)”是其中继“力学”后的第二门课程。
“普通物理学”课程的“目的是使学生系统地了解和掌握物理学的基本概念、基本原理、基本知识、基本思想“和方法,以及它们的实验基础;了解物理学的发展方向及物理学与其它自然科学和社会科学等的关系;培养学生进一步学好物理学的兴趣,提高学生的自学能力、分析和解决问题的能力;逐步帮助学生建立科学的自然观、世界观和方法论。
”#通过“普通物理学”课程的教学,“既要帮助学生迅速掌握大学的学习特点和规律,建立正确的学习方法,努力养成刻苦踏实、勤于思考的良好学风,又要为后继课程的学习作好业务、思想和心理上的准备,还要为学生毕业后从事有关科学研究、应用开发、教学工作等打下良好的基础。
”#“在普通物理学的教学中,要重视对基本物理现象和物理实验现象的观察、描述和分析,并在此基础上建立物理模型和概念,引出物理原理和定律,引导和帮助学生实现由感性认识到理性认识的飞跃;要重视和发挥演示实验和其它现代化教学手段在普通物理学教学中的作用,提高教学效果;要重视对物理概念、规律的定性描述,在此基础上,帮助学生掌握和使用所学的数学工具来概括和表述物理规律,充分认识每个物理定律数学表达式的物理意义。
在普通物理学中,数学、特别是高等数学,一般并非主要用于演绎和推理,但也不能忽视培养学生基本运算和逻辑思维能力;要准确地阐述物理学中的重要概念,既注意每个概念确定的条件、严格的定义和确切含义,又要注意这些概念将随着人们对自然界认识的深化或客观条件的变化而不断发展、变化和完善。
在着重要求学生掌握物理学基本概念和基本规律的基础上,适当介绍这些基本概念与当代物理学前沿之间的联系,以及它们在生产技术、特别是高技术领域中的应用,注意反映现代物理学的新成果、新思想和新方法。

大学物理热学试题题库及答案一、 选择题:(每题3分)1、在一密闭容器中,储有A 、B 、C 三种理想气体,处于平衡状态.A 种气体的分子数密度为n 1,它产生的压强为p 1,B 种气体的分子数密度为2n 1,C 种气体的分子数密度为3 n 1,则混合气体的压强p 为(A) 3 p 1. (B) 4 p 1.(C) 5 p 1. (D) 6 p 1. [ ]2、若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常量,R 为普适气体常量,则该理想气体的分子数为:(A) pV / m . (B) pV / (kT ).(C) pV / (RT ). (D) pV / (mT ). [ ]3、有一截面均匀的封闭圆筒,中间被一光滑的活塞分隔成两边,如果其中的一边装有0.1 kg 某一温度的氢气,为了使活塞停留在圆筒的正中央,则另一边应装入同一温度的氧气的质量为:(A) (1/16) kg . (B) 0.8 kg .(C) 1.6 kg . (D) 3.2 kg . [ ]4、在标准状态下,任何理想气体在1 m 3中含有的分子数都等于(A) 6.02×1023. (B)6.02×1021.(C) 2.69×1025 (D)2.69×1023.(玻尔兹曼常量k =1.38×10?23 J ·K ?1 ) [ ]5、一定量某理想气体按pV 2=恒量的规律膨胀,则膨胀后理想气体的温度(A) 将升高. (B) 将降低.(C) 不变. (D)升高还是降低,不能确定. [ ]6、一个容器内贮有1摩尔氢气和1摩尔氦气,若两种气体各自对器壁产生的压强分别为p 1和p 2,则两者的大小关系是:(A) p 1> p 2. (B) p 1< p 2.(C) p 1=p 2. (D)不确定的. [ ]7、已知氢气与氧气的温度相同,请判断下列说法哪个正确?(A) 氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强.(B) 氧分子的质量比氢分子大,所以氧气的密度一定大于氢气的密度.(C) 氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大. (D) 氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大. [ ]8、已知氢气与氧气的温度相同,请判断下列说法哪个正确?(A) 氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强.(B) 氧分子的质量比氢分子大,所以氧气的密度一定大于氢气的密度.(C) 氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大.(D) 氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大. [ ]9、温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系:(A) ε和w 都相等. (B) ε相等,而w 不相等.(C) w 相等,而ε不相等. (D) ε和w 都不相等. [ ]10、1 mol 刚性双原子分子理想气体,当温度为T 时,其内能为 (A) RT 23. (B)kT 23. (C)RT 25. (D)kT 25. [ ] (式中R 为普适气体常量,k 为玻尔兹曼常量)11、两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数n ,单位体积内的气体分子的总平动动能(E K /V ),单位体积内的气体质量?,分别有如下关系:(A) n 不同,(E K /V )不同,??不同.(B) n 不同,(E K /V )不同,??相同.(C) n 相同,(E K /V )相同,??不同.(D) n 相同,(E K /V )相同,??相同. [ ]12、有容积不同的A 、B 两个容器,A 中装有单原子分子理想气体,B 中装有双原子分子理想气体,若两种气体的压强相同,那么,这两种气体的单位体积的内能(E / V )A 和(E / V )B 的关系(A) 为(E / V )A <(E / V )B .(B) 为(E / V )A >(E / V )B .(C) 为(E / V )A =(E / V )B .(D) 不能确定. [ ]13、两个相同的容器,一个盛氢气,一个盛氦气(均视为刚性分子理想气体),开始时它们的压强和温度都相等,现将6 J 热量传给氦气,使之升高到一定温度.若使氢气也升高同样温度,则应向氢气传递热量(A) 12 J . (B) 10 J(C) 6 J . (D) 5 J . [ ]14、压强为p 、体积为V 的氢气(视为刚性分子理想气体)的内能为: (A)25pV . (B) 23pV . (C) pV . (D) 21pV . [ ] 15、下列各式中哪一式表示气体分子的平均平动动能?(式中M 为气体的质量,m 为气体分子质量,N 为气体分子总数目,n 为气体分子数密度,N A 为阿伏加得罗常量)(A) pV Mm 23. (B) pV M M mol 23. (C)npV 23. (D)pV N M M A 23mol . [ ] 16、两容器内分别盛有氢气和氦气,若它们的温度和质量分别相等,则:(A) 两种气体分子的平均平动动能相等.(B) 两种气体分子的平均动能相等.(C) 两种气体分子的平均速率相等.(D) 两种气体的内能相等. [ ]17、一容器内装有N 1个单原子理想气体分子和N 2个刚性双原子理想气体分子,当该系统处在温度为T 的平衡态时,其内能为(A) (N 1+N 2) (23kT +25kT ). (B) 21(N 1+N 2) (23kT +25kT ). (C) N 123kT +N 225kT . (D) N 125kT + N 223kT . [ ] 18、设声波通过理想气体的速率正比于气体分子的热运动平均速率,则声波通过具有相同温度的氧气和氢气的速率之比22H O /v v 为(A) 1 . (B) 1/2 .(C) 1/3 . (D) 1/4 . [ ]19、设v 代表气体分子运动的平均速率,p v 代表气体分子运动的最概然速率,2/12)(v 代表气体分子运动的方均根速率.处于平衡状态下理想气体,三种速率关系为(A) p v v v ==2/12)( (B) 2/12)(v v v <=p (C) 2/12)(v v v <<p (D)2/12)(v v v >>p [ ]20、已知一定量的某种理想气体,在温度为T 1与T 2时的分子最概然速率分别为v p 1和v p 2,分子速率分布函数的最大值分别为f (v p 1)和f (v p 2).若T 1>T 2,则(A) v p 1 > v p 2, f (v p 1)> f (v p 2).(B) v p 1 > v p 2, f (v p 1)< f (v p 2).(C) v p 1 < v p 2, f (v p 1)> f (v p 2).(D) v p 1 < v p 2, f (v p 1)< f (v p 2). [ ]21、 两种不同的理想气体,若它们的最概然速率相等,则它们的(A) 平均速率相等,方均根速率相等.(B) 平均速率相等,方均根速率不相等.(C) 平均速率不相等,方均根速率相等.(D) 平均速率不相等,方均根速率不相等. [ ]22、假定氧气的热力学温度提高一倍,氧分子全部离解为氧原子,则这些氧原子的平均速率是原来氧分子平均速率的(A) 4倍. (B) 2倍.(C) 2倍. (D) 21倍. [ ]23、 麦克斯韦速率分布曲线如图所示,图中A 、B 两部分面积相等,则该图表示(A) 0v 为最概然速率.(B) 0v 为平均速率.(C) 0v 为方均根速率.(D) 速率大于和小于0v 的分子数各占一半. [ ]24、速率分布函数f (v )的物理意义为:(A) 具有速率v 的分子占总分子数的百分比.(B) 速率分布在v 附近的单位速率间隔中的分子数占总分子数的百分比.(C) 具有速率v 的分子数.(D) 速率分布在v 附近的单位速率间隔中的分子数. [ ]25、若N 表示分子总数,T 表示气体温度,m 表示气体分子的质量,那么当分子速率v 确定后,决定麦克斯韦速率分布函数f (v )的数值的因素是(A) m ,T . (B) N .(C) N ,m . (D) N ,T .(E) N ,m ,T . [ ]26、气缸内盛有一定量的氢气(可视作理想气体),当温度不变而压强增大一倍时,氢气分子的平均碰撞频率Z 和平均自由程λ的变化情况是:(A)Z 和λ都增大一倍. (B)Z 和λ都减为原来的一半. (C)Z 增大一倍而λ减为原来的一半. (D) Z 减为原来的一半而λ增大一倍. [ ]27、一定量的理想气体,在温度不变的条件下,当体积增大时,分子的平均碰撞频率Z 和平均自由程λ的变化情况是: (A) Z 减小而λ不变. (B)Z 减小而λ增大. (C) Z 增大而λ减小. (D)Z 不变而λ增大. [ ]28、一定量的理想气体,在温度不变的条件下,当压强降低时,分子的平均碰撞频率Z 和平均自由程λ的变化情况是:(A) Z 和λ都增大. (B) Z 和λ都减小.(C) Z 增大而λ减小. (D) Z 减小而λ增大. [ ]29、一定量的理想气体,在体积不变的条件下,当温度降低时,分子的平均碰撞频率Z 和平均自由程λ的变化情况是:(A) Z 减小,但λ不变. (B) Z 不变,但λ减小.(C) Z 和λ都减小. (D) Z 和λ都不变. [ ]30、 一定量的理想气体,在体积不变的条件下,当温度升高时,分子的平均碰撞频率Z 和平均自由程λ的变化情况是:(A) Z 增大,λ不变. (B) Z 不变,λ增大.(C) Z 和λ都增大. (D) Z 和λ都不变. [ ]31、 在一个体积不变的容器中,储有一定量的理想气体,温度为T 0时,气体分子的平均速率为0v ,分子平均碰撞次数为0Z ,平均自由程为0λ.当气体温度升高为4T 0时,气体分子的平均速率v ,平均碰撞频率Z 和平均自由程λ分别为:(A) v =40v ,Z =40Z ,λ=40λ.(B) v =20v ,Z =20Z ,λ=0λ.(C) v =20v ,Z =20Z ,λ=40λ.(D) v =40v ,Z =20Z ,λ=0λ. [ ]32、在一封闭容器中盛有1 mol 氦气(视作理想气体),这时分子无规则运动的平均自由程仅决定于(A) 压强p . (B) 体积V .(C) 温度T . (D) 平均碰撞频率Z . [ ]33、一定量的某种理想气体若体积保持不变,则其平均自由程λ和平均碰撞频率Z 与温度的关系是:(A) 温度升高,λ减少而Z 增大.(B) 温度升高,λ增大而Z 减少.(C) 温度升高,λ和Z 均增大.(D) 温度升高,λ保持不变而Z 增大. [ ]34、一容器贮有某种理想气体,其分子平均自由程为0λ,若气体的热力学温度降到原来的一半,但体积不变,分子作用球半径不变,则此时平均自由程为(A)02λ. (B) 0λ. (C) 2/0λ. (D) 0λ/ 2. [ ]35、图(a)、(b)、(c)各表示联接在一起的两个循环过程,其中(c)图是两个半径相等的圆构成的两个循环过程,图(a)和(b)则为半径不等的两个圆.那么:(A) 图(a)总净功为负.图(b)总净功为正.图(c)总净功为零.(B) 图(a)总净功为负.图(b)总净功为负.图(c)总净功为正.(C) 图(a)总净功为负.图(b)总净功为负.图(c)总净功为零.(D) 图(a)总净功为正.图(b)总净功为正.图(c)总净功为负.36、 关于可逆过程和不可逆过程的判断:(1) 可逆热力学过程一定是准静态过程.(2) 准静态过程一定是可逆过程.(3) 不可逆过程就是不能向相反方向进行的过程.(4) 凡有摩擦的过程,一定是不可逆过程.以上四种判断,其中正确的是(A) (1)、(2)、(3).(B) (1)、(2)、(4).(C) (2)、(4).(D) (1)、(4). [ ]37、如图所示,当气缸中的活塞迅速向外移动从而使气体膨胀时,气体所经历的过程(A) 是平衡过程,它能用p ─V 图上的一条曲线表示.(B) 不是平衡过程,但它能用p ─V 图上的一条曲线表示.(C) 不是平衡过程,它不能用p ─V 图上的一条曲线表示.(D) 是平衡过程,但它不能用p ─V 图上的一条曲线表示. [ ]38、在下列各种说法(1) 平衡过程就是无摩擦力作用的过程.(2) 平衡过程一定是可逆过程.(3) 平衡过程是无限多个连续变化的平衡态的连接.(4) 平衡过程在p -V 图上可用一连续曲线表示.中,哪些是正确的?(A) (1)、(2). (B) (3)、(4).(C) (2)、(3)、(4). (D) (1)、(2)、(3)、(4). [ ]39、设有下列过程:(1) 用活塞缓慢地压缩绝热容器中的理想气体.(设活塞与器壁无摩擦)(2) 用缓慢地旋转的叶片使绝热容器中的水温上升.(3) 一滴墨水在水杯中缓慢弥散开.(4) 一个不受空气阻力及其它摩擦力作用的单摆的摆动.其中是可逆过程的为(A) (1)、(2)、(4).(B) (1)、(2)、(3).(C) (1)、(3)、(4).(D) (1)、(4).[]40、在下列说法(1) 可逆过程一定是平衡过程.(2) 平衡过程一定是可逆的.(3) 不可逆过程一定是非平衡过程.(4) 非平衡过程一定是不可逆的.中,哪些是正确的?(A) (1)、(4).(B) (2)、(3).(C) (1)、(2)、(3)、(4).(D) (1)、(3).[]41、置于容器内的气体,如果气体内各处压强相等,或气体内各处温度相同,则这两种情况下气体的状态(A) 一定都是平衡态.(B) 不一定都是平衡态.(C) 前者一定是平衡态,后者一定不是平衡态.(D) 后者一定是平衡态,前者一定不是平衡态.[]42、气体在状态变化过程中,可以保持体积不变或保持压强不变,这两种过程(A) 一定都是平衡过程.(B) 不一定是平衡过程.(C) 前者是平衡过程,后者不是平衡过程.(D) 后者是平衡过程,前者不是平衡过程.[]43、如图所示,一定量理想气体从体积V1,膨胀到体积V2分别经历的过程是:A→B 等压过程,A→C等温过程;A→D绝热过程,其中吸热量最多的过程(A) 是A→B.(B)是A→C.(C)是A→D.(D)既是A→B也是A→C, 两过程吸热一样多。

专业姓名职称研究方向邮箱电话有机化学董恒山副教授有机合成方法学和杂环化学研究donghengshan@l袁呈山副教授天然产物研究与开发yuancs@.cn13919991637刘强副教授可见光光催化、光诱导电子转移反应以及辅酶模型化合物的新反应liuqiang@lzu.e13639368140刘雪原副教授祝英教授天然有机化学、天然药物化学zhuy@.cn13909445175金璟教授生物物理有机化学jinjing@lzu.ed13893104307许主国副教授有机材料化学xuzhg@.cn惠新平副教授不对称催化反应研究;有机合成方法学研究huixp@.cn13919460373于炜副教授有机合成方法学、绿色化学yuwei@.cn武全香副教授微生物及天然药物研究与开发wuqx@.cn13919816052戴芳副教授生物有机daifang@lzu.ed13679423578师自法副教授功能有机化学合成shizf@.cn13659470990马宝春副教授生理活性天然产物合成化学和有机合成方法学mabaochun@lzu.13919127730彭羽副教授有机合成pengyu@.cn13099218921张辅民副教授韩丙副教授自由基化学,绿色有机合成方法学hanb@.cn13008784363柳忠全副教授谢新刚讲师无机化学刘相副教授功能配合物,功能纳米材料邬金才副教授催化化学,金属有机化学,分子器件,绿色化学wujc@.cn13659484683张永平副教授张国林副教授无机化学及稀土配位化学黄勇副教授汪宝堆副教授纳米发光材料制备,纳米流体力学,纳米有机催化wangbd@.cn唐晓亮讲师分析化学何疆副教授稀土配合物的发光及分析化学、药物包合物化学、生物大分子的分析化学hejiang@lzu.ed13893468651翟红林副教授复杂体系中的多组分同时定性与定量分析、药物与蛋白质相互作用研究、药物分子设计zhaihl@.cn陈宏丽副教授分离科学理论和应用、生命分析化学、毛细管电泳及联用技术hlchen@.cn0931-8912763物理化学苏中兴教授功能材料和纳米催化剂及金属镁及镁合金冶炼中的技术和环境问题zxsu@.cn0931-8912585(O)赵继华副教授胶体化学、化学热力学及动力学方建副教授从事功能高分子材料合成以及生物热力学方向的研究徐彩玲副教授xucl@.cn王强副教授生物大分子及纳米材料器件的稳态和时间分辨光谱研究qiangwang@lzu.136-79452069高郭金山副教授高分子材料的应用gjs@13809316670分子化学与物理卞凤玲副教授高分子化学与物理方面的研究工作bianfl@.cn13893295670周林成副教授化学工艺严世强教授有机化工、化工工艺,以及与生命科学密切相关的生物化工李茸副教授工业催化剂与催化工艺研究;不对称催化反应研究胡秀琴副教授精细化工常彦龙副教授化工工艺设计;化工设备设计changyanlong@l0931-8912586化学信息学张晓昀副教授化学计量学及化学信息学新技术xyzhang@.cn0931-*******兰州大学的化学专业是比较强的,化学化工学院有无机化学、分析化学、有机化学、物理化学、高分子化学与物理、应用化学、化学工艺、化学信息学、药物化学九个专业有硕士学位授予权;其中无机化学、分析化学、有机化学、物理化学、高分子化学与物理、化学信息学、放射化学、药物化学八个专业有博士学位授予权;还有化学工程一个专业享有学位授权领域。

热力学统计物理学课程教学大纲一、课程说明(一)课程名称、所属专业、课程性质、学分;热力学统计物理【Thermodynamics and Statistical Physics】,兰州大学物理科学与技术学院物理学专业专业基础课,4学分。
(二)课程简介、目标与任务;《热力学统计物理》从宏观及微观角度理解大量粒子组成的物理系统的基本性质及其微观基础,该课程的任务是让学生掌握热力学和统计物理的基本原理和研究方法。
(三)先修课程要求,与先修课与后续相关课程之间的逻辑关系和内容衔接;先修课程要求:高等数学、普通物理(包括力学、热学、光学、电磁学及原子物理)、理论力学。
与理论力学、量子力学、电动力学共同构成物理类专业基础课。
(四)教材与主要参考书。
教材:热力学•统计物理(第五版);作者:汪志诚;高等教育出版社。
参考书目:1)王竹溪,《热力学简程》,高教出版社,19642)王竹溪,《统计物理学导论》,第二版,高教出版社,19653)龚昌德,《热力学与统计物理学》,,高教出版社,19824)苏汝铿,《热力学与统计物理基础》,,复旦大学出版社,19905)Landau L.D. and Lifshitz E.M., Statistical Physics, Pergamon Press, 1958 6)Reif F., Fundamental of Statistical and Thermal Physics, McGraw Hill Book Company, 19657)L.E.雷克著,黄昀等校译,统计物理现代教程,上册,北京大学出版社二、课程内容与安排(一)章节详细内容第一章热力学的基本规律第一节热力学系统的平衡状态及其描述;第二节热平衡定律和温度;第三节物态方程;第四节准静态过程及其功表达式;第五节内能、热量和热力学第一定律;第六节热容量和焓;第七节理想气体的内能;第八节理想气体的绝热过程;第九节理想气体的卡诺循环;第十节热力学第二定律;第十一节卡诺定律;第十二节热力学温标;第十三节克劳修斯等式和不等式;第十四节熵和热力学基本方程;第十五节理想气体的熵;第十六节热力学第二定律的普遍表述;第十七节熵增加原理的简单应用。
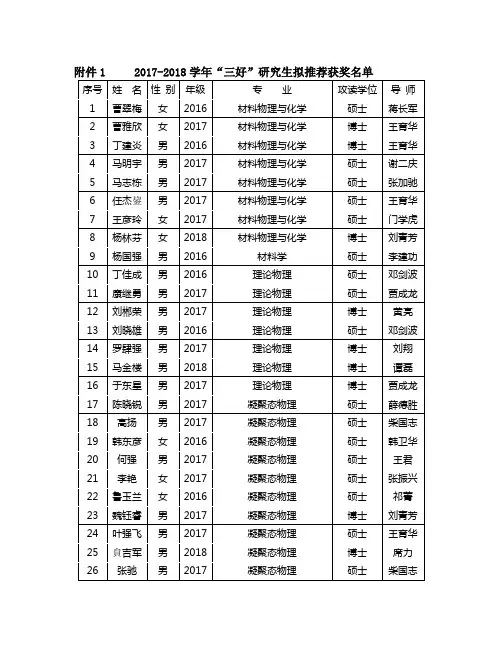


第一章 习题10.(a)等温条件下,气体对外作功为22ln 2V VVVdVW pdV RT RT V===⎰⎰ln 2Q W RT =-=- ()0U ∆=(b)等压条件下,由PV RT =,得RTP V =所以 o o o o o o RT V P V V P W ==-=)2( 当体积为2V 时 22P VPV T T R R=== 1252TP P T Q C dT C T RT ===⎰11.(1) ()521 2.110P Q C n T T cal =-=⨯⎪⎭⎫⎝⎛==25041000n (2) 51.510VU nC T cal ∆=∆=⨯ (3)4610W Q U cal =-∆=⨯ (4) 因为0W =,所以51.510Q U cal =∆=⨯12.由热力学第肯定律Q d W d dU += (1)对于准静态过程有PdV W d -=对志向气体V dU C dT =气体在过程中汲取的热量为dTC Q d n =由此()n V C C dT PdV -= (2)由志向气体物态方程RT n PV += (3) 且 P VC C n R +-= 所以 ()()n V P V dT dVC C C C T V-=- (4) 对志向气体物态方程(3)求全微分有dV dP dT V P T+= (5)(4)与(5)联立,消去dTT ,有()()0n V n P dP dVC C C C P V-+-= (6)令n Pn V C C n C C -=-,可将(6)表示为0dV dPn V P += (7)若,,n V P C C C 均为常量,将(7)式积分即得nPV C = (8)式(8)表明,过程是多方过程.14. (a) 以T,P 为电阻器的状态参量,设想过程是在大气压下进行的,假如电阻器的温度也保持为27C 不变,则电阻器的熵作为状态函数也保持不变.(b) 若电阻器被绝热壳包装起来,电流产生的焦耳热Q 将全部被电阻器汲取而使其温度由i T 升为f T ,所以有2()P f imC T T i Rt -= 2600f i Pi RtT T K mC =+= (1卡 = 4.1868焦耳)139.1ln-•===∆⎰K cal T T mC TdT mC S ifT T p p fi15.依据热力学第肯定律得输血表达式Q d W d dU += (1)在绝热过程中,有0=Q d ,并考虑到对于志向气体dT C dU v = (2)外界对气体所作的功为:pdV w d -=,则有0=+pdV dT C v (3)由物态方程nRT pV =,全微分可得nRdT Vdp pdV =+ (4)考虑到对于志向气体有)1(-=-=γv v p C C C nR ,则上式变为dTC Vdp pdV v )1(-=+γ (5)把(5)和(3)式,有0=+pdV Vdp γ (6)所以有 V p V p sγ-=⎪⎭⎫⎝⎛∂∂ (7)若m 是空气的摩尔质量,m +是空气的质量,则有V m +=ρ和m m n +=ss s VV p p ⎪⎪⎭⎫⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂ρρ ssV p m V p ⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂+2ρ (8)将式(7)代入(8)式,有+=⎪⎪⎭⎫ ⎝⎛∂∂m pV p sγρ (9) 由此可得+=⎪⎪⎭⎫ ⎝⎛∂∂=m pV p v sγρ有物态方程RT m m nRT pV +==,代入上式,得m RTmpVv γγ==+17.(1) 0C 的水与温度为100C 的恒温热源接触后水温升为100C ,这一过程是不行逆过程.为求水、热源和整个系统的熵变,可以设想一个可逆过程,通过设想的可逆过程来求不行逆过程前后的熵变。

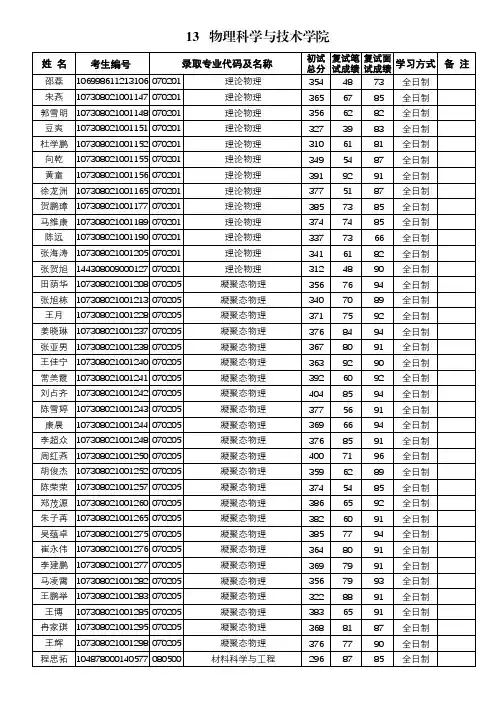
《 热力学统计物理》复习提纲21、考试时间:120分钟2、考试题型有:简答题、单项选择题、填空题、计算题、证明题、(或判断题)3、分数分布:25、20、25、18、12/124、复习思考题0、重点和难点:(六)近独立粒子的最概然分布:粒子运动状态的经典描述,量子描述,系统微观运动状态,三种分布。
(6学时)重点:三种分布。
难点:系统微观运动状态。
(七)Boltzman 统计:热力学量的统计表达式,理想气体的物态方程,Maxwell 速度分布律,能量均分定理。
(6学时)重点:热力学量的统计表达式。
难点:Maxwell 速度分布律。
(八)Bose 和Fermi 统计:热力学量的统计表达式。
(2学时)重点:热力学量的统计表达式。
(九)系综理论:相空间,Liuvil 定理,微正则分布,微正则分布的热力学公式,正则分布,正则分布的热力学公式,巨正则分布,热力学公式。
(8学时)重点:微正则、正则和巨正则分布热力学公式。
难点:相空间。
(十)涨落理论:涨落的准热力学理论。
(2学时)重点:涨落的准热力学理论。
难点:布朗运动。
一、填空题1、根据费米分布,温度为T 时处在能量为ε的一个量子态上的平均电子数为 。
2、若过程进行的每一中间态都是平衡态,则此过程称为 过程。
3、最大功定理指的是 。
4、盐的水溶液、水蒸气和冰三相平衡共存时,=ϕ ,=f ,溶液的冰点和饱和蒸气压都取决于盐的浓度x5、理想玻色气体出现凝聚的临界条件为 。
6、盐的水溶液与水蒸气平衡时,=ϕ ;=f ,水蒸气的饱和蒸气压随温度和盐的浓度而变,说明只有温度T 和浓度x 两个独立变量。
7、双原子分子能量中,如果有五个平方项,当温度为T 时,则分子数为N 的双原子分子理想气体的内能=U ;定压热容量=p C 。
9、粒子在三维空间运动,它的自由度为 ,粒子的质量为m ,粒子在任一时刻运动的动量为xm p x =,y m p y =,z m p z =,则此自由粒子的动能:=ε 。
第三章热力学本章提要1.准静态过程系统连续经过得每个中间态都无限接近平衡态得一种理想过程。
准静态过程可以用状态图上得曲线表示。
2.内能系统内所有分子热运动动能与分子之间相互作用势能得与,其数学关系式为内能就是态函数。
3.功功就是过程量。
微分形式:积分形式:4.热量两个物体之间或物体内各部分之间由于温度不同而交换得热运动能量。
热量也就是过程量。
5.热力学第一定律热力学第一定律得数学表达式:热力学第一定律得微分表达式:由热力学第一定律可知,第一类永动机就是不可能造成得。
6.理想气体得热功转换(1)等体过程:热量增量为或(2)等压过程:热量增量为因则(3)等温过程:热量增量为因则(4)绝热过程:根据热力学第一定路可得则或在绝热过程中理想气体得p、V、T三个状态参量之间满足如下关系:7.热容量等体摩尔热容量:等压摩尔热容量:对于理想气体,若分子自由度为i,则迈耶公式:比热容比:8.焓在等压过程中,由热力学第一定律可得由于,上式可写为如果令焓就是一个态函数。
9.循环过程正循环得热机效率逆循环得致冷系数10.卡诺循环由两个等温过程与两个绝热过程构成得循环。
正循环得效率逆循环得效率11.热力学第二定律开尔文表述:不可能制成一种循环动作得热机,只从单一热源吸收热量,使之全部转变为有用得功,而其她物体不发生任何变化。
克劳修斯表述:热量不可能自动地从低温物体传向高温物体,而不引起其她得变化。
统计意义:一个不受外界影响得孤立系统,其内部所发生得过程总就是由热力学概率小得宏观状态向热力学概率大得宏观状态进行,即从有序向无序得状态发展。
12.克劳修斯熵克劳修斯熵表达式熵增加原理:在孤立系统内,当热力学系统从一个平衡态到达另一个平衡态时,它得熵永远不减少。
如果过程不可逆,系统得熵增加;如果过程可逆,系统得熵不变。
13.玻耳兹曼熵玻耳兹曼熵表达式熵得微观本质:熵得多少就是系统微观状态数目多寡得标志。
思考题3-1 (1)热平衡态与热平衡有何不同?(2)热平衡与力学中得平衡有何不同?答:(1)一个孤立系统得各种宏观性质(如温度、压强、密度等)在长时间内不发生任何变化,这样得状态称为热平衡态。
兰州大学物理科学与技术学院本科生综合测评实施细则为了促进学生知识结构的完善和综合素质的提高,加强思想政治教育和管理工作,根据《兰州大学本科生综合测评试行办法》、《兰州大学本科生评优奖励办法》、《兰州大学本科生奖学金评定管理办法》,制定《兰州大学物理科学与技术学院本科生综合测评实施细则》。
一.综合测评人员的构成和职责1.由全班同学选举产生测评小组(班长、团支部书记为小组当然成员),测评小组成员经班主任同意后报年级辅导员备案。
测评小组成员必须是思想上进、责任心强、办事公道的同学,具体人数由辅导员根据班级大小决定,总人数不得少于7人,非学生干部代表比例不得低于测评小组人数的40%。
测评小组成员要本着实事求是、认真负责的态度,根据每位同学的思想道德及学习生活表现等情况,依据基本素质所包括的内容逐项打分。
测评小组组长有保留测评小组成员打分原始底单并将每位同学的测评成绩公布的义务。
2.由全班同学选举产生测评监督小组,测评监督小组成员必须由思想上进、责任心强、办事公道的非学生干部构成,总人数为3人或者5人,测评监督小组的主要职责是对测评小组的工作进行监督、接受广大同学对测评的提问并向测评小组反映,测评监督小组组长在综合测评工作结束后有向全班汇报测评过程问题处理结果的义务。
3.综合测评工作由院学工组全面负责实施,年级辅导员对本年级综合测评结果负责,综合测评小组组长对本班级综合测评结果负责。
二.综合测评的基本要素1.业务课成绩指本专业的基础课、专业课、公共课。
2.基本素质(1)思想素质(总分25分)热爱社会主义祖国,拥护共产党的领导和社会主义制度,有坚定正确的政治方向,积极参加政治理论学习。
讲文明,讲礼貌,尊敬师长,团结同学,注重个人品德修养,诚实守信,待人有礼,举止得体,乐于助人。
讲社会公德,维护公共秩序,爱护公共财物,勇于同不良行为作斗争。
能够正确认识自我,保持心理健康。
(2)创新能力(总分20分)能够理论联系实际,有较强的自学能力,综合运用知识分析问题、解决问题的能力,开拓创新能力。
电动力学课程教学大纲一、课程说明(一)课程名称、所属专业、课程性质、学分;课程名称:电动力学所属专业:理学专业课程性质:基础课学分:4(二)课程简介、目标与任务;电动力学是宏观电磁现象的经典理论,是研究电磁场的基本属性、运动规律以及它与带电物质之间相互作用的一门重要基础理论课。
电动力学是物理学科的一门重要基础理论课,是物理学的“四大力学”之一。
基本目标:1. 掌握处理电磁问题的一般理论和方法2. 学会狭义相对论的理论和方法学习目的与要求:1. 通过学习电磁运动的基本规律,加深对电磁场基本性质的理解;2. 通过学习狭义相对论理论了解相对论的时空观及有关的基本理论;3. 获得在本门课程领域内分析和处理一些基本问题的初步能力;4. 为学习后续课程和独力解决实际问题打下必要的基础。
为了达到以上目的和要求,在教材内容和课程设置中应注意以下问题:1. 由于本课程是理论物理课程的一部份,因而在要注意与研究生课程的衔接,尽量使这二者有机结合。
介绍麦克斯韦方程组的相对论形式时,本课程主要介绍物理量和方程如何从三维过渡到四维空间的表述形式。
结合科研工作,我们将从更深知识层次的广义相对论、微分几何角度来阐述狭义相对论时空观和Maxwell方程组的四维张量表述。
2. 详细阐述如何把学过的数理方程知识用于解决实际物理问题,即求解一定边界条件下静电势和磁矢势所满足的偏微分方程,达到提高学生分析和解决问题的能力。
3. 在电动力学课程中,讨论了如何从经典物理过度到相对论物理,因此,在介绍这些内容时要从相对论时空观上加以阐述,以使学生真正掌握狭义相对论的物理精髓,达到培养学生抽象思维的目的。
4. 适当介绍一些与课程相关的科研前沿知识,如A-B效应,超导体的磁通量子化,超颖材料(隐身材料),高维时空中的电磁理论(库伦定律),电磁与引力的统一(Kaluza-Klein理论),额外维与膜世界理论等以开阔学生的眼界。
(三)先修课程要求,与先修课与后续相关课程之间的逻辑关系和内容衔接;先修课程:高等数学矢量分析、数学物理方法、电磁学关系:其中高等数学矢量分析和数学物理方法是电动力学的数学基础,电磁学是电动力学的物理基础,电动力学在电磁学的基础上系统阐述电磁场的基本理论,并进一步在狭义相对论框架下讲述电磁场的四维协变规律。
热学课程教学大纲一、课程说明课程名称:热学所属专业:物理学专业本科学生课程性质:大类平台课程学分:3分主要先修课程和后续课程:(1)先修课程:高等数学,力学。
(2)后续课程:热力学与统计物理,电磁学,原子物理学,固体物理。
课程简介、目标与任务:“普通物理学”课程是理科物理类专业的重要基础课,由力学、热学电磁学、光学和原子物理学这五个部分组成。
各个部分单独设课,“热学”是其中继“力学”后的第二门课程。
“普通物理学”课程的“目的是使学生系统地了解和掌握物理学的基本概念、基本原理、基本知识、基本思想“和方法,以及它们的实验基础;了解物理学的发展方向及物理学与其它自然科学和社会科学等的关系;培养学生进一步学好物理学的兴趣,提高学生的自学能力、分析和解决问题的能力;逐步帮助学生建立科学的自然观、世界观和方法论。
”“热学”课程在物理类专业一年级第二学期开设。
通过“热学”课程的学习,使学生认识物质热运动形态的特点、规律和研究方法,深刻地理解热运动的本质,较为系统地掌握热力学、气体动理论和物性学的基础知识,能独立解决今后学习中遇到的一般热学问题,为进一步学习电磁学、原子物理学、理论物理热力学和统计物理等后续课程打下良好的基础。
教材:《热学》(第二版),李椿等编,高等教育出版社,2008主要参考书:1. 《热学》(第二版)习题分析与解答,宋峰常树人编,高等教育出版社,20102. 《热学》(第二版)常树人编,南开大学出版社,20092.《热学教程》,包科达编,科学出版社,20073. 《热学》(第二版),张玉民编,科学出版社,20064.《新概念物理教程·热学》(第二版),赵凯华等编,高等教育出版社,20055.《普通物理学教程·热学》(第二版),秦允豪编,高等教育出版社,20046. 《热学》(第二版),李洪芳编,高等教育出版社,2001二、课程内容与安排绪论(1学时)第一节热学研究的对象和方法第二节热学发展简述主要内容:热学研究的对象热现象热运动热力学统计物理学气体动理学理论物性学热学研究的方法宏观量微观量宏观量与微观量的关系热学发展简史热学常用物理量的符号热学常用物理量的单位基本物理常量基本物理常量的国际推荐值物理量的数量级物质世界的层次分子的典型数据热学课程的特点【掌握】:热学研究的对象热运动热学研究的方法宏观量微观量宏观量与微观量的关系热学课程的特点【了解】:热学发展简史热学常用物理量的符号热学常用物理量的单位物理量的数量级分子的典型数据物质世界的层次【难点】:深入理解热学是适用于宏观和微观的普适理论宏观理论和微观理论的本质关系第一章温度(5学时)第一节平衡态状态参量第二节温度第三节气体的物态方程主要内容:平衡态热动平衡对平衡态的描述力学平衡热学平衡化学平衡相变平衡状态参量几何参量力学参量化学参量电磁参量热接触热平衡热动平衡的条件热力学第零定律温度及温标建立温标的要素水的冰点水的汽点水的三相点经验温标华氏温标摄氏温标理想气体温标热力学温标国际实用温标ITS-90 温度计液体温度计定体气体温度计定压气体温度计物态方程气体物态方程玻意耳定律阿伏伽德罗定律理想气体物态方程普适气体常量阿伏伽德罗常量玻尔兹曼常量洛施密特常量道尔顿分压定律混合理想气体的物态方程分体积定律平均摩尔质量体积分数压强分数摩尔质量分数质量分数物质的量分数混合理想气体的密度非理想气体物态方程范德瓦耳斯方程范德瓦耳斯气体昂内斯方程【重点掌握】:平衡态热动平衡热动平衡的条件热力学第零定律温度及温标的概念理想气体物态方程范德瓦耳斯方程【掌握】:对平衡态的描述力学平衡热学平衡化学平衡相变平衡状态参量几何参量力学参量化学参量热接触热平衡建立温标的要素水的冰点水的汽点水的三相点经验温标理想气体温标热力学温标玻意耳定律阿伏伽德罗定律普适气体常量阿伏伽德罗常量玻尔兹曼常量洛施密特常量道尔顿分压定律混合理想气体的物态方程【了解】:国际实用温标ITS-90华氏温标摄氏温标温度计液体温度计定体气体温度计定压气体温度计各种物态方程平均摩尔质量体积分数压强分数摩尔质量分数质量分数物质的量分数混合理想气体的密度非理想气体物态方程昂内斯方程【难点】:平衡态热动平衡温度及温标概念的建立物态方程的建立第二章气体分子动理论的基本概念(6学时)第一节物质的微观模型第二节理想气体的压强第三节温度的微观解释第四节分子力第五节范德瓦耳斯气体的压强主要内容:气体动理学理论的基本论点分子论点热运动论点分子力论点统计论点布朗运动的微观解释统计规律性与涨落现象偶然性与必然性的关系统计性假设平均值加权平均统计平均理想气体的微观模型理想气体压强公式的推导气体压强的微观解释用不同的简化模型推导理想气体压强公式理想气体分子平均平动动能与热力学温度的关系温度的微观解释对理想气体定律的推证阿伏伽德罗定律道尔顿分压定律分子间力伦纳德-琼斯模型短程力分子间力势能常用分子间力势能模型微观粒子的弹性碰撞模型分子有效直径分子直径与热力学温度的关系分子间力的平衡距离分子间斥力的有效作用距离分子间引力的有效作用距离分子间力的典型数据分子体积引起的修正分子间引力所引起的修正范德瓦耳斯常量b 范德瓦耳斯常量a范德瓦耳斯气体的压强范德瓦耳斯气体的压强与理想气体的压强范德瓦耳斯方程的适用范围范德瓦耳斯气体的摩尔体积【重点掌握】:气体动理学理论的基本论点理想气体的微观模型气体压强的微观解释温度的微观解释【掌握】:理想气体压强公式的推导用不同的简化模型推导理想气体压强公式理想气体分子平均平动动能与热力学温度的关系对理想气体定律的推证常用分子间力势能模型微观粒子的弹性碰撞模型分子有效直径的概念分子体积引起的修正分子间引力所引起的修正范德瓦耳斯气体的压强【了解】:布朗运动的微观解释分子间力来源分子直径与热力学温度的关系分子间力的平衡距离分子间斥力的有效作用距离分子间引力的有效作用距离分子间力的典型数据范德瓦耳斯常量b范德瓦耳斯常量a范德瓦耳斯方程的适用范围【一般了解】:偶然性与必然性的关系统计性假设算术平均几何平均加权平均统计平均范德瓦耳斯气体的压强与理想气体的压强用迭代法计算范德瓦耳斯气体的摩尔体积【难点】:各种简化模型的建立方式物体内分子之间的相互作用和分子的热运动决定其宏观性质理想气体压强公式的推导宏观量的微观本质第三章气体分子热运动速率和能量的统计分布(11学时)第一节气体分子的速率分布率第二节用分子射线实验验证麦克斯韦速度分布律第三节玻尔兹曼分布律重力场中微粒按高度的分布第四节能量按自由度均分定理主要内容:分布函数速率分布函数速率分布函数的归一化条件麦克斯韦速率分布律麦克斯韦速率分布曲线的特征麦克斯韦速率分布律的适用范围随机事件概率概率加法定理概率乘法定理概率分布函数气体分子的最概然速率麦克斯韦速率分布函数的约化形式用麦克斯韦速率分布函数求平均值气体分子的平均速率和方均速率用麦克斯韦速率分布函数求分子数误差函数的计算气体分子速率其他特征速率麦克斯韦速度分布律麦克斯韦速度分布曲线的特征麦克斯韦速度分布函数的约化形式速度空间麦克斯韦速度分布函数与麦克斯韦速率分布函数的关系麦克斯韦速度分布函数的定义域气体分子速度分量的最概然值、平均值和方均根值分子通量公式泻流分子束泻流存在的条件麦克斯韦发射分布麦克斯韦发射分布的约化形式麦克斯韦速率分布律的实验验证密勒和库士实验葛正权实验等温大气等温气压公式气压计和高度计玻尔兹曼分布律重力场中微拉按高度的分布阿伏伽德罗常量的测定大气标高大气粒子总数大气的温度结构标准大气负绝对温度自由度分子运动的自由度分子的平动自由度分子的转动自由度分子的振动自由度刚性分子和非刚性分子的自由度线形分子和非线形分子的自由度能量均分定理理想气体的内能理想气体热容的经典理论能量均分定理的应用限度量子理论对气体热容量的解释【重点掌握】:麦克斯韦速率分布律麦克斯韦速度分布律玻尔兹曼分布律能量均分定理【掌握】:麦克斯韦速率分布曲线的特征麦克斯韦速率分布律的适用范围气体分子的最概然速率用麦克斯韦速率分布函数求平均值、气体分子的平均速率和方均速率用麦克斯韦速率分布函数求分子数麦克斯韦速度分布曲线的特征分子通量公式等温大气等温气压公式重力场中微拉按高度的分布分子运动的自由度理想气体的内能理想气体热容的经典理论【了解】:分布函数随机事件概率概率加法定理概率乘法定理气体分子特征速率的量纲分析麦克斯韦速率分布函数的约化形式麦克斯韦发射分布麦克斯韦速率分布律的实验验证密勒和库士实验葛正权实验大气标高能量均分定理的应用限度量子理论对气体热容量的解释【一般了解】:误差函数的计算麦克斯韦发射分布的约化形式阿伏伽德罗常量的测定大气粒子总数大气总质量大气的温度结构大气的均质层标准大气负绝对温度【难点】:速率分布函数及分布函数的统计意义麦克斯韦速率及速度分布律函数的统计意义及应用玻尔兹曼分布律的统计意义及应用第四章气体内的输运过程(5学时)第一节气体分子的平均自由程第二节输运过程的宏观规律第三节输运过程的微观规律主要内容:气体分子的碰撞频率气体分子的碰撞截面气体分子的平均自由程气体分子的平均相对速率与平均速率的关系分子的自由程分布函数穿过指定截面的分子的平均自由程分子穿过指定截面前最后一次受碰处至截面的平均距离黏性现象牛顿黏性定律黏度系数黏性现象的微观解释热传导现象傅里叶定律热导率热传导现象的微观解释热传导与电传导扩散现象菲克定律扩散系数扩散现象的微观解释黏度系数、热导率、扩散系数与压强的关系黏度系数、热导率、扩散系数与温度的关系黏度系数、热导率、扩散系数彼此之间的关系黏度系数、热导率、扩散系数的数量级低压下气体的黏性现象低压下气体的热传导现象容器对其内的低压气体分子的碰撞频率和平均自由程的限定估算分子有效直径的方法的比较分子热运动的典型数据【重点掌握】:气体分子的碰撞频率气体分子的碰撞截面气体分子的平均自由程黏性现象热传导现象扩散现象【掌握】:牛顿黏性定律及其微观解释傅里叶定律及其微观解释菲克定律及其微观解释低压下气体的黏性现象低压下气体的热传导现象容器对其内的低压气体分子的碰撞频率和平均自由程的限定【了解】:黏度系数、热导率、扩散系数与压强、温度的理论和实验比较黏度系数、热导率、扩散系数彼此之间的关系黏度系数、热导率、扩散系数的数量级估算分子有效直径的方法的比较分子热运动的典型数据【一般了解】:穿过指定截面的分子的平均自由程分子穿过指定截面前最后一次受碰处至截面的平均距离的概念【难点】:气体分子的碰撞频率、气体分子的碰撞截面、气体分子的平均自由程的概念的建立分子穿过指定截面前最后一次受碰处至截面的平均距离第五章热力学第一定律(10学时)第一节热力学过程第二节功第三节热量第四节热力学第一定律第五节热容焓第六节气体的内能焦耳-汤姆孙实验第七节热力学第一定律对理想气体的应用第八节循环过程和卡诺循环主要内容:热力学过程准静态过程非静态过程作功体积功作功的计算过程曲线示功图广义坐标广义位移广义力广义功绝热过程绝热功内能热量传热传热的计算热容量比热容摩尔热容焓作功与传热都是过程量作功与传热的等当性热力学第一定律能量守恒定律第一类永动机符号规定焦耳实验绝热自由膨胀过程等内能过程理想气体的内能焦耳-汤姆孙实验绝热节流膨胀过程等焓过程焦耳-汤姆孙效应焦耳-汤姆孙系数理想气体的焓反转温度理想气体的宏观定义迈耶关系热功当量的测定热力学第一定律对理想气体的应用等体过程等压过程等温过程绝热过程多方过程等热容过程直线过程理想气体绝热过程方程泊松公式循环热机的工作原理正循环的效率制冷机与热泵的工作原理逆循环的制冷系数符号规定卡诺热机卡诺循环理想气体卡诺循环的效率理想气体逆向卡诺循环的制冷系数奥托循环狄塞尔循环斯特林循环回热式循环热机与热泵的组合应用【重点掌握】:热力学过程准静态过程作功体积功作功的计算绝热功内能热量热容量比热容摩尔热容焓理想气体的宏观定义迈耶关系热力学第一定律对理想气体的应用循环热机的工作原理正循环的效率逆循环的制冷系数【掌握】:理想气体的内能理想气体绝热过程方程泊松公式【难点】:绝热过程多方过程第六章热力学第二定律(6学时)第一节热力学第二定律第二节热现象过程的不可逆性第三节热力学第二定律的统计意义第四节卡诺定理第五节热力学温标第六节应用卡诺定理的例子主要内容:热力学第二定律开尔文表述克劳修斯表述第二类永动机热力学第二定律的适用范围热力学第二定律两种表述的等效性可逆过程不可逆过程各种不可逆过程互相关联热力学第二定律的实质论证过程的不可逆性的方法不可逆过程的特点孤立系统宏观状态和微观状态气体自由膨胀的不可逆性热力学第二定律的统计意义卡诺定理可逆卡诺循环的效率不可逆卡诺循环的效率对于制冷机类似卡诺定理的结论卡诺定理的推广任意正循环的效率卡诺定理的应用热力学温标的引入热力学温标与理想气体温标和摄氏温标的关系内能随体积的改变与物态方程的关系定压摩尔热容与定体摩尔热容的关系【重点掌握】:热力学第二定律开尔文表述克劳修斯表述热力学第二定律两种表述的等效性可逆过程不可逆过程热力学第二定律的实质卡诺定理【掌握】:孤立系统宏观状态和微观状态气体自由膨胀的不可逆性热力学第二定律的统计意义【难点】:论证过程的不可逆性的方法不可逆过程的特点第七章固体(1学时)第一节晶体第二节晶体中粒子的结合力和结合能第三节晶体中粒子的热运动主要内容:物质的聚集态凝聚体固体液体气体晶体与非晶体单晶体和多晶体长程有序晶体中粒子的结合力晶体弹性的微观解释晶体中粒子的热运动热振动杜隆-珀蒂定律晶体热膨胀的微观解释晶体线膨胀率的计算非晶态固体过冷液体短程有序【重点掌握】:晶体中粒子的热运动热振动杜隆-珀蒂定律【掌握】:晶体与非晶体单晶体和多晶体晶体中粒子的结合力晶体弹性的微观解释晶体热膨胀的微观解释第八章液体(4学时)第一节液体的微观结构液晶第二节液体的彻体性质第三节液体的表面性质主要内容:液体与晶体和气体的比较液体的宏观特征液体的微观结构定居时间液体各向同性液晶外界因素对液晶的影响显示技术液体的表面性质表面张力表面层表面张力的微观解释表面张力系数影响表面张力系数的因素表面活性物质球形液面下的附加压强拉普拉斯公式柱形液面下的附加压强马鞍形液面下的附加压强接触角润湿和不润湿附着层附着力和内聚力润湿和不润湿的微观解释毛细现象毛细管【重点掌握】:液体的表面性质表面张力表面层表面张力的微观解释表面张力系数球形液面下的附加压强接触角毛细现象【掌握】:润湿和不润湿附着层附着力和内聚力润湿和不润湿的微观解释第九章相变(5学时)第一节单元系一级相变的普遍特征第二节气液相变第三节克拉珀龙方程第五节范德瓦耳斯等温线对比物态方程第六节固液相变第七节固气相变三相图主要内容:元单元系二元系多元系相相变一级相变单元系一级相变相变中体积的改变相变潜热内潜热和外潜热汽化蒸发气液等温相变饱和蒸气与液体平衡汽化曲线相平衡曲线饱和蒸气压影响饱和蒸气压的因素饱和蒸气压与液面曲率的关系凝结过冷蒸气亚稳态凝结核云雾的形成云室沸腾沸腾的条件过热液体亚稳态汽化核泡室暴沸临界等温线临界点临界态临界参量临界温度临界压强临界摩尔体积克劳修斯—克拉珀龙方程沸点与压强的关系正常沸点高压锅蒸气压方程由蒸气压方程求潜热沸点与海拔高度的关系兰州市区水的沸点熔点与压强的关系正常熔点范德瓦耳斯等温线亚稳平衡范德瓦耳斯气体的临界参量临界系数由临界参量确定范德瓦耳斯常量对应态对应态定律熔化凝固熔化曲线凝固时体积的改变升华凝华升华曲线升华与蒸发升华热与汽化热和熔化热的关系三相点相图三相图【重点掌握】:单元系一级相变相变中体积的改变相变潜热克劳修斯—克拉珀龙方程【掌握】:气液等温相变饱和蒸气与液体平衡汽化曲线相平衡曲线【难点】:临界等温线临界点临界态临界参量范德瓦耳斯等温线亚稳平衡制定人:蔡让岐毛延哲审定人:批准人:日期:。