一氯取代物种类复习课程
- 格式:ppt
- 大小:234.00 KB
- 文档页数:17


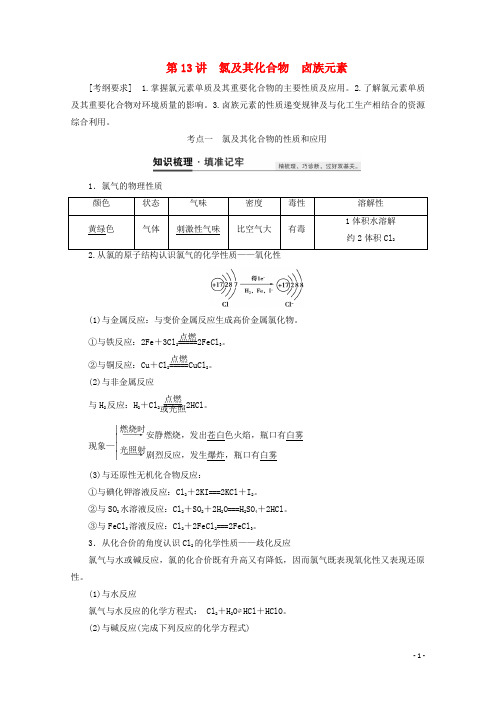
第13讲 氯及其化合物 卤族元素[考纲要求] 1.掌握氯元素单质及其重要化合物的主要性质及应用。
2.了解氯元素单质及其重要化合物对环境质量的影响。
3.卤族元素的性质递变规律及与化工生产相结合的资源综合利用。
考点一 氯及其化合物的性质和应用1.氯气的物理性质 颜色 状态 气味 密度 毒性 溶解性 黄绿色气体刺激性气味比空气大有毒1体积水溶解 约2体积Cl 2(1)与金属反应:与变价金属反应生成高价金属氯化物。
①与铁反应:2Fe +3Cl 2=====点燃2FeCl 3。
②与铜反应:Cu +Cl 2=====点燃CuCl 2。
(2)与非金属反应与H 2反应:H 2+Cl 2=====点燃或光照2HCl 。
现象—⎪⎪⎪⎪――→燃烧时安静燃烧,发出苍白色火焰,瓶口有白雾――→光照射剧烈反应,发生爆炸,瓶口有白雾(3)与还原性无机化合物反应:①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。
②与SO 2水溶液反应:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
③与FeCl 2溶液反应:Cl 2+2FeCl 2===2FeCl 3。
3.从化合价的角度认识Cl 2的化学性质——歧化反应氯气与水或碱反应,氯的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
(1)与水反应氯气与水反应的化学方程式: Cl 2+H 2O ⇌HCl +HClO 。
(2)与碱反应(完成下列反应的化学方程式)①与烧碱反应:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
②制取漂白粉:2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 。
漂白粉的主要成分是Ca(ClO)2、CaCl 2,有效成分是Ca(ClO)2。
4.次氯酸(1)不稳定性:2HClO =====光或加热2HCl +O 2↑。
氯水须现用现配,保存在棕色瓶中,置于冷暗处。
(2)强氧化性①能将有色物质氧化为无色物质,有漂白性。
