第四章 物质结构简介详解
- 格式:ppt
- 大小:9.07 MB
- 文档页数:5

物质结构概要
物质结构概要
近代以来的物理学研究发现,物质是由不同层次的微粒构成的,形成了一个阶梯系列。
二三百年前,人们发现物质由分子及原子组成。
到19世纪末,在科学实验基础上,科学家认识到原子由原子核和核外电子构成。
原子很小,直径约亿分之一厘米。
原子核大约是原子的10万分之一,电子则更小,大约是原子的亿分之一。
再进一步,人们发现原子核又是由质子和中子组成的。
到此,曾有人以为找到了构成物质的最小“砖块”。
然而,不久人们就发现了这种认识的局限性。
通过对宇宙射线的观察分析和高能加速器的实验,又发现了比上述微粒更小、更基本的大批新粒子,如介子、中微子、反粒子以及组成质子、中子的夸克等,达到几百种之多。
其中,大部分在自然界中并不存在,而是在高能束流的轰击下才产生出来的。
中子结构示意图。
从中可见到中子内部有三个夸克。
微观粒子之间存在不同的相互作用。
根据这些相互作用力的特点,可把几百种粒子分为强子、轻子和传播子三类。
强子是指参与强相互作用的那些粒子,包括质子。
中子、π介子等。
强子有其内部结构,由夸克组成。
夸克有上、下、奇、粲、底、顶6类,每类有3种,共18种。
2019年,科学家用高能物理实验证实了顶夸克存在的预言,这是近年来关于物质结构研究的一项重大进展。
轻子与强作用无关,只参与弱力、电磁力和引力相互作用,如
取得了“精确测量τ轻子质量”这一高水平理论研究成果,而且,在对撞机的研制过程中,还带动了一大批高技术的发展。

化学知识点总结物质结构一、物质结构的概念物质结构是指构成物质的基本单位以及它们之间的排列方式。
物质结构的研究是化学领域的重要内容,它对于解决物质的性质和变化规律有着重要的意义。
根据物质的构成和排列方式的不同,可以将物质结构划分为原子结构、分子结构和晶体结构等几个方面。
二、原子结构1. 原子的组成原子是物质的基本单位,由质子、中子和电子组成。
质子和中子构成了原子的核,而电子则绕核轨道运动。
2. 原子的排列方式原子的排列方式决定了物质的性质,不同元素的原子排列方式也是不同的。
例如,金属元素的原子一般是紧密排列的,而非金属元素的原子一般是松散排列的。
3. 原子结构的研究方法X射线衍射、高分辨透射电子显微镜等是研究原子结构的常用方法,通过这些方法可以观察到原子的排列方式和结构特征。
三、分子结构1. 分子的组成分子是由两个或者多个原子通过共价键连接而成的物质单位。
分子的组成决定了物质的种类和性质。
2. 分子的排列方式分子的排列方式会影响物质的性质,例如固体、液体和气体等状态的物质,分子的排列方式不同,性质也会有所区别。
3. 分子结构的研究方法红外光谱、核磁共振等是研究分子结构的常用方法,通过这些方法可以了解到分子的组成和排列方式。
四、晶体结构1. 晶体的组成晶体是由高度有序排列的原子、分子或者离子构成的固体物质。
晶体的组成决定了晶体的性质和外观。
2. 晶体的排列方式晶体的排列方式有规则的、有序的排列,而无晶体则是无规则的排列。
晶体的排列方式对其性质有着重要的影响。
3. 晶体结构的研究方法X射线衍射、电子显微镜等是研究晶体结构的常用方法,通过这些方法可以观察到晶体的结构和特征。
五、物质结构的应用1. 新材料的研发对物质结构的深入研究可以为新材料的研发提供重要的参考。
例如,了解材料的原子、分子或者晶体结构可以为新材料的设计和合成提供理论依据。
2. 化学反应的控制了解物质的结构可以为化学反应的控制提供帮助,可以通过调节物质的结构来控制化学反应的进行方向和速率。



物质的结构和性质知识点总结物质的结构和性质是化学学科中的重要内容,对于理解化学反应、物质的特性以及各种现象都有着关键的作用。
以下将对这方面的知识点进行详细的总结。
一、原子结构1、原子的组成原子由原子核和核外电子组成。
原子核又由质子和中子构成。
质子带正电荷,中子不带电,电子带负电荷。
原子中质子数等于电子数,因此原子整体呈电中性。
2、质子数和原子序数质子数决定了元素的种类,也称为原子序数。
不同元素的原子具有不同的质子数。
3、质量数质量数等于质子数与中子数之和。
通过质量数和质子数可以计算出中子数。
4、核外电子的排布核外电子按照一定的规律分层排布。
遵循能量最低原理、泡利不相容原理和洪特规则。
第一层最多容纳 2 个电子,第二层最多容纳 8 个电子,依次类推。
二、元素周期表1、周期周期是指具有相同电子层数的元素按照原子序数递增的顺序排列的横行。
周期数等于电子层数。
2、族族是指具有相似化学性质的元素按照纵行排列。
主族元素的族序数等于最外层电子数。
3、元素周期表的分区根据元素的电子构型和性质,周期表可以分为 s 区、p 区、d 区和 f 区。
4、元素周期律随着原子序数的递增,元素的性质呈现周期性的变化,包括原子半径、化合价、金属性和非金属性等。
三、化学键1、离子键离子键是由阴阳离子之间通过静电作用形成的化学键。
通常在活泼金属与活泼非金属之间形成。
2、共价键共价键是原子之间通过共用电子对形成的化学键。
分为极性共价键和非极性共价键。
3、金属键金属键存在于金属晶体中,是由金属阳离子和自由电子之间的强烈相互作用形成。
四、分子结构1、共价键的参数包括键长、键能和键角。
键长越短,键能越大,化学键越稳定。
键角决定了分子的空间构型。
2、分子的极性分子的极性取决于分子的空间构型和键的极性。
如果分子的正电荷中心和负电荷中心重合,则为非极性分子,否则为极性分子。
3、杂化轨道理论用于解释分子的空间构型。
常见的杂化类型有 sp、sp²、sp³等。

物质结构的概念初中物理物质结构是指物质构成的基本单位和它们之间的排列方式。
在初中物理中,我们主要学习了物质的三种状态:固体、液体和气体。
物质结构对于物质的性质、行为以及与其他物质的相互作用都具有重要影响。
首先,我们来了解一下固体的物质结构。
固体是由密集排列的分子、原子或离子组成的物质。
在固体中,分子、原子或离子之间存在着强烈的相互作用力,使得它们呈紧密有序的排列状态。
这种排列使得固体拥有一定的形状和体积,并且具有固定的熔点和沸点。
一般来说,固体的分子、原子或离子间距离较短,分子、原子或离子的振动范围也较小。
液体的物质结构与固体有所不同。
液体是由分子或原子组成的物质,分子或原子之间的相互作用力比较弱,但仍存在。
液体的分子或原子之间距离较固体大,而且分子或原子之间的位置是不断变化的。
这种无规则、无序的运动使得液体没有固定的形状,但有一定的体积。
液体的熔点和沸点通常比固体低,而且液体可以通过改变温度或压力来改变体积。
最后,我们来讨论气体的物质结构。
气体是由分子组成的物质,分子之间的相互作用力非常弱,几乎可以忽略不计。
气体的分子之间距离较大,它们在空间中自由运动,并且具有高度的无序性。
这种无序的运动使得气体没有固定的形状和体积,可以充满容器的所有空间。
气体的熔点和沸点通常较低,且易受温度和压力的影响。
除了以上三种状态的物质结构外,我们还需要了解一些其他的物质结构,比如离子晶体和分子晶体等。
离子晶体是由正负离子通过离子键结合而成,具有固定的几何结构和高熔点。
分子晶体是由分子通过弱的分子间相互作用力结合而成,具有相对较低的熔点。
总之,物质结构是指物质构成的基本单位和它们之间的排列方式。
不同的物质结构决定了物质的性质、行为以及与其他物质的相互作用。
通过对物质结构的研究,我们可以更好地理解物质的本质和特性,并且可以应用这些知识来解决实际问题。
在初中物理学习中,我们通常通过实验、观察和推理等方式来了解物质结构的概念和特点,从而进一步学习和探索更深层次的物质结构原理。

物质结构知识点精讲在我们生活的这个世界中,物质无处不在。
从我们呼吸的空气,到脚下坚实的大地,从璀璨的宝石到日常使用的各种材料,无一不是由物质构成。
而要深入理解这些物质的性质和行为,就需要探究它们的结构。
物质结构是化学学科中的一个重要领域,它为我们揭示了物质世界的奥秘。
首先,让我们来谈谈原子结构。
原子是构成物质的基本单位,就像乐高积木中的最小块,可以组合成各种各样的东西。
原子由原子核和核外电子组成。
原子核位于原子的中心,包含质子和中子。
质子带正电荷,中子不带电。
而核外电子则围绕着原子核高速运动,它们带负电荷。
质子的数量决定了原子的种类,我们称之为原子序数。
比如,氢原子有 1 个质子,氧原子有 8 个质子。
电子的数量和质子相等时,原子呈电中性。
但在某些情况下,原子会失去或得到电子,从而形成带电荷的离子。
电子在原子核外不是随意分布的,而是按照一定的规律分层排布。
这就好像是一栋多层的大楼,每一层能容纳的人数是有限的。
第一层最多容纳 2 个电子,第二层最多容纳 8 个,第三层最多 18 个,依次类推。
这种分层排布决定了原子的化学性质。
接下来,我们说一说化学键。
当原子们相互结合形成分子或化合物时,它们之间会通过化学键相连。
化学键主要有三种类型:离子键、共价键和金属键。
离子键通常在金属元素和非金属元素之间形成。
比如氯化钠(NaCl),钠原子容易失去一个电子变成带正电的钠离子,氯原子容易得到一个电子变成带负电的氯离子。
钠离子和氯离子通过静电作用相互吸引,形成离子键。
共价键则是由原子之间共用电子对形成的。
比如氢气(H₂),两个氢原子都需要 1 个电子才能达到稳定结构,它们就共用一对电子,形成共价键。
共价键又分为极性共价键和非极性共价键。
在极性共价键中,电子对会偏向电负性较大的原子;而在非极性共价键中,电子对在两个原子间均匀分布。
金属键存在于金属单质中。
金属原子的外层电子可以在整个金属晶体中自由移动,形成所谓的“电子气”,将金属原子紧密地结合在一起。

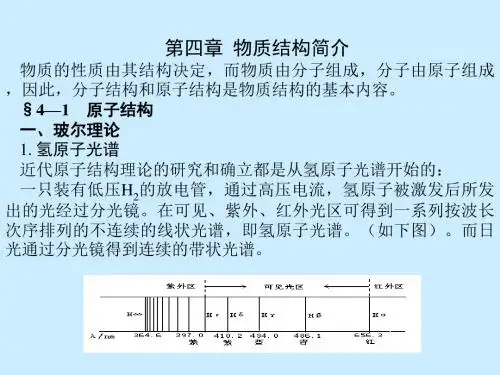
第四章物质结构元素周期律第一节原子结构与元素周期表本章内容是继氧化还原反应和离子反应之后又一个化学的理论知识点,通过本章的学习可以体会化学也是有规律可循的,本节内容是本章的基础,也是整个周期表周期律的基础,这一节学不好,就很难体会化学上结构决定性质的奥秘,也就很难体会化学的规律性,本节内容共有13个重点内容,静下心来慢慢体会吧!一、核外电子排布的表示方法(1)原子结构示意图①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
(2)离子结构示意图①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与少一个电子层的稀有气体元素原子相同的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成与电子层数相同的稀有气体元素原子相同的电子层结构。
(2020·上海市奉贤区奉城高级中学高一期末)有四种微粒的结构示意图,下列叙述中错误的是()它们属于不同种元素它们的核外电子排布相同它们都是离子它们都具有稀有气体原子的稳定结构【答案】C【分析】根据结构示意图分析可得,四种微粒分别为O2-、Ne、Mg2+和Al3+。
【详解】由分析可知,它们属于不同元素,故A不选;根据结构示意图,它们的核外电子排布相同,故B不选;由分析可知,第二种微粒不是离子,是氖原子,故C选;稀有气体原子最外层有8个电子(氦有2个),是稳定结构,第二种微粒就是Ne,其他几种微粒都和Ne的原子结构相同,故D不选;故选C。
二、明确符号A Z X±c n±m中各个字母的含义并了解它们之间的关系(1)质量数(A)=质子数(Z)+中子数(N),质量数可近似地代替原子的相对原子质量。
(2)原子的核外电子总数=质子数=核电荷数=原子序数。
(3)阳离子M n+的核外电子数=质子数-n;阴离子N n-的核外电子数=质子数+n。
(2020·福建南安市·高一期中)科学研究表明,月球上有丰富的He资源,可开发利用作未来的新型能源。

第四章生物大分子一、糖类的组成和分类2、用途:供能:C6H12O6 + 6O2→6CO2+6H2O+2804kJ/mol(二)组成结构1、组成元素: C 、 H 、 O2、结构特点:多个羟基、醛基、羰基。
碳水化合物:糖类大多数符合通式C n(H2O)m。
注:(1)符合通式C n(H2O)m的物质不一定都是糖类,如甲醛(CH2O)、乙酸(C2H4O2)等;有些糖的组成并不符合C n(H2O)m,如脱氧核糖(分子式:C5H10O4)(2)①有甜味的物质不一定是糖,如甘油、木糖醇等;②没有甜味的物质也可能是糖,如淀粉、纤维素等。
因此,糖类物质不等于碳水化合物,也不等于甜味物质。
(三)定义:多羟基醛、多羟基酮和他们的脱水缩合物(四)分类:1、根据能否水解以及水解后的的产物划分(1)单糖:不能水解的糖。
例:葡萄糖、果糖、核糖、脱氧核糖(2)寡糖或低聚糖: 1mol糖水解后能产生2-10mol 单糖。
例:二糖包括:麦芽糖、蔗糖、乳糖(3)多糖: 1mol糖水解后能产生10mol以上单糖。
例:淀粉、纤维素、糖原2、根据能否发生银镜反应划分(1)还原性糖:能发生银镜 反应的糖,如葡萄糖、果糖、麦芽糖 (2)非还原性糖:不能发生 银镜反应的糖,如蔗糖、淀粉、纤维素 二、单糖 (一)葡萄糖1、物理性质:易 溶于水的 无 色晶体,熔点为146℃,有 甜 味,但甜度不如蔗糖。
2、组成和结构:分子式:C 6H 12O 6 结构简式:CH 2OH-(CHOH)4-CHO 多羟基醛(5 个羟基、1 个醛基)3、化学性质: 还原 性糖(1)醛基:①与银氨溶液反应,有 银镜 产生;和新制Cu(OH)2反应产生 砖红 色沉淀②与H 2加成(2)多个羟基:①与新制的Cu(OH)2反应:生成 绛蓝 色溶液(可用于检验多个羟基)②酯化反应 ③与活泼金属反应(3)氧化反应:①人体内−−−→−酶的催化发生氧化反应→热量→能量:C 6H 12O 6 +6O 2−→−酶6CO 2+6H 2O ; ②被酸性 高锰酸钾 氧化 葡萄O 糖(4)分解反应:C 6H 12O 6−−→−酒化酶 2C 2H 5OH+2CO 2↑4、用途:制 镜 业、糖果制造业;低血糖患者可利用静脉注射葡萄糖 溶液的方式来迅速补充营养 (二)果糖:1、物理性质:纯净的果糖为无 色晶体,易 溶于水,吸湿性强。

物质结构知识点归纳物质是宇宙中最基本的构成单元,它以种种形式表现出来,包括从最小的量子粒子到最大的星系。
物质结构研究不仅关乎着基础科学的探索,也溶入到了物理、化学、生物等多个学科领域中。
在生活和工作中,我们也经常会接触到和使用到各种各样的物质。
因此,对于物质结构的知识点的掌握是非常有必要的。
一、物质的组成物质由原子、离子或者分子等基本单位组成。
原子是物质的基本单位,它包括了原子核和电子。
原子核由质子和中子构成,质子带正电,中子不带电;电子带负电,质量非常小。
离子是由一个或一组原子(分子)失去或者获得一个或多个电子而形成的。
分子是由两个或更多原子共用电子而形成的电中性粒子。
二、物质的状态与相变物质存在三种基本的状态:固体、液体和气体。
随着温度和压力的变化,物质之间还可以发生相变。
例如,水的三种状态之间可以互相转化。
当水温度降到0℃以下时,水会从液态变为固态,这就是冰的形成过程;当水温度升高到100℃以下时,水会从液态变为气态,这就是水的汽化过程。
相变是物质结构中非常重要的一部分。
三、物质的周期性表现元素周期表是物质结构领域最重要的成果之一,是了解元素的性质和组成的基础。
元素周期表按照元素的原子序数、电子排布和化学性质等方面的特征进行排列,提供了元素性质及其用途的重要信息。
四、物质的晶体结构晶体是指具有一定的内部规则和对称性的固体物质。
最小的晶体单位叫做晶胞,它是由离子、原子或分子等基本单位组成的。
晶格是晶体分子在三维空间内排布的基本单位,它包括一系列节点和网格线。
通过学习晶体结构,我们能够深入了解晶体物质的特性,并且可以应用晶体结构设计新型的物质。
五、物质的化学键化学键是描述分子间化学结合情况的重要概念,它与物质的物理性质、化学性质有密切关系。
共价键是原子共用电子对形成的键,主要存在于分子内部;离子键是由带正电的离子和带负电的离子之间的相互吸引力形成的键;金属键是由金属原子之间电子互相贡献形成的键。
初中化学知识点解析物质结构在初中化学学习中,物质结构是一个重要的知识点。
了解物质的结构可以帮助我们更好地理解它们的性质和行为。
下面,我们将解析一些常见的物质结构知识点。
1. 原子结构:物质的结构起源于它的基本单位——原子。
原子由中心的原子核和外部的电子云组成。
原子核由质子和中子组成,质子带有正电荷,中子不带电。
电子带有负电荷,在外部电子云中运动。
2. 元素周期表:元素周期表是所有已知元素的有序排列。
元素按照原子序数的大小进行排列,并且按照相似的化学性质进行分组。
周期表可以帮助我们了解元素的原子结构以及它们的周期性性质。
3. 分子结构:分子是由两个或更多的原子通过共价键连接在一起的化合物的最小单位。
共价键的形成是通过电子的共享来完成的。
分子的结构对化合物的性质和行为有着重要影响。
4. 离子结构:离子是带电的原子或分子。
当原子失去或获得电子时,会形成带电的离子。
离子根据电荷的正负可以分为阳离子和阴离子。
离子之间通过电荷的吸引力相互结合,形成离子晶体。
5. 金属结构:金属是由金属原子通过金属键连接在一起的物质。
金属原子由正离子和自由流动的电子组成。
金属结构中的正离子排列成紧密的球形结构,而自由电子在正离子之间自由流动。
6. 离子晶体结构:离子晶体是由离子通过电荷的吸引力形成的化合物。
离子晶体的结构是由正负离子相互排列形成的。
正离子和阴离子按照比例排列,形成具有规则结构和平衡电荷的晶体。
7. 水的结构:水是一个特殊的分子,由两个氢原子和一个氧原子通过共价键连接在一起。
水分子呈现出一个带有部分正电荷的氧原子和带有部。