无机化学:chapter 4 物质结构
- 格式:ppt
- 大小:6.26 MB
- 文档页数:172
第4章习题1 根据半径比规则预测下列晶体的结构:LiF NaBr KCl CsI MgO AlN PbO 2 BaCl 2 SiO 2解:注:(1) 离子半径值为Pauling 数据;(2) KCl 的理论构型为CsCl 型,而实验结果为NaCl 型。
2 下列各对离子晶体哪些是同晶型的(晶体结构相同)?并提出理由。
(1) ScF 3和LaF 3; (2) ScF 3和LuF 3;(3) YCl 3和YbCl 3; (4) LaF 3和LaI 3;(5) PmCl 3和PmBr 3。
答:(1) ScF 3:r +/r —=81/136=0.596 NaCl 型,LaF 3:r +/r —=106/136=0.779 CsCl 型(2) ScF 3:NaCl 型 LuF 3:r +/ r —=85/136=0.625 NaCl 型(3) YCl 3:r +/ r —=93/181=0.514 NaCl 型,YbCl 3:r +/ r —=86/181=0.475 NaCl 型(4) LaF 3:CsCl 型 LaI 3:r +/ r —=106/216=0.491 NaCl 型(5) PmCl 3:r +/ r —=98/181=0.541 NaCl 型 PmBr 3:r +/ r —=98/195=0.503 NaCl 型 所以,第(2)、(3)和(5)组同晶型,均具有NaCl 型结构。
3 计算负离子作三角形排布时r +/r -的极限比值。
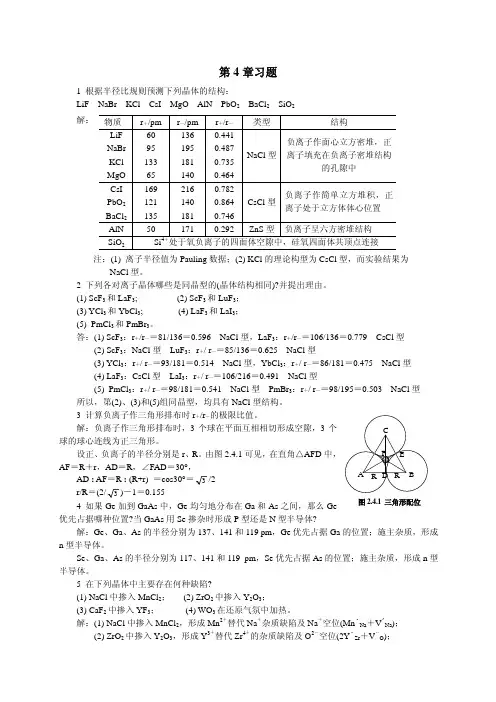
解:负离子作三角形排布时,3个球在平面互相相切形成空隙,3个球的球心连线为正三角形。
设正、负离子的半径分别是r 、R 。
由图2.4.1可见,在直角△AFD 中,AF =R +r ,AD =R ,∠FAD =30°, AD : AF =R : (R+r) =cos30°=3/2r/R =(2/3)-1=0.1554 如果Ge 加到GaAs 中,Ge 均匀地分布在Ga 和As 之间,那么Ge优先占据哪种位置?当GaAs 用Se 掺杂时形成P 型还是N 型半导体?解:Ge 、Ga 、As 的半径分别为137、141和119 pm ,Ge 优先占据Ga 的位置;施主杂质,形成n 型半导体。

第一章 气体和溶液§1-1 气体教学目的:1. 熟练掌握理想气体状态方程式,并掌握有关计算。
2.熟练掌握分压定律及应用。
教学重点:1. 理想气体状态方程式;2. 道尔顿分压定律。
一、理想气体(Ideal Gases )1.什么样的气体称为理想气体?气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。
即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。
2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。
3.实际气体在什么情况下看作理想气体呢?只有在温度高和压力无限低时,实际气体才接近于理想气体。
因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。
二、理想气体状态方程1.理想气体方程式(The ideal-gas equation ) pV = nRT2.理想气体方程式应用(Application of the ideal-gas equation )可求摩尔质量 (1) 已知p ,V ,T , m 求 M(2) 已知p ,T ,ρ 求 M三、道尔顿分压定律(Dalton’s Law of Partial Pressures ) 1801年1.Deduction :假设有一理想气体的混合物,此混合物本身也是理想气体,在温度T 下,占有体积为V ,混合气体各组分为i (=1,2,3,… i ,…) 由理想气体方程式得:11RT p n V = ,22RT p n V = ,……,i i RTp n V=,…… ∴总p VRT nVRT n p ii ===∑∑,即∑=ipp 总2.表达式:∑=ipp 总3.文字叙述:在温度和体积恒定时,其总压力等于各组分气体单独存在时的压力之和。
4.另一种表达形式:ii i iRTn p n V x RT p n n V===总─ mole fraction 在温度和体积恒定时,理想气体混合物中,各组分气体的分压(p i )等于总压(p 总)乘以该组分的摩尔分数(x i )。





无机化学(第四版)答案第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。


无机化学课程教学大纲水排水工程专业课程教学大纲(2021级)无机化学课程编号:0812198课程性质:学科基础课适用专业:给水排水工程先修课程:中学化学后续课程:分析化学和物理化学总学分:3教学目的与要求:无机化学是环境工程、给排水、农业材料、环境科学等专业的第一门基础化学课程。
它在学生的学习中起着承上启下的作用。
当前化学的快速发展和近年来化学专业大一新生的特点,要求无机化学教学不仅要注重基础课程内容的细化,还要适当引入现代化学的新发展,使学生既能掌握无机化学的基本内容,又能通过化学学习正确认识现代化学的发展特点,充分发挥学生学习化学的主动性,提高学生学习化学的兴趣。
1.使学生掌握物质结构理论、化学热力学和动力学、化学平衡、氧化一还原、配位化合物等基本原理和基础知识,为进一步学习后续课程和分析、解决一般无机化学问题打下基础。
2.培养和训练学生的科学思维方法,引导学生运用辩证唯物主义的认识论和方法论,逐步分析和解决一般无机化学问题。
3.培养学生独立地进行无机化学实验、化学计算等方面的能力。
4.使学生全面了解无机化学的发展过程和趋势,以及与重要相关学科的联系。
教学内容与学时安排序列号章节标题科学时间顺序分配号9999章节标题课时分配6331章节1化学反应基本原理2第2章溶液和胶体3第3章电化学原理和应用4第4章材料结构基础5章化学和材料6章化学和化学环境保护7第7章化学与生命第一章化学反应中的能量关系1.了解系统、环境和相的概念,了解气体分压定律。
2.了解系统的状态、状态功能的含义和状态功能的特点。
了解恒压热和火焰变化之间的关系,以及恒容热和热力学能变化之间的关系。
θθθθ3.了解δg、δh、δS等,掌握它们的计算方法。
可分别用δG和δG判断标准状态和非标准状态下的化学反应方向。
θ4.了解标准平衡常数的意义及其与δG的关系,并控制相关计算。
5.了解化学反应速率与浓度、温度的定量关系。
了解元反应和反应级数的概念,能用活化能和活化分子的概念说明浓度、催化剂对化学反应速率的影响。

第一篇物质结构基础第一章原子结构和元素周期系第二章分子结构第三章晶体结构第四章配合物第二篇化学热力学与化学动力学基础第五章化学热力学基础第六章化学平衡常数第三篇水溶液化学原理第九章酸碱平衡第十章沉淀平衡第十一章电化学基础第十二章配位平衡第四篇元素化学(一)非金属第十三章氢和稀有气体第十四章卤素第十五章氧族元素第十六章氮磷砷第十七章碳硅硼第十八章非金属元素小结第五篇元素化学(二)金属第二十一章p区金属第二十二章ds 区金属第二十三章 d 区金属(一)第四周期d区金属要求绪论教学基本要求:理解化学研究的对象、内容、目的和方法。
了解化学发展的现状。
掌握学习化学的正确方法。
第一篇物质结构基础第1章原子结构与元素周期系教学基本要求:初步了解原子能级、波粒二象性、原子轨道(波函数)和电子云等原子核外电子运动的近代概念。
熟悉四个量子数对核外电子运动状态的描述。
熟悉s、p、d原子轨道的形状和伸展方向。
掌握原子核外电子排布的一般规律和各区元素原子层结构的特征。
会从原子半径、电子层构型和有效核电荷来了解元素的性质。
熟悉电离能、电子亲合能、电负性及主要氧化值的周期性变化。
1.本章第1、2、3节讨论原子、元素、核素、同位素、同位素丰度、相对原子质量等基本概念。
其中相对原子质量(原子量)是最重要的,其余都是阅读材料。
2.本张第4节讨论氢原子的玻尔行星模型,基本要求是建立定态、激发态、量子数和电子跃迁4个概念,其他内容不作为教学要求。
3.第5节是本章第1个重点。
基本要求是初步理解量子力学对核外电子运动状态的描述方法;初步理解核外电子的运动状态;掌握核外电子可能状态的推算。
本节小字部分为阅读材料。
4.第6节是本章第2个重点。
基本要求是掌握确定基态原子电子组态的构造原理,在给定原子序数时能写出基态原子的电子组态;掌握多电子原子核外电子状态的基本规律,特别是能量最低原理。
本节小字内容不作教学要求。
5.第7、8节是本章最后1个重点。
