原子光谱项的意义和推求_姜心田
- 格式:pdf
- 大小:153.28 KB
- 文档页数:4

原子结构与光谱:原子光谱与谱线原子光谱是研究原子结构和性质的重要方法之一。
通过观察原子在光谱仪中经过光激发后产生的谱线,科学家们深入探索了原子的内部构造和粒子行为,为人类认识宇宙提供了重要的线索。
本文将介绍原子结构与光谱的关系,解析原子光谱的特点以及谱线的含义。
一、原子结构与光谱理解原子光谱首先需要了解原子的基本结构。
根据波尔模型,原子由一个中心核和围绕核运动的电子构成。
核内的质子和中子决定了原子的质量,而电子则决定了原子的化学性质。
原子的电子以能级的形式存在,每个能级可以容纳一定数量的电子。
当原子受到外部能量的激发时,电子会从低能级跃迁到高能级。
当电子回到低能级时,会释放出一定的能量,形成光的辐射。
这种辐射所形成的光谱称为原子光谱。
原子光谱可以通过光谱仪进行分析,并确定所观察到的谱线。
二、原子光谱的特点1. 具有特定的波长和颜色:不同元素的原子具有不同的能级结构,因此其光谱也具有独特的波长和颜色。
这使得原子光谱成为元素鉴定和分析的重要手段。
2. 具有离散的谱线:原子的能级是离散的,因此原子光谱呈现出离散的、间隔均匀的谱线。
每个谱线对应着电子跃迁的能级差和能量释放的特定波长。
3. 具有良好的分辨能力:原子光谱仪具有很高的分辨能力,可以准确测量光谱中谱线的波长和强度。
这为科学家们进行精确的光谱分析提供了有力工具。
三、谱线的含义原子光谱中的谱线代表着电子跃迁时产生的辐射能量。
通过观察和分析谱线的特征,可以得出以下信息:1. 波长:谱线的波长可以确定电子跃迁的能级差,从而推测原子的能级结构和电子分布。
2. 强度:谱线的强度反映了电子跃迁的概率,即从高能级到低能级的跃迁概率。
强度较强的谱线对应的跃迁概率较高。
3. 形态:谱线的形态(如单峰、多峰等)可以提供关于原子的电子状态和相应能级的信息。
4. 分裂:有些原子光谱呈现出多条非常接近且微弱的谱线,这是由于原子的内部结构和外界环境的影响导致原子能级的分裂现象。




原子光谱的原理及应用1. 原子光谱的概述•原子光谱是通过检测和分析原子发射或吸收光谱来研究原子及其性质的一种方法。
•原子光谱可以分为原子发射光谱(AES)和原子吸收光谱(AAS)两种。
•原子光谱技术广泛应用于材料科学、环境监测、生命科学等领域。
2. 原子光谱的原理•原子在激发状态下会发射或吸收特定频率的光子。
•原子光谱的原理基于原子能级结构和光与物质相互作用的规律。
•原子在吸收或发射光谱过程中,能级跃迁导致光子的能量差异,从而产生特定波长的光谱线。
3. 原子发射光谱(AES)•原子发射光谱是通过检测原子发射的光谱来分析物质中的元素组成和含量。
•原子发射光谱的基本原理是将样品激发至高能态,然后测量发射光强度,进而得到元素的分析结果。
•原子发射光谱具有快速、高灵敏度和多元素分析的优势,适用于材料分析和环境监测等领域。
4. 原子吸收光谱(AAS)•原子吸收光谱是通过检测原子吸收特定波长的光谱来定量分析物质中的元素含量。
•原子吸收光谱的基本原理是通过比较样品吸收光强度与标准溶液的吸收光强度,从而确定元素的含量。
•原子吸收光谱具有高选择性、高准确性和灵敏度,广泛应用于环境、农业、医药等领域。
5. 原子光谱的应用•原子光谱技术在材料科学中的应用:–分析材料中的元素组成和含量。
–研究材料的结构和性质。
–检测金属材料中的杂质。
•原子光谱技术在环境监测中的应用:–检测空气中的污染物。
–分析水体中的金属离子含量。
–监测土壤中的有害物质。
•原子光谱技术在生命科学中的应用:–分析生物体内的元素含量。
–研究药物与生物体的相互作用。
–检测食品中的有害物质。
6. 结论•原子光谱是一种重要的分析技术,可广泛应用于材料科学、环境监测和生命科学等领域。
•原子光谱的原理基于原子能级结构和光与物质的相互作用规律。
•原子发射光谱和原子吸收光谱是原子光谱的两种基本形式。
•原子光谱技术有着快速、高灵敏度和多元素分析的优势,是现代科学研究和工业生产中不可或缺的工具。

原子光谱项和基谱支项的简单推求
原子光谱学和基谱学是光谱学的两个重要分支,分别与原子性质和基性质有关。
原子光谱
学的研究和应用主要是研究原子的发射和吸收光谱特性,基谱学主要研究和应用分子光谱
特性。
原子光谱项一般指原子性特征,包括原子态、分子态、单离子态等。
基谱支项则指
分子性特征,包括分子状态、化学键、空间结构等。
原子光谱学主要研究原子发射光谱特性,为求解结构及化学反应机理提供信息。
原子发射
光谱又可以细分为发射线谱(electron lines)、离子谱(ion spectra)、可溶性离子谱(soluble ion spectra)等。
吸收光谱象征原子态的吸收,是探测原子态的有效方法。
基谱学的研究聚焦于分子的发射光谱和发射光谱特性,用于探索和描述分子状态、化学键、空间结构等信息。
发射光谱包括振动光谱、旋转光谱、旋转振动光谱、多重光谱等,可以
用来研究分子所具有的能量状态,此外,吸收光谱也用于探索分子性质。
一般来说,基谱
学的研究方法可以源于原子光谱学的研究方法。
原子光谱学和基谱学都是光谱学的重要分支,可以独立认识和开发应用。
原子光谱项可以
划分为原子态、分子态、单离子态等,基谱支项则可以细分为分子状态、化学键、空间结
构等。
运用原子光谱学和基谱学研究可以深入了解原子性质和分子性质,并为科学实验提
供有效帮助。

原子光谱的作用与研究意义知识点总结
为方便同学们复习物理知识点,查字典物理网小编整理了原子光谱的作用与研究意义知识点总结,供同学们参考学习。
原子光谱提供了原子内部结构的丰富信息。
事实上研究原子结构的原子物理学和量子力学就是在研究分析阐明原子
光谱的过程中建立和发展起来的。
原子是组成物质的基本单元。
原子光谱的研究对于分子结构、固体结构也有重要意义。
原子光谱的研究对激发器的诞生和发展起着重要作用,对原子光谱的深入研究将进一步促进激光技术的发展;反过来激光技术也为光谱学研究提供了极为有效的手段。
原子光谱技术还广泛地用于化学、天体物理、等离子体物理等和一些应用技术学科之中。
原子或离子的运动状态发生变化时,发射或吸收的有特定频率的电磁波谱.原子光谱的覆盖范围很宽,从射频段一直延伸到X射线频段,通常,原子光谱是指红外、可见、紫外区域的谱。
原子光谱中某一谱线的产生是与原子中电子在某一对特
定能级之间的跃迁相联系的.因此,用原子光谱可以研究原子结构.由于原子是组成物质的基本单位,原子光谱对于研究分子结构、固体结构等也是很重要的.另一方面,由于原子光谱可以了解原子的运动状态,从而可以研究包含原子在
内的若干物理过程.原子光谱技术广泛应用于化学、天体物理学、等离子物理学和一些应用技术科学中。
以上内容是小编为大家整理的原子光谱的作用与研究意义知识点总结,大家仔细阅读了吗?想了解更多学习相关资料,敬请关注查字典物理网!。



原子光谱基本原理嘿,朋友们!今天咱来聊聊原子光谱这神奇的玩意儿!你说这原子光谱啊,就像是原子的独特“身份证”。
咱可以把原子想象成一个个小音乐家,它们发出的光就像是独特的旋律。
每个原子都有自己专属的“曲调”,这就是原子光谱啦!这些光谱可不简单,它们蕴含着原子的各种信息呢。
比如说氢原子吧,它发出的光谱就有自己的特点。
就好像一个人有独特的笑声一样,一听就知道是它。
通过研究这些光谱,科学家们就能了解原子的结构、能量状态等等好多好多东西。
这多厉害呀!你看,在我们生活中,各种物质都有自己的光谱特征。
就像不同的人有不同的性格特点。
我们可以通过分析光谱来识别物质,就跟我们通过一个人的言行来认识他差不多。
这是不是很有意思?而且啊,原子光谱的应用那可广泛啦!在化学领域,它能帮助化学家们确定物质的成分。
想象一下,就像侦探通过线索找出真相一样,原子光谱就是化学家们的重要线索。
在天文学中,通过分析遥远星球发出的光谱,我们能知道那些星球上有什么元素,这多神奇呀!就好像我们能隔着老远就知道别人家里有什么宝贝似的。
还有呢,在医学上也有用武之地哦!有些医疗设备就是利用原子光谱的原理来检测人体的健康状况呢。
这就像是给人体做了一次特别的“体检”,能发现一些我们自己都不知道的问题。
原子光谱就像是一个隐藏在微观世界里的宝藏,等待着我们去挖掘、去发现。
它让我们对这个世界有了更深入的了解,让我们看到了那些肉眼看不到的奇妙之处。
所以说呀,原子光谱可真是个了不起的东西!它虽然看不见摸不着,但却在各个领域发挥着巨大的作用。
它就像一个默默奉献的幕后英雄,为我们的生活和科学研究带来了无数的便利和惊喜。
我们是不是应该好好感谢它呢?是不是应该更努力地去探索它的奥秘呢?让我们一起加油吧!。
原子光谱线的解释与归属光谱是物质吸收或发射光线时产生的一系列波长的分布。
而原子光谱则是指由原子吸收或发射的光谱。
原子光谱线的解释与归属是研究原子结构和性质的重要方法之一。
本文将探讨原子光谱线的形成机制以及不同光谱线的归属。
首先,我们来了解一下原子光谱线的形成机制。
当原子处于基态时,其电子处于最低能级,处于稳定状态。
当外界能量作用于原子时,原子的电子会被激发到更高的能级。
这种激发可以通过热激发、电子碰撞或光激发等方式实现。
当激发电子回到较低的能级时,会释放出能量,这能量以光的形式传播出来,形成原子光谱线。
不同的原子具有不同的能级结构,因此会产生不同波长的光谱线。
接下来,我们来讨论一下原子光谱线的归属。
根据量子力学理论,原子的能级是离散的,而且每个能级对应着特定的能量。
这意味着原子只能吸收或发射特定波长的光。
根据这一原理,科学家们通过实验观察到了不同的光谱线,并将其归属于相应的原子。
在可见光谱范围内,最常见的光谱线是氢光谱线。
氢光谱线是由氢原子吸收或发射的光谱线。
经过实验测量,科学家们发现了一系列的氢光谱线,其中最明显的是巴尔末系列、帕舍尼系列和布拉开系列。
这些光谱线的波长和强度都有特定的规律,这些规律正是量子力学理论的预测和解释。
除了氢光谱线,其他元素的光谱线也被广泛研究。
例如,钠元素的光谱线在实验室中常常被观察到。
钠光谱线主要由两条黄线组成,波长分别为589.0纳米和589.6纳米。
这些光谱线的归属与钠原子的能级结构有关。
通过实验和理论计算,科学家们确定了这些光谱线与钠原子的电子跃迁过程相对应。
除了单个原子的光谱线,还存在着复杂的多原子光谱线。
例如,金属元素的光谱线往往包含多个波长的光。
这是因为金属元素的原子结构比较复杂,包含多个能级。
不同能级之间的电子跃迁会产生不同波长的光谱线,形成复杂的光谱图案。
通过对这些光谱线的分析,科学家们可以研究金属元素的结构和性质。
总结起来,原子光谱线的解释与归属是通过实验和理论研究来实现的。
原子发射光谱的作用我得跟你好好唠唠原子发射光谱这玩意儿,它可真是个神奇的存在呢!你知道吗?原子发射光谱就像是一把超级厉害的“魔法钥匙”,能打开好多科学奥秘的大门。
我有个朋友叫小李,他在一家冶金厂工作。
有一次,他跟我抱怨说,他们厂在检测金属纯度的时候老是遇到麻烦。
传统的检测方法不仅慢,而且还不是很准确。
我就跟他说,嘿,你咋不知道原子发射光谱这个好东西呢?原子发射光谱在检测金属纯度方面那可是相当厉害的。
它就像一个超级敏锐的侦探,能够精确地找出金属里的各种元素成分。
比如说,在一块合金里,不管是微量的杂质还是主要的金属成分,原子发射光谱都能把它们一一揪出来。
这对于冶金行业来说,简直就是个福音啊。
你想想看,要是能快速又准确地知道金属的纯度,那产品的质量不就能更好地控制了吗?这就好比做菜的时候,你清楚地知道每种调料放多少,做出来的菜肯定美味可口。
那对于冶金产品来说,质量上去了,竞争力不就强了嘛。
小李听了我的话,眼睛都亮了,赶紧回去给他老板推荐去了。
原子发射光谱在环境检测方面也是大显身手呢。
我认识一个环保志愿者小张,他整天为环境里的污染物发愁。
那些污染物啊,就像隐藏在暗处的小怪兽,悄无声息地破坏着我们的环境。
有一次,他跟我说他们在检测一个污染区域的重金属含量的时候遇到了难题,传统方法检测范围有限,而且很容易受到干扰。
我就跟他讲原子发射光谱的事儿。
原子发射光谱在这种情况下就像是一个超级英雄,它可以对土壤、水等环境样品中的各种重金属元素进行检测。
不管是水里微量的汞、铅,还是土壤里的镉等有害元素,原子发射光谱都能检测出来。
这就好比给环境检测人员装上了一双透视眼,能够看穿这些污染物的伪装。
小张听了可高兴了,说这可真是个好办法。
在天文学领域,原子发射光谱更是有着不可替代的作用。
我曾经参加过一个天文学爱好者的聚会,在那里我认识了老王。
老王对星星那可是痴迷得很呢。
他总是感叹说,想要了解那些遥远的星星可真难啊。
我就跟他说,老王啊,原子发射光谱就能帮上大忙呢。
原子光谱项的推导方法
,
原子光谱是科学研究中不可或缺的一个重要工具,其中常用的是原子吸收光谱法。
它是利用原子、分子及其颗粒在一定的发射或吸收的光的波长范围内吸收特定的能量,将光谱图上的离子线和谱线信息看做是存在不同离子态和激发态介质中的原子信息,从而推导出物质的原子组成。
推导原子光谱的步骤如下:
第一步:预备工作,准备实验材料,确定实验条件,防止实验前物质发生变化,如临界温度、湿度等;
第二步:原子发射或吸收能量,原子线和谱线此时正在发生,光谱图此时正在
自动绘制;
第三步:数据处理,将光谱数据通过光谱仪系统处理,并根据所选取的理论公式,将某一波长的信号作为原子光谱的指示,计算出原子的具体吸收光谱;
第四步:推导原子光谱,分析出原子的能级结构,并用Born-Oppenheimer近
似加以计算;
第五步:用费米进一步计算,将不同离子态和激发态介质中的原子信息结合起来,推导出3d状态空间,并使用不同的数学工具验证原子光谱,最终得出物质的
原子组成。
原子光谱推导是一个比较繁琐的过程,需要精良的实验设备和丰富的数学知识,只有准备充分,才能精准获取物质的组成和反应特性。
原子光谱推导方法为科学家们提供了一种更加精确快捷的研究方法。
原子光谱的原理及应用推荐原理原子光谱是研究原子的能级结构和光谱特性的一种方法。
原子在受到能量激发后会发射出具有特定频率的光,这些特定频率对应着原子的能级差。
通过测量原子发出的光谱,可以推断出原子的能级结构。
原子光谱的原理主要包括激发、发射和吸收三个过程。
激发过程在原子光谱中,原子首先要受到能量激发,使其电子从低能级跃迁至高能级。
能量激发可以通过多种方式实现,例如电弧放电、热激发或光激发等。
不同的激发方式会导致不同的光谱特征。
发射过程原子在受到能量激发后,会发射出具有特定频率的光。
这些特定频率的光对应着原子的能级差,可以通过光谱仪测量和分析。
原子发射光谱可以分为系列谱、带谱和线谱等。
每种谱线对应着原子能级之间的跃迁,通过测量谱线的强度和位置,可以推断出原子的能级结构。
吸收过程与发射过程相反,原子在低能级态时可以吸收相应能量的光,电子跃迁到高能级态。
吸收光谱是一种连续的谱带,与原子发射光谱相比,其强度较弱。
通过测量吸收光谱的强度和波长,可以进一步研究原子的能级结构和光谱特性。
应用推荐原子光谱的研究对于理解原子能级结构、研究物质性质和开展分析化学等领域具有重要意义。
以下是一些原子光谱应用的推荐:1.元素分析:原子光谱可以用于定性和定量分析元素的含量。
通过测量原子的发射光谱或吸收光谱,可以确定样品中不同元素的存在和相对含量。
原子吸收光谱法是分析化学中常用的定量分析方法之一。
2.环境监测:原子光谱技术可用于环境监测中,例如测量大气中的气体成分、地下水中的金属离子等。
在环境监测中,原子光谱可以提供快速、准确的分析结果,有助于评估环境污染程度和采取相应的措施。
3.材料研究:原子光谱在材料科学中有广泛应用,可以研究材料的结构、成分和性质。
例如,用原子发射光谱技术可以分析材料中的杂质元素,用原子吸收光谱技术可以研究材料的光学性质等。
4.天体物理:原子光谱在天体物理学中也扮演着重要角色。
天文学家通过分析星光的光谱,可以推断出天体中元素的存在和丰度,以及天体的温度、密度等参数。
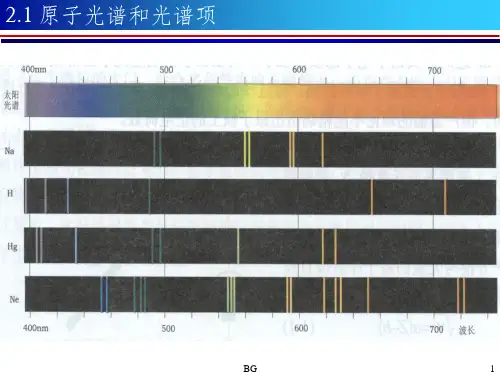
2004年6月 第21卷第2期陕西师范大学继续教育学报(西安)Journal of Further Educati on of Shaanxi N o r m al U niversity Jun.2004V o l.21N o.2 原子光谱项的意义和推求姜心田(陕西师范大学化学与材料科学学院 教授 西安710062) 摘 要:原子光谱项是反映原子内部轨一轨,轨一旋,旋一旋复杂相互作用能量效应的,是解释原子光谱的理论基础。
本文就原子光谱项的意义,L-S耦合推求方法及H und规则通过实例给出了说明。
关键词:原子状态;L-S耦合;量子数L,S,J和m J;H und规则;光谱项;光谱支项中图分类号:O641 文献标识码:A 文章编号:1009-3826(2004)02-0110-051 引言原子中的电子整体总是处在一定的运动状称为原子状态。
每一种原子状态态都具有一定的能量称为原子能量。
这些能量是量子化的。
原子光谱实验对应的是原子的整体状态,原子光谱的精细结构反映了原子内部能级的复杂性。
原子中各电子的主量子数n,角量子数l给定后称为一种组态。
如C原子基态电子层结构为1s22s22p2,简称P2组态。
原子能量的大小显然主要由电子组态决定。
因为原子中各电子的轨道能是由量子数n,l共同决定的。
但轨道能仅包括了电子的动能、电子与核的静电吸引势能以及电子之间的静电排斥势能,只能作为原子能量的初步近似。
由于原子中各电子间还存在着其它复杂的相互作用如轨道——轨道,自旋——自旋静电排斥作用,轨道——自旋磁力相互作用,这些作用均是影响原子能量的因素,是决定原子能量更高一级的近似。
故在一种组态中还可能存在不止一种的能量状态。
对于全充满的闭壳层组态如2s2,2s22p6等每个轨道都占据两个电子,其磁量子粒m和自旋磁量子数m s是唯一确定了的。
然而对于部分充满的壳层组态,或叫做开壳层组态电子的n,l值虽然确定了,但m和m s的值仍然是不能确定的。
如P2组态,在P轨道上的2个电子,其中第一个电子的状态用四个量子数n、l、m、m s来描述就有6种可能性(m=±0,1; m s=±1 2),第二个电子填入后,组成P2组态的微观状态数有C26=6×52!=15种。
(从m个不同元素里每次取出n个元素不管怎样的顺序组成一组,称作组合。
其所有不同的组合种数记作C n m=m(m-1)……(m-n+1)n!。
m和m s表示了电子轨道角动量和自旋角动量在外磁场中的取向。
轨道角动量和自旋角动量各自对应一个磁矩。
轨道运动的磁矩在空间产生一个磁场,这一磁场会与自旋磁矩相互作用而使能量发生变化。
可见各个电子的m和m s 是影响原子能量的重要量子数,这15种微观状态中电磁作用可能不同,因此确定电子的组态还不足以完整地反映原子的状态。
原子状态应由电子组态和电子间电磁相互作用来描述。
而电子间电磁相互作用是用原子光谱项来表征的。
所以原子能量是由电子组态和原子光谱项共同决定的。
在不同的电子组态下,无法单独由原子光谱项来判断原子能量高低。
只有在同一电子组态下才能判断由该组态所产生的各种光谱项所对应的能级的高低。
原子的状态与核外各电子的状态密切相关,但又不是它们的简单加和,表述各个电子微观状态的量子粒n,l,m,m s不能直接和光谱实验观察到的数据相联系。
如何将原子的状态与电子的状态联系起来呢?这就要考虑电子间多种相互作用,这种相互作用通常以角动量耦合来实现。
将几个角动量进行矢量加和得到总的确定的角动量的过程叫耦合。
目前关于角动量耦合有两种近似处理方法,或者说有两种方式将原子状态与它们的电子状态相联系。
当然也可以说有两种确定光谱项的方法。
一种是L-S 耦合又称罗素——桑德斯耦合,它是先分别将各电子的轨道角动量和自旋角动量组合起来得来原子的总轨道角动量M L和总自旋角动量M S,然后再将两者进一步组合得到原子的总角动量M J。
它适用于核电荷Z≤40的轻原子,这些原子的轨—轨,旋—旋的收稿日期 2003-05-09静电作用比较重要,而每个电子的轨一旋磁力作用较小。
另一种是将每个电子的轨道运动所产生的轨道角动量和自旋角动量先组合起来,得到每个电子的总的角动量M j,然后将各电子的总角动量再组合起来求得原子的总角动量M J,这种组合方式称为j -j耦合。
它适用于Z>40的重原子(如稀土元素),这些原子的每个电子的轨道和自旋相互作用比各电子间的轨道相互作用或自旋相互作用都要大,于是采用j-j耦合将会得到更好的近似。
在L-S耦合中,原子的三种角动量M L,M S, M J可分别用原子的总轨道角量子数L,总自旋量子数S,总角量子粒J标记。
与单电子的情况相似三种角动量也是量子化的,且其值可表示为:M L=L(L+1)M S=S(S+1)M J=J(J+1)这三种角动量在外磁场方向(Z轴)上的分量分别为M L Z=m L 原子总轨道磁量子粒m L=-L,-L+1,……L。
共(2L+1)个。
M SZ=m S 原子总自旋磁量子粒:m S=-S,-S+1,……S。
共(2S+1)个。
M JZ= m J 原子总磁量子数:m J=-J,-J+1,……J。
共(2J+1)个。
在多电子原子体系中这三种角动量的Z 分量应分别等于各电子角动量Z分量的代数和,即M L Z=∑i M Zi=∑i m i式中m i为电子i的磁量子数,M SZ=∑i M SZi=∑i m si 式中m si为电子i的自旋磁量子数。
比较以上两组式可得:m L=∑m i,m S =∑m si,求和中最大的m L值和最大的m S值即是该组态中最大的L值和最大的S值。
用来表示原子整体运动状态的第二套量子数L,S,J,m J与表示各个电子微观运动状态的第一套量子数n,l,m,m s不同,它能直接和光谱实验得到的数据相联系。
表明了原子的能态,不同的L,S,J, m J一般来说具有不同的能级,原子光谱项就是在给定的组态下标示所有电子各种角动量大小的符号。
角动量是向量,量子力学可以得出两个量子数为j1和j2的角动量耦合而生成的总角动量量子数j 为:j=j1+j2,j1+j2-1,…… j1-j2 (1)该规则称量子化矢量加和规则,应用这一结论很容易得到多电子原子的L,S,J。
对于两个电子的体系,两个电子的角量子数分别为l1和l2,自旋量子数s1=s2=1 2利用矢量加和规则可得L、S、J的一系列可能值:L=l1+l2,l1+l2-1…… l1-l2 (2)S=l,0(3)J=L+S,L+S-1…… L-S (4)对于含有三个电子的原子,角量子数分别有l1,l2,l3。
自旋量子数s1=s2=s3=1 2。
则三个电子的总L和总S可由(2)式和(3)式的每一值再分别与l3,s3耦合而成即L=l1+l2+l3,l1+l2+l3-1…… l1-l2 -l3S=3 2,1 2J=L+S,L+S-1…… L-S这个方法可推广到含有多个电子的原子。
L-S耦合法可用图解表示为:l1,l2……,l i轨一轨作用LS1,S2……,S i轨一轨作用S轨一旋作用J2 原子光谱项2.1 谱项表示法量子力学可以证明当考虑电子的轨一轨,旋一旋相互作用时,组态的能量分裂成若干个光谱项,光谱项用2S+1L来标记,光谱项的写法规定L用代号表示,当L为0,1,2,3,4,5,6,7,8……时,相应的符号为S、P、D、F、G、H、I K、L……。
又因为能级的高低和S的大小有关系,所以我们将2s+1数值记在表示L的符号S、P、D等的左上角,称为光谱项的多重度。
如1P表示L=2,s=0叫做单重态P,2D表示L= 2,S=1 2叫做二重态D,3P表示L=1,S=1叫做三重态P等等。
当考虑轨——旋相互作用时,不同量子数J的状态所对应的能级还有微小的差别。
因此将J的数值记在表示L的符号的右下角2S+1L J,这样的符号称光谱支项。
当L≥S时,J有(2S+1)个数值即光谱支项的个数等于光谱的多重度,如光谱项3P有3个光谱支项3P2、3P1、3P0,分别读作“三重态P、二”“三重态P、一”、“三重态P、O”。
当L<S时J取(2L+1)个数值,即光谱支项的个数有(2L+1)个。
如光谱项2S有一个光谱支项:2P1 2,读作“二重态S、1 2”,这时(2S +1)就不代表光谱支项的数目了,但习惯上总称2S +1为多重度。
根据以上的讨论,我们可以对多电子原子的状态作这样的理解:核外电子的排布称为组态,由于电子之间的轨一轨,旋一旋静电相互作用,每一组态分解为不同的光谱项,当进一步考虑轨一旋磁相互作用时,每一光谱项又分解为能量有微小差别的若干光谱支项。
每一光谱支项还包含2J+1个不同的状态,它们属于相同的能级,但在外磁场中这2J+1个状态的能级则分裂开来。
这就是一条光谱线在磁场中分裂成几条谱线的所谓塞曼(Zeem an)效应的原因。
2.2 光谱项的确定现在举列说明如何从一给定的电子组态推导出光谱项。
例1 基态H e的电子组态是1S2。
即l1=l2=0, S1=S2=0。
据加和规则得L=0,S=1,0。
但H e的两个电子的量子数m1=m2=0,按Pauli 原理m s1≠m s2。
若令m s1=12,m s2=-1 2,根据∑m s 中最大值即最大S 值的规律求得S m ax =(m S )m ax =(∑im si )m ax =0,这说明S =1是违反Pauli 原理的。
因为S =1意味着两个电子的第4个量子数m s1=m s2=1 2也相等。
这S =1所对应的谱项不能存在应该去掉。
所以H e 的光谱项为:1S ,光谱支项为:1S 。
这一例说明对于具有相同n ,l 的等价电子的原子,在利用加和规则求光谱项时要考虑Pauli 原理的限制。
如果两个电子的量子数n 或l 不同,或者n 和l 都不相同称为非等价电子。
因为非等价电子中任何两个电子至少已有一个量子数不同,所以无须担心违反Pauli 原理。
可分别求出所有可能的L 和S 值,L 和S 值每一个种组合方式给出组态的一个谱项。
如H e 激发态1S 12S 1应有L =0,S =1,0。
因而可产生两个谱项:1S ,3S 。
对应的支项分别为1S 0和3S 1。
我们还注意到,求出一组态的谱项时单电子的主量子数n 并不起作用。
例2 基态L i 的电子组态是1S 22S 1。
这是一个三电子体系,按加和规则可以两个1S 电子先耦合,利用上例结果两个1S 电子的L =0,S =0,可见全充满闭壳层的电子组态对光谱项没有贡献。
这在一般情况下也是对的,如2p 6组态:按Pauli 原理填充情况为: ↑↓ ↑↓ ↑↓m = 1 0 -1因为m L =∑6i=1mi=0,m S =∑6i=1msi=0,S =0。