原子结构原子光谱项
- 格式:pptx
- 大小:409.68 KB
- 文档页数:20





Eu的原子光谱项是一个复杂的问题,涉及到Eu原子的电子结构和能级跃迁。
Eu原子具有复杂的电子结构,其光谱项包括多个能级和跃迁。
在Eu原子的光谱项中,观察到的荧光光谱具有以下特征:荧光峰的宽化、激发和发射谱上各个跃迁峰的相对强度随颗粒度的变化而改变、样品颗粒度小于10nm时激发谱和发射谱上出现新的跃迁峰、Eu3+的5D能级的寿命随颗粒度的减小而缩短,在样品颗粒度小于10nm时,其荧光衰减呈现双指数规律、电荷传递态激发峰随着颗粒度的减小而红移、Eu3+的5D-7F跃迁峰随样品颗粒度减小而兰移等。
另外,双光子电离探测技术也被用于研究Eu原子的光谱项。
通过利用共振激发技术,可以获得Eu原子的奇宇称态和偶宇称束缚态以及自电离态的光谱信息。
总之,Eu的原子光谱项是一个复杂的问题,涉及到多个能级和跃迁,需要通过不同的技术和方法进行研究。

福师《结构化学》第一章量子力学基础和原子结构课堂笔记◆主要知识点掌握程度了解测不准关系,掌握和的物理意义;掌握一维势箱模型方程的求解以及该模型在共轭分子体系中的应用;理解量子数n,l,m的取值及物理意义;掌握波函数和电子云的径向分布图,原子轨道等值线图和原子轨道轮廓图;难点是薛定谔方程的求解。
◆知识点整理一、波粒二象性和薛定谔方程1.物质波的证明德布罗意假设:光和微观实物粒子(电子、原子、分子、中子、质子等)都具有波动性和微粒性两重性质,即波粒二象性,其基本公式为:对于低速运动,质量为m的粒子:其中能量E和动量P反映光和微粒的粒性,而频率ν和波长λ反映光和微粒的波性,它们之间通过常数h联系起来,普朗克常数焦尔·秒。
实物微粒运动时产生物质波波长λ可由粒子的质量m和运动度ν按如下公式计算。
λν量子化是指物质运动时,它的某些物理量数值的变化是不连续的,只能为某些特定的数值。
如微观体系的能量和角动量等物理量就是量子化的,能量的改变为ν的整数倍。
2.测不准关系:内容:海森保指出:具有波粒二象性的微观离子(如电子、中子、质子等),不能同时具有确定的坐标和动量,它们遵循“测不准关系”:(y、z方向上的分量也有同样关系式)ΔX是物质位置不确定度,Δ为动量不确定度。
该关系是微观粒子波动性的必然结果,亦是宏观物体和微观物体的判别标准。
对于可以把h看作O的体系,表示可同时具有确定的坐标和动量,是可用牛顿力学描述的宏观物体,对于h不能看作O的微观粒子,没有同时确定的坐标和动量,需要用量子力学来处理。
3.波函数的物理意义——几率波实物微粒具有波动性,其运动状态可用一个坐标和时间的函数来描述,称为波函数或状态函数。
1926年波恩对波函数的物理意义提出了统计解释:由电子衍射实验证明,电子的波动性是和微粒的行为的统计性联系在一起的,波函数正是反映了微粒行为的统计规律。
这规律表明:对大量电子而言,在衍射强度大的地方,电子出现的数目多,强度小的地方电子出现的数目少,即波函数的模的平方与电子在空间分布的密度成正比。

第二章 原子结构和性质教学目的:通过H 原子薛定谔方程的求解,了解原子结构中量子数的来源,类氢离子波函数的图形及其物理意义。
掌握多电子原子的原子轨道能级等,推导原子基态光谱项。
教学重点:1.类氢离子波函数量子数的物理意义。
2.掌握多电子原子的原子轨道能级、电离能的求解。
3.推导等价、非等价电子的原子光谱项,掌握基态原子谱项的快速推算法。
第一节 单电子原子的薛定谔方程及其解引言:前面介绍了量子力学的概念,建立了量子力学的基础,下面我们要讨论原子结构的核心问题,即原子中电子的运动状态,其中最简单的体系就是原子核外只有一个电子的体系,也叫单电子原子结构,如氢原子和类氢离子(H ,Li 2+,He +,Be 3+……)。
一.建立单电子原子的Schrodinger 方程r Ze mh M h H e N 022********ˆπεππ-∇-∇-= 假设在研究电子运动时核固定不动,r Ze mh H 0222248ˆπεπ-∇-= 为了解题方便通常将x,y ,z 变量变换成极坐标变量r ,θ,φ由图可得如下关系:⎪⎭⎪⎬⎫⋅=⋅⋅=⋅⋅=θφθφθcos sin sin cos sin r z r y r x得极坐标形式的Schrodinger 方程:048sin 1sin sin 110222222222=⎪⎪⎭⎫⎝⎛++∂∂+⎪⎭⎫ ⎝⎛∂∂∂∂+⎪⎭⎫ ⎝⎛∂∂∂∂ψπεπφψθθψθθθψr Ze E h m r r r r r r二、单电子Schrodinger 方程的一般解。
1. 变数分离法把含三个变量的微分方程化为三个各含一个变量的常微分方程来求解。
令()()r R r =φθψ,,Θ(θ)Φ(φ)()()φθ,,Y r R =代入薛定鄂方程,经过数学变换得三个方程:R(r)方程 ()()k E r hm r h mZe r r R r r r R =++⎪⎭⎫ ⎝⎛∂∂∂∂⋅2222022821πεπ Θ方程22sin )(sin )(sin m k =+⎪⎭⎫ ⎝⎛∂Θ∂⋅∂∂⋅Θθθθθθθθ Φ方程222)()(1m =∂Φ∂⋅Φ-φφφ 2. Φ方程的解Φ方程整理得:0222=Φ+Φm a a φ这是一个常系数2阶齐次线性方程,它的特征方程为022=+m p i m p ±=微分方程的两个特解为φim Ae m =Φ m m ±= A 由归一化求得: π21=A ∴φπim e m 21=Φ 这是解的复数形式,由于Φ是循环坐标所以()()πφφ2+Φ=Φm m 于是πφπφφ2)2(im im im im e e e e ⋅==+ 即12=πim e由欧拉公式12sin 2cos 2=+=m i m e im πππ故m 的取值必须为: 2,1,0±±=m 即取值是量子化的称为磁量子数。

原子结构和原子光谱【学习目标】1.了解汤姆孙发现电子的研究方法;2.知道粒子散射实验;3.明确原子核式结构模型的主要内容;4.理解原子核式结构提出的主要思想;5.知道光谱、发射光谱、吸收光谱、光谱分析等概念;6.明确光谱产生的原理及光谱分析的特点;7.知道氢原子光谱的实验规律;8.了解玻尔原子模型及能级的概念;9.理解原子发射和吸收光子的频率与能级差的关系;10.知道玻尔对氢光谱的解释以及玻尔理论的局限性;7.了解激光产生的原理和激光的特性及激光在日常生活中的应用。
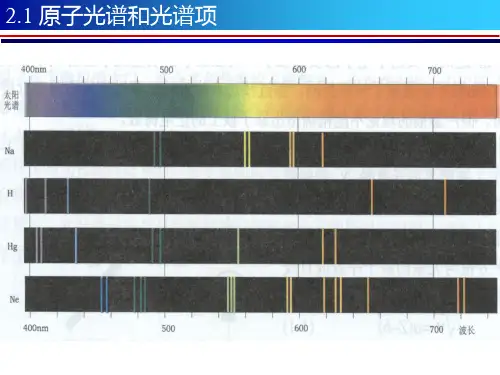
知识1--原子结构1.阴极射线(1)气体的导电特点:通常情况下,气体是不导电的,但在强电场中,气体能够被电离而导电.平时我们在空气中看到的放电火花,就是气体电离导电的结果.在研究气体放电时一般都用玻璃管中的稀薄气体,导电时可以看到辉光放电现象.(2)1858年德国物理学家普里克发现了阴极射线.①产生:在研究气体导电的玻璃管内有阴、阳两极.当两极间加一定电压时,阴极便发出一种射线,这种射线为阴极射线.②阴极射线的特点:碰到荧光物质能使其发光.(2)测定阴极射线粒子的比荷.4.密立根实验美国物理学家密立根在1910年通过著名的“油滴实验”简练精确地测定了电子的电量密立根实验更重要的发现是:电荷是量子化的,即任何电荷只能是元电荷的整数倍.5.电子发现的意义以前人们认为物质由分子组成,分子由原子组成,原子是不可再分的最小微粒.现在人们发现了各种物质里都有电子,而且电子的质量比最轻的氢原子质量小得多,这说明电子是原子的组成部分.电子是带负电,而原子是电中性的,可见原子内还有带正电的物质,这些带正电的物质和带负电的电子如何构成原子呢?电子的发现大大激发了人们研究原子内部结构的热情,拉开了人们研究原子结构的序幕.6.19世纪末物理学的三大发现对阴极射线的研究,引发了19世纪末物理学的三大发现:(1)1895年伦琴发现了X射线;(2)1896年贝克勒尔发现了天然放射性;(3)1897年汤姆孙发现了电子e.知识3--氢原子光谱1.光谱用光栅或棱镜可以把光按波长展开,获得光的波长(频率)成分和强度分布的记录,即光谱.用摄谱仪可以得到光谱的照片.物质的光谱按其产生方式不同可分为两大类:(1)发射光谱——物体直接发出的光通过分光后产生的光谱.它又可分为连续光谱和明线光谱(线状光谱).①连续光谱一一由连续分布的一切波长的光(一切单色光)组成的光谱。


原子光谱项和基谱支项的简单推求
原子光谱学和基谱学是光谱学的两个重要分支,分别与原子性质和基性质有关。
原子光谱
学的研究和应用主要是研究原子的发射和吸收光谱特性,基谱学主要研究和应用分子光谱
特性。
原子光谱项一般指原子性特征,包括原子态、分子态、单离子态等。
基谱支项则指
分子性特征,包括分子状态、化学键、空间结构等。
原子光谱学主要研究原子发射光谱特性,为求解结构及化学反应机理提供信息。
原子发射
光谱又可以细分为发射线谱(electron lines)、离子谱(ion spectra)、可溶性离子谱(soluble ion spectra)等。
吸收光谱象征原子态的吸收,是探测原子态的有效方法。
基谱学的研究聚焦于分子的发射光谱和发射光谱特性,用于探索和描述分子状态、化学键、空间结构等信息。
发射光谱包括振动光谱、旋转光谱、旋转振动光谱、多重光谱等,可以
用来研究分子所具有的能量状态,此外,吸收光谱也用于探索分子性质。
一般来说,基谱
学的研究方法可以源于原子光谱学的研究方法。
原子光谱学和基谱学都是光谱学的重要分支,可以独立认识和开发应用。
原子光谱项可以
划分为原子态、分子态、单离子态等,基谱支项则可以细分为分子状态、化学键、空间结
构等。
运用原子光谱学和基谱学研究可以深入了解原子性质和分子性质,并为科学实验提
供有效帮助。
原子的光谱结构是带状光谱或者连续光谱原子的光谱结构取决于原子中电子的能量状态和跃迁。
一般来说,原子的光谱结构是线状光谱,而不是带状光谱或连续光谱。
线状光谱是由原子中的电子在能量变化时所发射或吸收的一系列特定波长的光所组成的光谱,其特点是各波长之间有明显的界限。
这是因为原子能级是量子化的,电子只能存在于特定的能级上,从一个能级到另一个能级跃迁时,只能发射或吸收特定波长的光。
相比之下,带状光谱和连续光谱分别是指具有一定宽度和连续变化的波长分布的光谱。
这两种光谱的产生原因与原子的能级结构有关。
在某些特殊情况下,如高激发态的原子或气体放电管中,可能会观察到带状光谱或连续光谱。
总之,原子的光谱结构是线状光谱、带状光谱还是连续光谱取决于原子所处的能态以及观察的条件。
如有需要,可以查阅专业资料了解更多有关原子光谱的详细信息。
洪特规则可以确定原子光谱项的能级顺序原子光谱学是一个研究原子状态及其结构的重要领域。
通过原子光谱学可以研究原子的能级及其结构,可以更好地研究原子的性质。
在原子光谱学的研究中,洪特规则是一个重要的原理,他可以确定原子光谱项的能级顺序。
洪特规则是美国物理学家洪德(Hund)提出的一个概念。
它是一种原子能级填充规则,允许多个电子共居在某个能级上,在填充时保持最小能量状态。
洪特规则规定,同一组原子的多个电子能级填充原则中,当第一填充电子成对填充时,会有更高的能量。
因此,在同一组原子中,电子最初填充时,先填充一对,然后紧接着一个单电子,之后就是第三个电子以及更多的对,这就是洪特规则的基本原理。
洪特规则的另一个重要特点是,在它的填充过程中不涉及原子的自旋状态,因此他是一种更加简单和易于理解的原子填充规则。
洪德规则可以用来确定原子光谱项的能级顺序。
原子通常为一个具有不定自旋的系统,因此原子的能级分布状况由它们的最大自旋构成。
当原子填充电子时,Hund规则规定先填满含有最大自旋的最低能级,而不是全部填满最低能级,这样就可以确定原子光谱项的能级顺序。
洪特规则的应用不仅仅是确定原子光谱项的能级顺序,它还可以用来研究原子的结构和特性,并且它在分子光谱学中也有着重要的作用。
洪德规则是原子光谱学、原子结构学以及分子光谱学中不可或缺的重要概念,它有着十分广泛的应用。
综上所述,洪德规则可以确定原子光谱项的能级顺序,是一个重要的原子填充规则。
它不仅可以用来确定原子光谱项的能级顺序,还可以用来研究原子结构、性质以及分子光谱学的相关性质,因此在原子光谱学、原子结构学以及分子光谱学中都有着重要的作用。