第八节 原子整体状态和原子光谱项
- 格式:ppt
- 大小:408.50 KB
- 文档页数:23

化学元素的原子结构和光谱学知识点:化学元素的原子结构与光谱学一、原子结构1.原子核:原子核由质子和中子组成,质子带正电,中子不带电。
原子核的质量远大于电子。
2.电子:电子是原子的外层粒子,带负电。
电子在原子核外以不同的能级分布,能级越高,电子距离原子核越远。
3.能级:原子内部的能量分布不均匀,电子在原子核外按照能量的高低分布在不同能级上。
能级越高,电子距离原子核越远。
4.轨道:电子在能级上的运动轨迹称为轨道。
轨道具有不同的形状和大小,分别对应不同的能量。
5.量子化:电子在原子内的运动是量子化的,即电子只能存在于特定的能级上,不能任意分布在原子内部。
6.泡利不相容原理:一个原子轨道上最多只能容纳两个电子,且这两个电子的自旋量子数必须相反。
7.能级交错:不同能级的电子具有不同的能量,当电子从一个能级跃迁到另一个能级时,会吸收或释放能量。
8.光谱:光谱是光经过物质时,由于物质与光的相互作用,光强度随波长变化的现象。
9.连续光谱:连续光谱是指光通过物质时,从红光到紫光范围内光强度连续变化的 spectrum。
10.吸收光谱:吸收光谱是指光通过物质时,由于物质对光的吸收,使光强度减弱的现象。
吸收光谱反映了物质内部电子能级的分布。
11.发射光谱:发射光谱是指物质受到激发后,自发地发出光的现象。
发射光谱反映了物质内部电子的能级跃迁。
12.线谱:线谱是指光谱中由一系列离散的、亮度相等的暗线或亮线组成的现象。
线谱反映了物质内部电子能级的具体数值。
13.光谱分析:光谱分析是指通过观察和研究物质的光谱,推断物质内部电子能级结构的过程。
14.能级跃迁:物质内部电子从一个能级跃迁到另一个能级时,会吸收或释放能量。
吸收和发射的光波长分别对应电子跃迁前后的能级差。
15.原子光谱:不同元素的原子光谱具有独特的线谱特征,称为指纹光谱。
通过光谱分析,可以识别元素种类。
16.光谱仪:光谱仪是一种用于测量和研究光谱的仪器。
光谱仪可以分析物质的组成、结构、性质等。



原子结构中的原子能级图与光谱分析原子能级图是描述原子内电子能量分布的一种图示方式,它是理解和解释原子结构及其性质的基础。
光谱分析是利用原子或分子对不同频率或波长的光的吸收、发射或散射行为进行物质分析的技术。
本文将探讨原子能级图的基本原理和应用,以及光谱分析技术的原理和应用。
一、原子能级图原子能级图是将原子内电子的能量分布以图形的形式展示出来,它基于原子能量的离散性质,描述了电子的能级和转移方式。
在原子中,电子围绕原子核运动,并处于不同的能级上。
原子能级图可以通过以下三个基本原则来解释原子内电子的能级结构。
1. 泡利不相容原理泡利不相容原理指出,一个原子内的电子不能完全占据相同的能级。
也就是说,同一个能级上最多只能容纳两个电子,并且这两个电子的自旋量子数必须相反。
2. 化学亚壳层规则电子在原子中的能级分布遵循化学亚壳层规则,即一个原子内的电子填充次序为:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p等。
3. 能级间的能量差异能级间的能量差异使得电子在原子内跃迁的时候会吸收或发射特定波长的光。
这些电子跃迁所产生的光谱线具有独特的特征,可以用于分析和识别物质。
二、光谱分析光谱分析是利用原子或分子对特定波长或频率的光的吸收、发射或散射来推断物质的成分或性质的一种分析技术。
1. 吸收光谱分析吸收光谱分析主要包括原子吸收光谱和分子吸收光谱。
原子吸收光谱是通过测量原子在特定波长的光下的吸收来分析物质成分和浓度。
分子吸收光谱是通过测量分子在特定波长的光下的吸收来分析物质的结构和性质。
2. 发射光谱分析发射光谱分析是通过测量物质在特定条件下,发射出的光的波长和强度来分析物质成分和浓度。
原子发射光谱分析常用于金属元素的分析,而分子发射光谱分析则用于分析分子物质的结构和性质。
3. 散射光谱分析散射光谱分析是通过测量散射光的强度和散射角度来研究物质的微观结构和分子大小等性质。
常见的散射光谱分析包括拉曼散射光谱和散射瑞利光谱。


原子能级结构与光谱分析引言:原子能级结构与光谱分析是物理学中重要且广泛研究的领域。
通过对原子能级结构的研究,我们可以了解原子中电子的分布和能量变化规律,从而深入理解原子的行为和性质。
而光谱分析则利用原子能级结构的特性,通过测量物质对电磁波的吸收、发射和散射等现象,来研究物质的组成和性质。
1. 原子能级结构的基本概念在原子中,电子的能量是量子化的,即只能存在于特定的能级上。
这些能级按照能量大小分层排列,称为能级结构。
根据泡利不相容原理,每个能级上最多只能容纳一定数量的电子。
这种能级结构决定了原子在吸收和发射能量时所遵循的规则和选择性。
2. 能级跃迁与光谱现象当原子吸收或释放能量时,它的电子会发生能级跃迁。
跃迁的过程中,原子会吸收或辐射特定频率或波长的光子。
这种光子的频率或波长与电子跃迁之间的能量差相关。
因此,通过测量吸收或发射的光的频率或波长,我们可以推断出原子中电子的能级结构和能量差。
3. 光谱分析的应用领域光谱分析在物理、化学、天文学、生物学等领域有广泛的应用。
在物理学中,光谱分析可以用于研究原子核结构和粒子物理等基础研究。
在化学中,光谱分析可以用于确定样品的组成、纯度和化学反应的动力学过程。
在天文学中,光谱分析可以通过观测星体的光谱来研究宇宙的演化和物质的分布。
在生物学中,光谱分析可以用于研究细胞和生物分子的结构和功能。
4. 光谱分析的主要方法光谱分析的主要方法包括吸收光谱、发射光谱和散射光谱等。
吸收光谱是通过测量样品对特定波长或频率的光的吸收程度来研究样品的组成和浓度。
发射光谱是通过测量样品在受激后发射的光的频率或波长来分析样品的组成和结构。
散射光谱则是通过测量样品对入射光的散射现象来研究样品的微观结构和光学性质。
5. 光谱仪器与数据处理方法光谱分析需要使用特定的仪器和设备来测量和记录光谱。
常用的光谱仪器包括分光仪、光电倍增管、光栅、光谱仪等。
数据处理方法通常包括信号滤波、基线校正、拟合曲线等。

原子结构和原子光谱【学习目标】1.了解汤姆孙发现电子的研究方法;2.知道粒子散射实验;3.明确原子核式结构模型的主要内容;4.理解原子核式结构提出的主要思想;5.知道光谱、发射光谱、吸收光谱、光谱分析等概念;6.明确光谱产生的原理及光谱分析的特点;7.知道氢原子光谱的实验规律;8.了解玻尔原子模型及能级的概念;9.理解原子发射和吸收光子的频率与能级差的关系;10.知道玻尔对氢光谱的解释以及玻尔理论的局限性;7.了解激光产生的原理和激光的特性及激光在日常生活中的应用。
知识1--原子结构1.阴极射线(1)气体的导电特点:通常情况下,气体是不导电的,但在强电场中,气体能够被电离而导电.平时我们在空气中看到的放电火花,就是气体电离导电的结果.在研究气体放电时一般都用玻璃管中的稀薄气体,导电时可以看到辉光放电现象.(2)1858年德国物理学家普里克发现了阴极射线.①产生:在研究气体导电的玻璃管内有阴、阳两极.当两极间加一定电压时,阴极便发出一种射线,这种射线为阴极射线.②阴极射线的特点:碰到荧光物质能使其发光.(2)测定阴极射线粒子的比荷.4.密立根实验美国物理学家密立根在1910年通过著名的“油滴实验”简练精确地测定了电子的电量密立根实验更重要的发现是:电荷是量子化的,即任何电荷只能是元电荷的整数倍.5.电子发现的意义以前人们认为物质由分子组成,分子由原子组成,原子是不可再分的最小微粒.现在人们发现了各种物质里都有电子,而且电子的质量比最轻的氢原子质量小得多,这说明电子是原子的组成部分.电子是带负电,而原子是电中性的,可见原子内还有带正电的物质,这些带正电的物质和带负电的电子如何构成原子呢?电子的发现大大激发了人们研究原子内部结构的热情,拉开了人们研究原子结构的序幕.6.19世纪末物理学的三大发现对阴极射线的研究,引发了19世纪末物理学的三大发现:(1)1895年伦琴发现了X射线;(2)1896年贝克勒尔发现了天然放射性;(3)1897年汤姆孙发现了电子e.知识3--氢原子光谱1.光谱用光栅或棱镜可以把光按波长展开,获得光的波长(频率)成分和强度分布的记录,即光谱.用摄谱仪可以得到光谱的照片.物质的光谱按其产生方式不同可分为两大类:(1)发射光谱——物体直接发出的光通过分光后产生的光谱.它又可分为连续光谱和明线光谱(线状光谱).①连续光谱一一由连续分布的一切波长的光(一切单色光)组成的光谱。



教学目的:掌握原子的量子数的确定和原子光谱项及光谱支项的推求方法。
教学重点:量子数的确定、原子光谱项及光谱支项的推求。
教学难点:同科(等价)电子谱项的推求。
授课时数: 授课内容:1.原子的量子数与角动量的耦合 2.原子光谱项3.原子光谱项对应能级的相对大小 4.原子光谱项的推求法 5.原子能级和原子光谱的关系 序:原子中个别电子的运动状态用sm ,m ,l ,n 四个量子数描述。
那么原子的整体状态用怎样的量子数来描述呢?原子的整体的状态,取决于核外所有电子的轨道和自旋状态。
然而,由于多电子原子中电子间存在着相当复杂的作用,而且轨道运动和自旋运动所产生的磁矩之间也存在着相互作用。
所以,原子状态又不是所有电子状态的简单加和。
用JM J S L ,,,四个量子数描述原子整体的状态。
原子的电子组态原子中所有电子按照一定规则排列在原子轨道上,构成了多电子原子的核外电子排布,称为原子的电子组态。
无外磁场时,多电子原子的能量由n,l 决定,不考虑电子的相互作用时,n,l 可表示原子的状态。
原子的微观状态 将量子数sm m ,考虑进去,电子按一定规则排列在自旋轨道上的状态。
如,C :电子组态为:222221p s s 。
1s 、2s 填满电子,构成闭壳层;2p 轨道上两个电子,每个电子的状态有6种可能(2/1,1,0±=±=s m m ),组成组态的微观状态数为1525*626==C 种。
这些微观状态原子能量、角动量等物理量以及其中电子间静电相互作用,轨道及自旋相互作用,以及在外磁场存在下原子所表现的性质等具有怎样的规律性呢?原子光谱从实验上研究了这些问题。
一、原子的量子数与角动量的耦合(一)角动量守恒原理:在没有外界的影响下,一个微粒的运动或包含若干微粒运动的体系,其总角动量是保持不变的。
原子内只有一个电子时,虽可粗略地认为它的轨道角动量和自旋角动量彼此独立,又都保持不变。
但严格说,这两个运动产生的磁距间会有磁的相互作用,不过它们的总角动量却始终保持恒定。
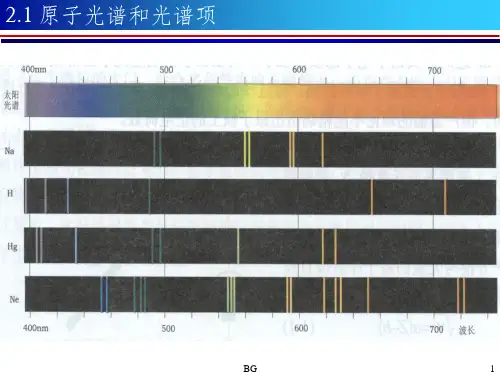
原子光谱项和光谱支项求法稿子一:嘿,亲爱的小伙伴们!今天咱们来聊聊原子光谱项和光谱支项的求法。
说起这原子光谱项啊,它可是个有点神秘但又超级有趣的东西。
要找到它,咱们得先从原子的电子组态入手。
就好像是给原子的电子们排排坐,分分组。
比如说,咱们先确定电子的主量子数、角量子数这些参数。
这就像是给电子们贴上不同的标签。
然后呢,根据一些特定的规则,把这些电子的状态组合起来。
在这个过程中,要特别注意泡利不相容原理哦,不能让电子们乱了套。
还有那个洪特规则,也是很关键的呢。
当咱们把这些都搞清楚了,就能算出原子光谱项啦。
再来说说光谱支项,这可是在光谱项的基础上更进一步的细分。
得考虑到电子的自旋量子数。
这就好像是给已经排好队的电子们再加上一点点小个性。
呢,求原子光谱项和光谱支项虽然有点小复杂,但是只要咱们一步一步来,细心一点,就能搞定它们!是不是还挺有意思的?稿子二:嗨呀,朋友们!今天咱们来唠唠原子光谱项和光谱支项的求法。
你想啊,原子里的那些电子就像一群调皮的小精灵,要搞清楚它们的状态可不容易。
咱们先来讲讲原子光谱项的求法。
得先弄明白每个电子所处的轨道和状态,这就像知道每个小精灵住在哪间房子里。
然后呢,根据一些神奇的规则,把这些信息综合起来。
比如说,要考虑电子的磁量子数啥的。
有时候,还得想想那些电子之间会不会互相影响,就像小精灵们会不会吵架一样。
再来说说光谱支项,这就更精细啦!得把电子的自旋也考虑进去。
就好像给每个小精灵都戴上了一顶有特别标记的帽子。
求这两个东西的时候,可别着急,慢慢算,仔细算。
就像解一个有趣的谜题,当你算出来的时候,那种成就感,简直太棒啦!反正呢,原子光谱项和光谱支项虽然有点难搞,但只要咱们有耐心,有兴趣,肯定能把它们拿下!怎么样,是不是准备好去探索啦?。