单分子-2016-4-时间分辨光谱技术
- 格式:pdf
- 大小:1.85 MB
- 文档页数:35

光谱分析法大全光谱分析法有很多仪器应用,比如紫外分光光度计、原子吸收光谱、红外光谱、原子荧光光谱、近红外光谱、激光拉曼、分子荧光等。
这些仪器如何区分呢?原理有啥区别?看完本文希望你能建构起光谱分析法的宏观概念。
光学分析法凡是根据物质与辐射能的相互作用所建立起来的定性、定量和结构分析的方法,均可称为光学分析法。
光学分析法是基于物质发射的电磁辐射(electromagnetic radiation)或物质与辐射相互作用产生的辐射信号或发生的信号变化来测定物质的性质、含量和结构的仪器分析方法。
电磁辐射是一种以电磁波的形式在空间高速传播的粒子流,具有波动性和微粒性。
根据物质与辐射能作用的性质不同,光学分析法可分为光谱法和非光谱法。
光谱法:当物质与辐射能作用时,物质内部发生能级之间的跃迁;记录由能级跃迁所产生的辐射能强度随波长(或相应单位)的变化,所得的图谱称为光谱。
利用物质的光谱进行定性、定量和结构分析的方法称为光谱分析法,简称光谱法。
非光谱法:非光谱法是基于物质与辐射相互作用时,测量辐射的某些性质,如折射、散射、干涉、衍射、偏振等变化的分析方法。
非光谱法不涉及物质内部能级的跃迁,电磁辐射只改变了传播方向、速度或某些物理性质。
属于这类分析方法的有折射法、偏振法、光散射法、干涉法、衍射法、旋光法和圆二向色性法等。
光谱分析法的分类光谱法可分为原子光谱法和分子光谱法。
原子光谱法是由原子外层或内层电子能级的变化产生的,它的表现形式为线光谱。
属于这类分析方法的有原子发射光谱法(AES)、原子吸收光谱法(AAS),原子荧光光谱法(AFS)以及X射线荧光光谱法(XFS)等。
分子光谱法是由分子中电子能级、振动和转动能级的变化产生的,表现形式为带光谱。
属于这类分析方法的有紫外-可见分光光度法(UV-Vis),红外光谱法(IR),分子荧光光谱法(MFS)和分子磷光光谱法(MPS)等。
光谱法按不同的分类角度,可归为不同类别。


AES 原子发射光谱:原子的外层由高层能及向底层能级,能量以电磁辐射的形式发射出去,这样就得到了发射光谱。
原子发射一般是线状光谱。
原理:原子处于基态,通过电至激发,热至激发或者,光至激发等激发作用下,原子获得能量,外层电子从基态跃迁到较高能态变成激发态,经过10-8s ,外层电子就从高能级向较低能级或基态跃迁,多余能量的发射可得到一条光谱线。
光谱选择定律:①主量子数的变化△n 为包括零的整数,②△L=±1,即跃迁只能在S 项与P项间,P 与S 或者D 间,D 到P 和F 。
③△S=0,即不同多重性状间的迁移是不可能的。
③△J=0,±1。
但在J=0时,J=0的跃迁是允许的。
N 2S+1L J影响谱线强度的主要因素:1激发电位2跃迁概率3 统计权重4激发温度(激发温度↑离子↑原子光谱↓离子光谱↑)5原子密度原子发射光谱仪组成:激发光源,色散系统,检测系统,激发光源:①火焰:2000到3000K ,只能激发激发电位低的原子:如碱性金属和碱土金属。
② 直流电弧:4000到7000K ,优点:分析的灵敏度高,背景小,适合定量分析和低含量的测定。
缺点:不宜用于定量分析及低熔点元素的分析。
③交流电弧:温度比直流高,离子线相对多,稳定性比直流高,操作安全,但灵敏度差④火花:一万K ,稳定性好,定量分析以及难测元素。
每次放电时间间隔长,电极头温度低。
适合分析熔点低。
缺点:灵敏度较差,背景大,不宜做痕量元素分析(金属,合金等组成均匀的试样)⑤辉光 激发能力强,可以激发很难激发的元素,(非金属,卤素,一些气体)谱线强度大,背景小,检出限低,稳定性好,准确度高(设备复杂,进样不方便)⑥电感耦合等离子体10000K 基体效应小,检出限低,限行范围宽⑦激光 一万K ,适合珍贵样品分光系统:单色器:入射狭缝,准直装置,色散装置,聚焦透镜,出射狭缝。
棱镜:分光原理:光的折射,由于不同的光有不同的折射率,所以分开。


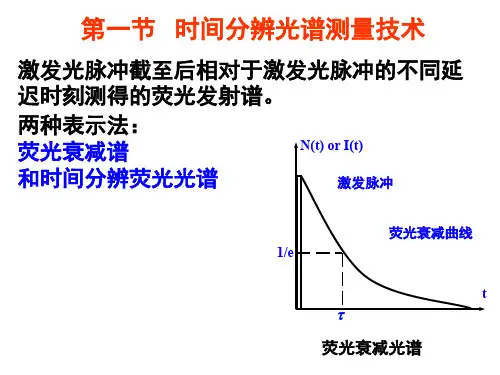
时间分辨光谱和稳态光谱1. 引言1.1 时间分辨光谱的定义时间分辨光谱是一种通过在时间上分辨光谱信号来研究物质的光谱特性的方法。
它能够实时观察物质在不同时间点上的光谱响应,从而揭示物质的动态变化过程。
通过时间分辨光谱,我们可以了解物质在激发态和基态之间的能量转移路径、激发态的寿命、化学反应的动力学过程等信息。
时间分辨光谱的快速响应和高时间分辨率使其在研究快速动力学过程和光化学反应中具有重要应用价值。
通过对时间分辨光谱数据的分析和处理,可以获得物质的光谱动力学信息,进一步深入理解物质的光谱特性和反应机制。
时间分辨光谱在生物医学、材料科学、化学反应动力学等领域有着广泛的应用,为研究人员提供了一个强大的工具来探索物质的微观结构和动态行为。
1.2 稳态光谱的定义稳态光谱是指在系统达到稳定状态时所测得的光谱。
在稳态光谱中,系统的能级分布保持不变,各能级之间的占据数达到平衡,从而呈现出一定的能级结构和波长分布。
稳态光谱通常用于研究物质的结构、成分和性质,可以帮助我们了解物质的光学特性、化学反应过程等。
稳态光谱具有稳定性高、信号强度高、测量精度高等特点,因此在很多领域得到广泛应用。
在化学分析领域,稳态光谱常常用于物质的定性和定量分析;在生物医学领域,稳态光谱可用于研究生物分子的结构和功能;在材料科学领域,稳态光谱可用于研究材料的光学、电学性质等。
稳态光谱的应用范围非常广泛,对于推动科学研究和技术发展具有重要意义。
2. 正文2.1 时间分辨光谱的特点时间分辨光谱是一种通过测量物质在不同时间尺度上的光学响应来研究其动力学过程的技术手段。
其特点主要包括以下几个方面:1. 高灵敏度:时间分辨光谱能够提供高灵敏度的光学信号,使得可以检测到物质在极短时间尺度上的变化。
2. 高分辨率:该技术具有高分辨率的特点,能够准确地测量物质在时间上的变化,并能够区分不同光谱特征的信号。
3. 非破坏性:时间分辨光谱通常是非破坏性的,可以在不破坏样品的情况下对其进行测量,适用于对一些脆弱或难获取的样品的研究。

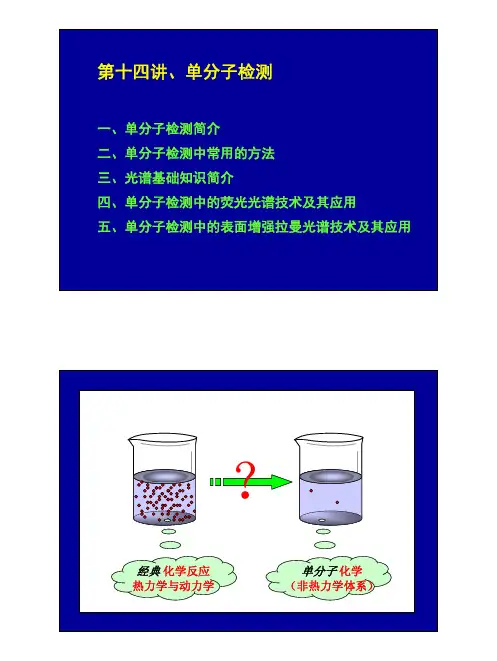
一.单分子技术单分子技术是指在单分子水平上对生物大分子的行为(包括构象变化、相互作用、相互识别等)进行实时﹑动态检测以及在此基础上的操纵﹑调控等,是纳米技术和分子生物物理学的自然延伸和必然趋势。
生命单元的基本功能主要取决于单个大分子,单分子操纵方法在研究单个生物分子的性质上有着独特的优势。
与测量分子集合体整体性质的传统方法(如光散射,光偏振,粘滞性等)相比,单分子技术具有直接,准确,实时等优点。
主要的研究手段有两种:1。
单分子光谱学(Single-molecule spectroscopy 和Single-molecule FRET)2。
单分子力谱(AFM和光镊)二荧光光谱荧光光谱先要知道荧光,荧光是物质吸收电磁辐射后受到激发,受激发原子或分子在去激发过程中再发射波长与激发辐射波长相同或不同的辐射。
当激发光源停止辐照试样以后,再发射过程立刻停止,这种再发射的光称为荧光。
1荧光光谱物体经过较短波长的光照,把能量储存起来,然后缓慢放出较长波长的光,放出的这种光就叫荧光。
如果把荧光的能量--波长关系图作出来,那么这个关系图就是荧光光谱。
荧光光谱当然要靠光谱检测才能获得。
荧光光谱。
高强度激光能够使吸收物种中相当数量的分子提升到激发量子态。
因此极大地提高了荧光光谱的灵敏度。
以激光为光源的荧光光谱适用于超低浓度样品的检测,例如用氮分子激光泵浦的可调染料激光器对荧光素钠的单脉冲检测限已达到10-10摩尔/升,比用普通光源得到的最高灵敏度提高了一个数量级。
荧光光谱有很多,如原子光谱1905年,Wood首先报道了用含有NaCl的火焰来激发盛有钠蒸气的玻璃管,并得到了D线的荧光,被Wood称为共振荧光。
在Mitchell及Zemansky和Pringsheim的著作里讨论了某些挥发性元素的原子荧光。
火焰中的原子荧光则是Nichols和Howes于1923年最先报道的,他们在Bunsen焰中做了Ca、Sr、Ba、Li及Na的原子荧光测定。

光致发光组分测量
光致发光是指在吸收光能后,物质发射出的荧光或磷光。
测量光致发光组分的主要方法有如下几种:
1. 光谱测量:利用分光光度计或荧光光谱仪测量样品在不同波长下的发光强度。
通过比较样品在不同波长下的发光谱线,可以确定其光致发光组分的类型和含量。
2. 单光子计数:通过单光子计数仪测量样品发出的光子数量,从而确定光致发光组分的浓度。
这种方法适用于低浓度样品或有单分子发光的系统研究。
3. 时间分辨荧光光谱:利用荧光寿命测量技术,测量样品发光的寿命和荧光强度。
通过时间分辨荧光光谱仪的测量,可以进一步了解光致发光组分的动力学过程和化学性质。
4. 图像分析:利用荧光显微镜或荧光成像仪,观察和记录样品的光致发光图像。
通过图像分析,可以获得样品中不同位置的光致发光组分的分布和形态信息。
综上所述,光致发光组分的测量可以通过光谱测量、单光子计数、时间分辨荧光光谱和图像分析等方法来实现。
不同的方法可以提供不同方面的信息,根据需要选择适当的测量方法。

一个调Q 开关激光的泵浦功率P P (t), 振荡阈值,反转密度出功率P L (t)的示意图Such an optical switch can be realized, for instance, if one of the resonatormirrors is mounted on a rapidly spinning motor shaft. Only at that time t0 where the surface normal of the mirror coincides with the resonator axis is the incident light reflected back into the resonator, giving a high Q value of the laser cavity. The optimum time t0 can be selected by imaging the beam of a light-emitting diode (LED)after reflection at the spin motor onto the detector D , which provides the trigger signal for the flash lamp of the Q-switch laser.用快速转动的反射镜当Q -开关在激光腔内放入一个Pockel-cell 和两个相互垂直的偏振器当Q -开关。
Pockel-cell 有一块各向异性晶体,在电场下能旋转光的偏振方向。
锁模激光(Mode-Luck Lasers)当激光腔内没有选频元件时,激光腔内同时有多模振荡,模之间无位相关系。
如果用一个光调制器把所有同时振荡的模的位相耦合起来,这些模的振幅相干叠加出的激光会是ps 超短脉冲。
这种模的耦合又叫锁模,产生的激光叫锁模激光。
主动锁模示意图. 如图,把一个调制器放入激光腔内。

时间分辨光谱技术
时间分辨光谱技术(Time-Resolved Spectroscopy,TRS) 是一种分析物质结构和动力学特性的技术,它通过测量物质在一定时间内的光谱变化,来确定物质的结构和动力学特性。
TRS 技术通常涉及两个步骤:脉冲荧光光谱和时间分辨光谱。
脉冲荧光光谱技术(PFS) 用于测量物质在一定时间内的荧光强度变化,而时间分辨光谱技术(TDS) 则用于测量物质在一定时间内的光谱变化。
TDS 技术可以通过测量物质在一定时间内的光谱变化来确定物质的结构和动力学特性。
这种技术可以用来确定物质的分子量、结构式、反应机理等。
TDS 技术在化学、环境科学、材料科学和生命科学等领域得到了广泛应用。
总结起来,时间分辨光谱技术是一种分析物质结构和动力学特性的技术,它可以通过测量物质在一定时间内的光谱变化来确定物质的结构和动力学特性。
染料进人DNA 前后发光变化0306090k H z(a)TIR-FM( NR MCB, 4:ss1-5)Fig. 1. (A) The wtGFP chromophore, consisting of a cyclized tripeptideFIG. 2. Excitation and emission spectra for the BFP–GFP and BFP–YFP combinations. (A) The BFP (P4-3 variant) and GFPS65T excitation and emission spectra are shown, illustrating the overlap in BFP emission with GFP absorption, a critical requirement for FRET. (B) The overlap in BFP emission with the YFP excitation spectra. The filter sets used to detect the signals from these fluorescent protein pairs and minimize the spectral cross talk are also illustrated (gray lines). FIG. 4. FRET microscopy with BFP and GFP. Pituitary GHFT1-5 cells were cotransfected with expression vectors encoding GFP–and BFP–C/EBP D244. (A) A reference image showing the nucleus of a cell coexpressing these two proteins was acquired using the GFP filter set to establish the expression level for GFP–C/EBP D244 (bar 5 10 m m). (B) A second digital image was obtained at the same focal plane using the donor filter set to detect the BFP–C/EBP D244 signal. (C) By changing only the emission filter and using identical conditions as for (B), the acceptor (FRET) image was then acquired. The histograms shown demonstrate that the signal in the FRET channel exceeds the donor signal, and is greater than the signal expected for spectral cross talk alone (see Fig. 3A).SM analysis of cellular events (NR MCB, 4:ss1-5)a. Science, 294:864;b. EMBO J, 19:892;c. Science, 295:1083; Nat CB, 2:168Speckle analysis Figure 7 Phosphorylation of EGF–EGFR complexes. A431 cellswere perforated using streptolysin O and stimulated with 10 ngCy5–EGF for 1 min. Phosphorylation of the EGFR was detected withMyosin V1Ion channelCombinations of SM techniques for in vitro protein analysisNR MCB, 4:ss1-5) a, b, BBRC, 290-311; c,d, Single Molecule, 3-33ZnS-capped CdSe Quantum DotA. QD covalently coupled to protein through mercaptoacetic acid量子点Luminescenceimages of cultured HeLa cellsA. Incubated withMercapto-QDs B. QD-transferrinConjugates Antibody-inducedagglutination ofQDs that werelabeled withHuman IgG•In the presence ofBSA (0.5 mg/ml)B. Aggregated QDs inducedby a specific polyclonalantibody (0.5ug/ml)Science, 264:415 (1994)How Strong Is a Covalent Bond?The rupture force of single covalent bonds under anexternal load was measured with an atomic forcemicroscope (AFM). Single polysaccharide molecules werecovalently anchored between a surface and an AFM tipand then stretched until they became detached. By usingdifferent surface chemistries for the attachment,it was found that the silicon-carbon bond ruptured at 2.0 60.3 nanonewtons, whereas the sulfur-gold anchor rupturedat 1.4 6 0.3 nanonewtons at force-loading rates of 10nanonewtons per second. Bond rupture probabilityScience, 283:1727Fig. 1.(A)Photograph of our AFM set-up. The CCD camera is not inview.Fig. 2. Functionalization of an AFM tip with concavalin A.Fig. 3.Steps in the acquisition of an AFM force measurement.The first step is the approach of the cantilever with a cell bound to the substrate. This is followed by contact between the cell and substrate and retraction of the cantilever, which results in the separation of the cell from the substrate. The cantilever is bent during this process. The arrows indicate the direction of cantilever movement.(Biol ProcedOnline.2004;6: 1–9)/SunneyXie’s Group 谢晓亮2 固定,9博士后,11博士生,2技术员,2访问学者,4本科生2845 cm-1, taken with parallel polarized beams along the x axis (notethe polarization dependence).Probing Single Molecule Dynamics Photon-by-PhotonWe use a confocal microscope to detect the fluorescence signal from a single molecule. Different from the conventional time correlated single photon counting (TCSPC), for each detected fluorescence photon with index, p, we record both the delay time respect to its excitation pulse, τp, and the chronological arrival time tp(see the accompany figure). Instead of binning the detected photon to calculate the fluorescence lifetime, the lifetime correlation function C(t), can be calculated with the novel photon-by-photon correlation method. Such a method provides dynamical information with a high time resolution and a broad range of time scale.。
光漂白(photonic bleaching)是在光照条件下使其发生化学反应或是构象改变,而失去发荧光的特性,就是所谓的漂白.它常用于生物体内扩散速率常数的测定. 光漂白抗性就是抗光漂白性吧~~我是这么理解的。
下面的是搜索的关于绿色荧光蛋白^_^·GFP的发光特性GFP吸收的光谱,最大峰值为395nm(紫外),并有一个峰值为470nm的副峰(蓝光);发射光谱最大峰值为509nm(绿光),并带有峰值为540nm的侧峰(Shouder). GFP的光谱特性与荧光素异硫氰酸盐(FITC)很相似,因此为荧光素FITC设计的荧光显微镜滤光片组合同样适用于GFP观察.尽管450~490nm(蓝光)是GFP的副吸收峰,但由于长波能量低,细胞忍受能力强,因此更适合于活体检测.GFP的性质GFP荧光极其稳定,在激发光照射下,GFP抗光漂白(Photobleaching)能力比荧光素(fluorescein)强,特别在450~490nm蓝光波长下更稳定.GFP需要在氧化状态下产生荧光,强还原剂能使GFP转变为非荧光形式,但一旦重新暴露在空气或氧气中,GFP荧光便立即得到恢复.而一些弱还原剂并不影响GFP 荧光.中度氧化剂对GFP荧光影响也不大,如生物材料的固定,脱水剂戊二酸或甲醛等.GFP融合蛋白的荧光灵敏度远比荧光素标记的荧光抗体高,抗光漂白能力强,因此更适用于定量测定与分析.但因为GFP不是酶,荧光信号没有酶学放大效果,因此GFP灵敏度可能低于某些酶类报告蛋白.由于GFP荧光是生物细胞的自主功能,荧光的产生不需要任何外源反应底物,因此GFP作为一种广泛应用的活体报告蛋白,其作用是任何其它酶类报告蛋白无法比拟的.常用的显微技术共聚焦显微镜原理:共焦显微镜[Confocal Laser Scanning Microscope(CLSM或LSCM)]在反射光的光路上加上了一块半反半透镜(Beam Splitter),将已经通过透镜的反射光折向其它方向,在其焦点上有一个带有针孔(Pinhole)的挡板,小孔就位于焦点处,挡板后面是一个光电倍增管(photomultiplier tube,PMT)。