双水相萃取相图制作实验
- 格式:doc
- 大小:51.00 KB
- 文档页数:2



实验二双水相萃取牛血清蛋白1实验目的与要求1.掌握双水相萃取技术的基本原理和主要影响因素;2.了解制作双水相系统的相图的方法,加深对相图的认识;3.掌握熟悉聚乙二醇(PEG)/硫酸铵体系双水相萃取实验操作;4.掌握分配系数和萃取收率的计算方法。
2 实验原理相图是研究两水相萃取的基础,双水相形成条件和定量关系常用相图来表示。
图1是典型的高聚物-高聚物-水双水相体系的直角坐标相图,两种聚合物A、B以适当比例溶于水就会分别形成有不同组成、度的两相,上相组成用T点表示,下相组成用B点表示,由图1可知上下相所含高聚物有所偏重,上相主要含B,下相主要含A。
曲线TCB称为结线,直线TMB称为系线。
结线上方是两相区,下方为单相区,若配比取在曲线上,则混合后,溶液恰好从澄清变为混浊。
组成在系线上的点,分为两相后,其上下相组成分别为T和B,T、B量的多少服从相图的杠杆定律。
即T和B相质量之比等于系线上MB与MT的线段长度之比。
又由于两相密度相差很小,故上下相体积之比也近似等于系线上MB与MT线段长度之比。
图1 A-B-水双水相体系相图双水相系统分配系数的影响因素包括系统本身的因素如系统组成、聚合物分子量、聚合物浓度、盐和离子强度、pH等,以及目标产物的性质如疏水作用、电荷、等电点和分子量等。
利用双水相技术可以获得特定蛋白质和生物大分子的最适宜分离的相系统和最优分配。
本实验采用PEG/硫酸铵双水相体系萃取牛蛋白血清。
3实验试剂及仪器仪器:紫外可见分光光度计,电子天平,离心机,旋窝混合仪,滴定管,大试管,刻度离心试管,移液管,注射器,烧杯。
试剂:50%PEG溶液,硫酸铵固体,40%硫酸铵溶液,牛血清蛋白,双缩脲试剂。
4实验操作4.1P E G2000-硫氨酸双水相体系相图的测定(1)取50%的PEG2000溶液(w/v)10ml于大试管中;(2)用40%的硫酸铵溶液(w/v)装入滴定管中向大试管中滴加,每滴加1或2或3滴后,将大试管放到漩涡混合器上振荡并观察试管内溶液的澄清程度,直到试管内液体出现浑浊为止,记录硫酸铵消耗的体积。

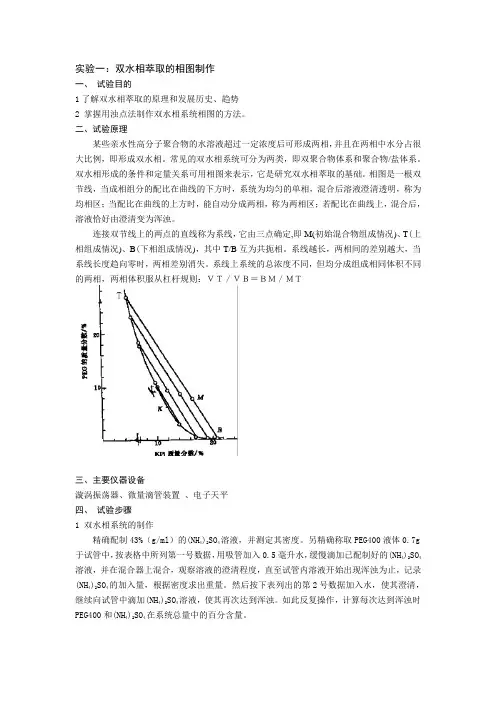
实验一:双水相萃取的相图制作一、试验目的1了解双水相萃取的原理和发展历史、趋势2 掌握用浊点法制作双水相系统相图的方法。
二、试验原理某些亲水性高分子聚合物的水溶液超过一定浓度后可形成两相,并且在两相中水分占很大比例,即形成双水相。
常见的双水相系统可分为两类,即双聚合物体系和聚合物/盐体系。
双水相形成的条件和定量关系可用相图来表示,它是研究双水相萃取的基础。
相图是一根双节线,当成相组分的配比在曲线的下方时,系统为均匀的单相,混合后溶液澄清透明,称为均相区;当配比在曲线的上方时,能自动分成两相,称为两相区;若配比在曲线上,混合后,溶液恰好由澄清变为浑浊。
连接双节线上的两点的直线称为系线,它由三点确定,即M(初始混合物组成情况)、T(上相组成情况)、B(下相组成情况),其中T/B互为共扼相。
系线越长,两相间的差别越大,当系线长度趋向零时,两相差别消失。
系线上系统的总浓度不同,但均分成组成相同体积不同的两相,两相体积服从杠杆规则:VT/VB=BM/MT三、主要仪器设备漩涡振荡器、微量滴管装置、电子天平四、试验步骤1 双水相系统的制作精确配制43%(g/ml)的(NH4)2SO4溶液,并测定其密度。
另精确称取PEG400液体0.7g 于试管中,按表格中所列第一号数据,用吸管加入0.5毫升水,缓慢滴加已配制好的(NH4)2SO4溶液,并在混合器上混合,观察溶液的澄清程度,直至试管内溶液开始出现浑浊为止,记录(NH4)2SO4的加入量,根据密度求出重量。
然后按下表列出的第2号数据加入水,使其澄清,继续向试管中滴加(NH4)2SO4溶液,使其再次达到浑浊。
如此反复操作,计算每次达到浑浊时PEG400和(NH4)2SO4在系统总量中的百分含量。
2 相图的绘制以PEG400的重量百分比浓度为纵坐标,(NH4)2SO4的重量百分比浓度为横坐标作图,即得到一条双节线的相图。
五、注意事项1、微量滴定管在使用前必须先洗涤干净,否则容易产生气泡或发生堵塞现象。

双水相萃取地豆蛋白实验设计方案史庚林一、引言地豆又名金果,长寿果、长果、番豆、金果花生、无花果、地果、地豆、唐人豆、花生豆、落花生和长生果。
花生滋养补益,有助于延年益寿,所以民间又称之为“长生果”,并且和黄豆一同被誉为“植物肉”、“素中之荤”。
花生的营养价值比粮食高,可以与鸡蛋、牛奶、肉类等一些动物性食物媲美。
它含有大量的蛋白质和脂肪,特别是不饱和脂肪酸的含量很高,很适宜制作各种营养食品。
双水相萃取系统通常是由水溶性的两种聚合物或一种水溶性聚合物与一种盐和水构成的三组分双相体系。
近年来, 该萃取技术受到研究者的青睐, 尤其是它对蛋白质、酶、核酸等生物活性物质的分离纯化等方面受到广泛重视, 双水相萃取在提取生物活性物质方面有如下优点: 含水量高;分相时间短; 界面张力小; 不存在有机溶剂残留问题; 大量杂质能与所有固体物质一同除去; 易于工程放大和连续操作 ; 更重要的是双水相萃取避免了传统液- 液萃取中生物活性物质与有机溶剂的直接接触, 保护了其活性, 有研究表明聚合物对颗粒或生物分子的结构不但没有破坏作用, 反而有稳定作用。
本实验以PEG/ ( NH4)2SO4双水相体系为考察对象, 比较了不同浓度的PEG 和( NH4 )2SO4组成的双水相体系对地豆蛋白的萃取效果, 并考察了影响萃取效果的各种因素。
二、实验仪器与试剂1 仪器:离心机,电热恒温水浴锅,分光光度计,磁力搅拌器,电子天平,超声波仪2 试剂:PEG( 分子量分别为600、1000,2000、4000、6000) , 硫酸铵,Nacl,NaH2PO4,K2HPO4,考马斯亮蓝(G-250)三、方法1 粗蛋白的提取1.1 用前面超声波处理的方法提取蛋白质1.2 用考马斯亮蓝法测定蛋白质的含量2 不同分子量PEG 的双水相萃取的相图作用浊点法制作相图。
称取2g50%PEG溶液,加1mL蒸馏水,计总质量。
向体系中加40%(NH4)2SO4至浑浊,测质量,然后再加1mL蒸馏水,溶液马上澄清,重复前面步骤,测出多组数据,作出相图。

实验二_PEG-磷酸盐双水相体系相图的绘制及萃取分配平衡实验实验二PEG/磷酸盐双水相体系相图的绘制及萃取分配平衡实验一、实验目的1.掌握双水相相图的制作方法。
2.掌握双水相萃取过程中分配系数的测定。
二、实验原理常用的形成双水相系统的成相组分有可由两种高聚物,或一种高聚物和一种无机盐。
高聚物与高聚物形成两相的原因是高聚物的不相容性,高聚物与盐形成两相的原因是无机盐的盐析作用。
两水相的成相条件和定量关系,用相图表示,α-淀粉酶能将淀粉分子链中的α-1,4葡萄苷键随机切断成长短不一的短链糊精、少麦芽糖和葡萄糖,而使淀粉对碘呈蓝紫色的特异性反应逐渐消失,呈红棕色,其颜色消失的速度与酶活性有关,可通过固定反应后的吸光度计算其酶活力。
三、仪器和药品PEG (1000,2000,4000,6000),NaH2PO4,K2HPO4?12H2O,NaCl,柠檬酸,碘,碘化钾各,α-淀粉酶。
分光光度计,离心机,恒温水浴锅(温度计),量筒,烧杯,移液管,试管,试管架,试剂瓶。
四、实验步骤20 g/L可溶性淀粉溶液:称取可溶性淀粉(以绝干计)2.00 g,精确至0.001 g,用水调成浆状物,搅动下缓缓倾入70 mL沸水中,然后以30 mL水分几次冲洗装淀粉的烧杯,洗液并入其中,加热至完全透明,冷却,定容至100 mL,此溶液需要当天配制。
1. 将一种分子量的40%的PEG 和无机盐母液制成一定浓度原液:准确量取5 mL的一种PEG 原液加入到50 mL或100 mL的量筒中,称重。
用移液管不断加入无机盐原液,混合,直至试管开始出现混浊并分层为止,称重,计算加入无机盐的量,算出PEG 和无机盐在系统中的重量百分浓度,再加入适量水(1~5 mL),使体系澄清,计量加入的水,并继续加入无机盐,使系统再次变混浊并分层为止,如此反复操作。
计算达到混浊时PEG 和无机盐在系统中的重量百分含量,以磷酸盐浓度为横坐标、PEG浓度为纵坐标,绘出PEG和磷酸盐的双节线相图。

吉林化工学院生物分离工程专业实验报告课程类型:生物分离工程实验实验类型:设计型实验学年学期:2015-2016学年第一学期试验时间: 2015.10.8-2015.11.20 班级:学号:实验者:合作者:指导教师:提交日期:2015年11月29日吉林化工学院Jilin Institute of Chemical Technology两水相萃取蛋白质的相图制作实验摘要:目前在生化工业中常用的分离生物活性物质的方法,如有机溶剂萃取法等存在着一定的缺陷,例如由于有相的变化或有机溶剂的变性作用使得生物活性物质易于失活;在水—有机溶剂萃取中,界面上具有很强的界面张力,可破坏生物大分子的结构。
双水相萃取技术的发展趋势还体现在与其他生物分离技术的结合以及萃取机理和热力学模型的优化上。
关键词:双水相萃取,蛋白质,分离纯化分离纯化出高纯度有生物活性的蛋白质一直是项艰巨的工作。
由于蛋白质的市场价格昂贵,提高回收率能带来巨大的经济效益,所以有关蛋白质在分离纯化中的失活及其对策在近年来受到很大的关注。
双水相萃取是通过溶质在两水相之间分配系数的差异而进行萃取的技术,其应用于蛋白质的分离纯化具有以下优势:体系含水量高.可达80%以上。
萃取环境和操作条件温和,蛋白质在其中不易失活;界面张力远远低于水一有机溶剂两相体系的界面张力,有助于强化相际闸的质量传递;易于按比例放大和进行连续性操作等⋯。
正是由于双水相萃取技术的诸多优势,现已被广泛用于蛋白质的分离纯化,取得了很好的成效。
近年来,双水相萃取技术的分离对象进一步扩大,已包括了多肽、氨基酸、植物有效成分、重金属离子和抗生素等。
1 双水相萃取技术在生物分离工程中的应用1956年,瑞典Lund大学学者A1bertson首次利用双水相萃取技术分离生物分子,开始对A邛s进行比较系统的研究,测定了许多ATPs的相图,考察了蛋白质、核酸、病毒、细胞及细胞颗粒在ATPS中的分配行为,为发展双水相萃取技术奠定了坚实的基础。



双水相萃取一实训目的掌握双水相萃取的原理及方法。
学习双水相萃取相图的制作。
二实训原理双水相萃取法(aqueous two-phase extraction)是利用物质在互不相溶的两水相间分配系数的差异来进行萃取的方法。
高聚物PEG和盐(硫酸铵)形成的互不相溶的两相,倒入牛奶中,蛋白质富集在一相中。
三实训仪器和药品试管,离心机,天平,离心管,三角瓶,滴定管,聚乙二醇2000(PEG2000),硫酸铵,牛奶。
四实训步骤1 PEG2000-硫酸铵双水相体系相图的测定(1)取10%PEG2000溶液10mL于三角瓶中;(2)用40%硫酸铵溶液装入滴定管中滴定至三角瓶中溶液出现浑浊,记录硫酸铵消耗的体积。
加入1mL水使溶液澄清,继续用硫酸铵滴定至浑浊,重复7~8次,记录每次硫酸铵消耗的体积,计算每次出现浑浊时体(3)以硫酸铵的浓度(W/V)为横坐标,PEG浓度(W/V)为纵坐标,绘制出PEG2000-硫酸铵双水相体系相图。
2PEG2000-硫酸铵双水相体系的配制自行在相图中双水相区选择一个点,根据该点的PEG2000浓度和硫酸铵浓度,分别量取适量的10%PEG2000溶液和硫酸溶液,混合均匀后以2500rpm/min离心5min后分相,得到双水相体系(总量约3mL)。
3利用PEG2000-硫酸铵双水相体系萃取分离牛奶中的蛋白质取1mL 牛奶装入上述双水相体系中,搅拌均匀,于2500rpm/min 离心5min,静置分层,分别量取上下相的体积。
萃取完成后,如果牛奶中的蛋白质不能被萃取到上相,则证明所选的1PEG2000 与硫酸铵浓度不对,应重新选择。
五结果与讨论1如果正确地绘制相图。
2如何根据相图配制双水相体系,并对混合物进行分离。
2。
双水相萃取相图的绘制1.实验目的⑴掌握绘制双水相相图的方法⑵理解双水相形成条件和定量关系2.实验原理双水相是指某些高聚物之间或高聚物与无机盐之间在水中以一定的浓度混合而形成互不相容的两相,由于溶质在两相间的分配系数的差异而进行萃取的方法即为双水相萃取。
双水相形成条件和定量关系常用相图来表示(见图1)。
成相物质都能与水无限混合,当它们的组成位于曲线的上方时(用M点表示)体系就会分成两相,分别有不同的组成密度,轻相(或称上相)组成用T点表示,重相(或称下相)组成用B点表示,T、B点称为节点。
直线TMB称为系线,是相图的重要特征,关系到相的平衡组成。
所有组成在系线上的点,分成两相后,其上下相组成均分别为T、B,但是其体积比(V T/V B)不同。
相体积比可由相图上线段比(BM/MT)估算,即服从杠杆规则。
本实验绘制PEG/(NH4)2SO4体系双水相相图。
图1 双水相体系相图3.实验材料及仪器PEG1000原液(0.6g/mL,w/w=56.926%,密度1.054);PEG2000原液(0.4g/mL,密度1.02);硫酸铵原液(0.43g/mL,密度1.2)。
4.实验方法准确称取2.0mLPEG原液,加入25 mL具塞刻度试管中,然后逐滴加入硫酸铵原液,混合,直至试管中开始出现混浊为止,记录加入硫酸铵量,算出PEG和硫酸铵在系统中的质量百分浓度,再向试管中加入适量水(0.2~0.5~1.0 mL),使体系变澄清,记录加入水的量,并继续加入硫酸铵,使体系再次变混浊,如此反复操作二十几次,计算达到混浊时PEG 和硫酸铵在系统中的质量百分含量,得出不同相对分子量的PEG和硫酸铵的双节线相图节点。
以上述试验所得结点绘制出不同相对分子量的PEG/(NH4)2SO4体系双水相相图。
5.数据处理表1 相图节点数据序号PEG质量(g)体系中盐溶液(mL)盐质量(g)体系加水量(g)体系总质量(g)PEG质量分数(w/w)盐质量分数(w/w)1 02 0.33 0.5……………………n 1.5双水相萃取牛血清白蛋白1.实验目的⑴掌握PEG/无机盐体系双水相萃取蛋白质的方法⑵了解影响蛋白质在双水相体系中分配行为的主要参数2.实验原理双水相是指某些高聚物之间或高聚物与无机盐之间在水中以一定的浓度混合而形成互不相容的两相,由于溶质在两相间的分配系数的差异而进行萃取的方法即为双水相萃取。
实验二PEG/磷酸盐双水相体系相图的绘制及萃取分配平衡实验一、实验目的1.掌握双水相相图的制作方法。
2.掌握双水相萃取过程中分配系数的测定。
二、实验原理常用的形成双水相系统的成相组分有可由两种高聚物,或一种高聚物和一种无机盐。
高聚物与高聚物形成两相的原因是高聚物的不相容性,高聚物与盐形成两相的原因是无机盐的盐析作用。
两水相的成相条件和定量关系,用相图表示,α-淀粉酶能将淀粉分子链中的α-1,4葡萄苷键随机切断成长短不一的短链糊精、少麦芽糖和葡萄糖,而使淀粉对碘呈蓝紫色的特异性反应逐渐消失,呈红棕色,其颜色消失的速度与酶活性有关,可通过固定反应后的吸光度计算其酶活力。
三、仪器和药品PEG (1000,2000, 4000, 6000),NaH2PO4,K2HPO4•12H2O,NaCl,柠檬酸,碘,碘化钾各,α-淀粉酶。
分光光度计,离心机,恒温水浴锅(温度计),量筒,烧杯,移液管,试管,试管架,试剂瓶。
四、实验步骤20 g/L可溶性淀粉溶液:称取可溶性淀粉(以绝干计)2.00 g,精确至0.001 g,用水调成浆状物,搅动下缓缓倾入70 mL沸水中,然后以30 mL水分几次冲洗装淀粉的烧杯,洗液并入其中,加热至完全透明,冷却,定容至100 mL,此溶液需要当天配制。
1. 将一种分子量的40%的PEG 和无机盐母液制成一定浓度原液:准确量取5 mL的一种PEG 原液加入到50 mL或100 mL的量筒中,称重。
用移液管不断加入无机盐原液,混合,直至试管开始出现混浊并分层为止,称重,计算加入无机盐的量,算出PEG 和无机盐在系统中的重量百分浓度,再加入适量水(1~5 mL),使体系澄清,计量加入的水,并继续加入无机盐,使系统再次变混浊并分层为止,如此反复操作。
计算达到混浊时PEG 和无机盐在系统中的重量百分含量,以磷酸盐浓度为横坐标、PEG浓度为纵坐标,绘出PEG和磷酸盐的双节线相图。
2. 双水相萃取分配平衡实验根据相图在分层临界点处,按照相应的PEG无机盐和水(含有相应的酶)的体积比配制两相,等待静置分层分别得到两相的体积,并测定酶活力,求出K值:K=C上相酶活/ C下相酶活称取α-淀粉酶,精确至0.0002 g,加水稀释,过滤,取澄清滤液供测定用。
双⽔相相图制作实验⼀双⽔相相图的制作⼀、实验⽬的1.了解双⽔相系统成相的原理和⽅法。
2.学习双⽔相相图的制作。
3.掌握双⽔相溶液配制与双⽔相萃取的操作。
⼆、实验原理双⽔相系统中使⽤的双⽔相是由两种互不相溶聚合物(如聚⼄⼆醇(PEG)与葡聚糖(Dextran))或者互不相溶的盐溶液和聚合物溶液(如PEG与(NH4)2SO4)组成。
双⽔相系统的制备,⼀般是将两种溶质分别配制成⼀定浓度的⽔溶液,然后将两种溶液按照不同的⽐例混合,静⽌⼀段时间,当两种溶质的浓度超过某⼀浓度范围时,就会产⽣两相。
两⽔相形成的条件和定量关系可⽤相图来表⽰,它是⼀根双节线,当成相组分的配⽐取在曲线下⽅时,系统为均匀的单相,混合后,溶液澄清透明,称为均相区;在曲线的上⽅时,能⾃动分为两相,称为两相区;若配⽐取在曲线上,则混合后,溶液恰好从澄清变为浑浊。
相图是研究两⽔相萃取的基础。
双⽔相萃取与⽔-有机相萃取的原理相似,都是依据物质在两相间的选择性分配,但萃取体系的性质不同。
当物质进⼊双⽔相体系后,由于表⾯性质、电荷作⽤和各种⼒(如憎⽔键、氢键和离⼦键等) 的存在和环境的影响,使其在上、下相中的浓度不同。
对于某⼀物质,只要选择合适的双⽔相体系,控制⼀定的条件,就可以得到合适的分配系数,从⽽达到分离纯化之⽬的。
双⽔相萃取受许多因素的影响,如⾼分⼦聚合物种类、分⼦量及组成、⽆机盐种类及组成,pH等。
本实验选⽤PEG—硫酸盐为相系统,点浊法绘制相图。
三、试剂及仪器仪器:天平、离⼼机、刻度试管、吸管、分光光度计、试管、移液管等。
药品:PEG6000、硫酸铵、蒸馏⽔等。
四、实验内容(⼀)PEG4000-硫酸铵双⽔相体系相图的测定1. 取25%PEG4000溶液(w/v)10ml 于三⾓瓶中。
2. ⽤40%硫酸铵溶液(w/v)装⼊滴定管中滴定⾄三⾓瓶中溶液恰好浑浊,记录硫酸铵消耗的体积。
加⼊1ml ⽔使溶液澄清,继续⽤硫酸铵滴定⾄恰好浑浊,重复7次记录每次硫酸铵消耗的体积,计算每次出现浑浊时体系中PEG和硫酸铵的浓度(w/v),并填⼊表1中。
实验一:双水相萃取的相图制作
一、试验目的
1了解双水相萃取的原理和发展历史、趋势
2 掌握用浊点法制作双水相系统相图的方法。
二、试验原理
某些亲水性高分子聚合物的水溶液超过一定浓度后可形成两相,并且在两相中水分占很大比例,即形成双水相。
常见的双水相系统可分为两类,即双聚合物体系和聚合物/盐体系。
双水相形成的条件和定量关系可用相图来表示,它是研究双水相萃取的基础。
相图是一根双节线,当成相组分的配比在曲线的下方时,系统为均匀的单相,混合后溶液澄清透明,称为均相区;当配比在曲线的上方时,能自动分成两相,称为两相区;若配比在曲线上,混合后,溶液恰好由澄清变为浑浊。
连接双节线上的两点的直线称为系线,它由三点确定,即M(初始混合物组成情况)、T(上相组成情况)、B(下相组成情况),其中T/B互为共扼相。
系线越长,两相间的差别越大,当系线长度趋向零时,两相差别消失。
系线上系统的总浓度不同,但均分成组成相同体积不同的两相,两相体积服从杠杆规则:VT/VB=BM/MT
三、主要仪器设备
漩涡振荡器、微量滴管装置、电子天平
四、试验步骤
1 双水相系统的制作
精确配制43%(g/ml)的(NH4)2SO4溶液,并测定其密度。
另精确称取PEG400液体0.7g 于试管中,按表格中所列第一号数据,用吸管加入0.5毫升水,缓慢滴加已配制好的(NH4)2SO4溶液,并在混合器上混合,观察溶液的澄清程度,直至试管内溶液开始出现浑浊为止,记录(NH4)2SO4的加入量,根据密度求出重量。
然后按下表列出的第2号数据加入水,使其澄清,继续向试管中滴加(NH4)2SO4溶液,使其再次达到浑浊。
如此反复操作,计算每次达到浑浊时PEG400和(NH4)2SO4在系统总量中的百分含量。
2 相图的绘制
以PEG400的重量百分比浓度为纵坐标,(NH4)2SO4的重量百分比浓度为横坐标作图,即得到一条双节线的相图。
五、注意事项
1、微量滴定管在使用前必须先洗涤干净,否则容易产生气泡或发生堵塞现象。
洗涤时,不用去污粉,可用铬酸洗液或洗涤液先浸泡一段时间后,用一根细长的刻度移液管刷刷洗刻度处,最后用蒸馏水反复冲洗数次。
2、清洗干净的微量滴定管必须先用蒸馏水试漏,如有漏液,可涂少量凡士林(过量的凡士林会堵塞滴定管)。
试漏成功的滴定管要润洗两次,即注液杯、支管、刻度管和出液尖嘴用滴定液洗涤两遍。
3、由于支管拐弯处易藏气泡,一般待滴定液放满刻度管后打开支管旋塞用洗耳球将溶液中气泡刚好吹入贮液杯中即可,也可缓慢倾斜滴定管使气泡从口部溢出。
4、滴定过程要注意爱护仪器,轻拿轻放。
用(NH4)2SO4滴定时,在接近滴定终点左右时一定要每滴一滴,便彻底混匀后方可滴定下一滴。
六、思考问题
1 双水相萃取中相图有何意义?
2 双水相萃取在分离生物大分子物质时有何意义?。