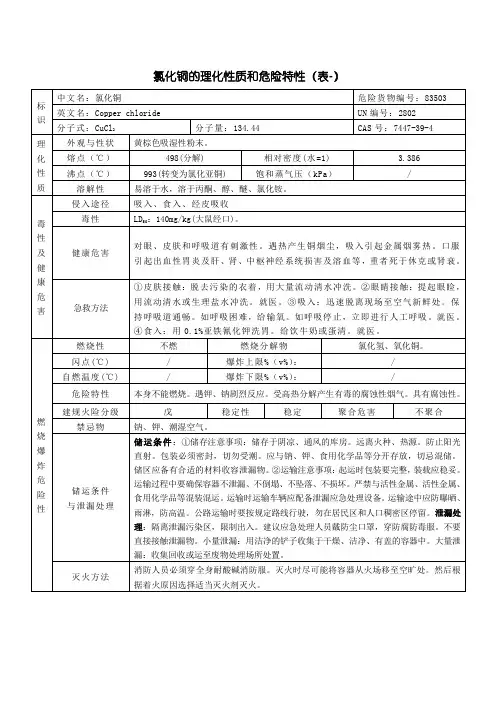
氯化铜的颜色
- 格式:doc
- 大小:28.00 KB
- 文档页数:2

碱式氯化铜化学式碱式氯化铜的化学式为Cu2(OH)3Cl,它是一种由铜、氢氧化物和氯化物组成的化合物。
由于铜元素的存在,碱式氯化铜具有良好的导电性和催化性能,广泛应用于工业和实验室中。
下面将从其物理性质、化学性质和应用方面进行介绍。
一、物理性质。
1.外观和颜色:碱式氯化铜是一种淡绿色固体,具有非常细密的结构。
2.热稳定性:在常态下,碱式氯化铜的热稳定性一般。
但当在氧化性环境中,碱式氯化铜的热稳定性会降低,容易受到氧化,从而失去其特性。
3.溶解性:碱式氯化铜能够在水中溶解。
当然了,碱式氯化铜在碱性或酸性环境下溶解性大不同。
在酸性环境下,碱式氯化铜溶解的较快。
而在碱性环境下,则很难溶解。
二、化学性质。
1.物理性质:碱式氯化铜有多种结构形式,物理性质也会因结构的不同有所差异。
2.氧化还原性:碱式氯化铜含有铜元素,因此具有较强的氧化还原性。
它在一定条件下可以发生氧化反应,例如和浓硝酸反应时,会释放出氧气。
3.催化剂:碱式氯化铜可以作为一种重要的催化剂,参与多种有机反应或气相反应。
而且碱式氯化铜比铜氧化物还有更高的催化活性。
三、应用方面。
1.计算机元件:碱式氯化铜有很高的导电性,因此常被用来制造电子元件,如计算机中的集成电路等。
2.催化剂:碱式氯化铜在体系中作为催化剂的应用广泛,如在合成甲酸酯时,碱式氯化铜可以作为催化剂,促进反应进行。
3.电器设备:碱式氯化铜添加到电器设备中,可以起到减少环境电磁波的作用,保护电器设备,增强电磁兼容性。
总之,碱式氯化铜具有多种物理化学性质和广泛的应用价值,在工业和实验室中得到了广泛应用。

氯化铜晶体
【英文名称】Copper(II) Chloride
【分子式】CuCl2
【分子量】134.45
【CAS号】7447-39-4
【物理性质】黄色或棕色固体,mp 620 ℃,d 3.386 g/cm3,二水合氯化铜为蓝色粉末或晶体,mp 100℃,d 2.51 g/cm3。
无水氯化铜溶于水、醇、丙酮。
二水合氯化铜溶于水、甲醇、乙醇,在丙酮和乙酸乙酯中部分溶解,微溶于乙醚。
【制备和商品】国内外试剂公司均有销售,商品化试剂有无水氯化铜、水合氯化铜以及吸附在氧化铝上的含30%氯化铜试剂。
【注意事项】具有吸湿性,应保存在阴凉干燥处。
在有机合成中,氯化铜可以作为氯化试剂、氧化试剂和路易斯酸试剂。
氯化铜是一个对多种官能团化合物有效的氯化试剂,能实现羰基化合物的α-氯化反应。
该反应通常在含有氯化锂的极性溶剂中进行。
使用丁醛在甲醇溶剂反应时,可以得到α-氯代缩醛。

智能手机用于氯化铜溶液颜色变化的实验探究作者:卢运许燕红覃稔来源:《化学教学》2019年第08期摘要:用智能手机设计的简易色度仪对氯化铜溶液在不同浓度、不同温度以及存在其他无色离子的情况下的颜色进行探究,将颜色反映在图像的RGB值上。
结果显示,拍摄得到的氯化铜溶液颜色图像的RGB值与氯化铜溶液的浓度和温度成线性关系;氯化铜稀溶液呈蓝色,氯化铜浓溶液呈绿色,浓度1.2mol/L为氯化铜溶液颜色由蓝色系变成绿色系的理论变色浓度;氯化铜稀溶液温度升高时,颜色将由蓝色变成绿色;加入Cl-离子,溶液绿色加深,加入Na+、NO ;-3、 NH ;+4等无关离子溶液颜色不变。
关键词:氯化铜; 溶液颜色; 图像RGB值; 智能手机; 实验探究文章编号: 1005-6629(2019)8-0080-05 ; ; ; ; ; ;中图分类号: G633.8 ; ; ; ; ; ;文献标识码: B1 ;问题的提出在浙教版初中化学教材“探究酸的性质”[1]中介紹了“探究稀盐酸和稀硫酸与金属氧化物(氧化铜)的反应”的实验。
该实验在实际教学中进行分组实验后,要求学生填写观察到的实验现象与结论。
探究稀硫酸与氧化铜反应时,所有学生得到的实验现象几乎都是“黑色粉末逐渐消失溶液由无色变成蓝色”;但是探究稀盐酸与氧化铜反应时,部分学生得到的实验现象为“黑色粉末逐渐消失,溶液由无色变成蓝色”,而部分学生得到的实验现象却是“黑色粉末逐渐消失,溶液由无色变成绿色”。
对同一实验同样的实验步骤,出现两种不同的实验结论,其背后的影响因素及其变色规律有待通过实验进行探究。
对于氯化铜溶液颜色的探究,传统的实验方法通常是配制一定的不同浓度的氯化铜溶液,在相同温度下观察其颜色,并在此基础上找出其变色规律;在探究温度对氯化铜溶液颜色的影响时,通常是配制相同浓度的氯化铜溶液,在不同温度下观察其颜色。
这种实验方法由于实验器材和条件的限制,加上肉眼对颜色的视觉判断存在较大误差,未能从定量的角度研究问题,得到的实验结果往往缺乏可信度,因此,寻找一种更为科学可靠的实验方式,是得出可信度更高的实验结论的关键。

溶液:1.一般为无色2.含铜离子的溶液:二价铜离子呈蓝色或者蓝绿色,而氯化铜浓溶液,硝酸铜浓溶液呈绿色:通常,铜离子Cu2+在水溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的,水合铜离子呈蓝色,所以我们常见的铜盐溶液大多呈蓝色。
而在氯化铜的溶液中,不仅有水合铜离子[Cu(H2O)4]2+,还有氯离子Cl-与铜离子结合形成的四氯合铜络离子[CuCl4]2-,该离子的颜色为黄色。
根据光学原理我们知道,蓝色和黄色的混合色为绿色,这就是为什么我们常见的一般浓度的氯化铜溶液呈绿色的原因。
如果我们向氯化铜溶液中加水,则溶液中氯离子浓度变小,水合铜离子相对增多,溶液主要呈现水合铜离子的颜色(蓝色)。
所以我们见到的氯化铜稀溶液一般呈蓝色。
同样道理,在硝酸跟铜的反应中,稀硝酸与铜反应所得的溶液呈蓝色,而浓硝酸与铜反应所得溶液呈绿色。
这是因为,浓硝酸与铜反应时,产生大量的二氧化氮气体,二氧化氮溶解在溶液中呈黄色,二氧化氮的黄色跟水合铜离子的蓝色混合就出现了我们看到的绿色。
3.含铁离子的溶液:水合铁离子呈浅紫色,若有水解,则为黄色;水合亚铁离子呈浅绿色4.含锰离子的溶液:水合锰离子:肉红色高锰酸根离子:紫红色锰酸根离子:绿高锰酸根离子紫红色锰酸根离子绿色二价锰离子淡粉色四价锰(二氧化锰)黑色5.其他离子:重铬酸根离子橙色铬酸根离子黄色粉末一般为白色1.单质绝大少数单质:雪白色。
Cu 紫红 O2 无 Au 黄 S 黄 B 黄或黑 F2 淡黄绿C(石墨黑 Cl2 黄绿 C(金刚石)无 Br2 红棕 Si 灰黑 I2 紫黑 H2 无有数气体无 P 白、黄、红棕。
2.氢化物 LiH等金属氢化物:白; NH3等非金属氢化物:无。
3.氧化物大少数非金属氧化物:无;次要破例: NO2 棕红 N2O5和P2O5 白 N2O3 暗蓝 ClO2 黄大少数主族金属的氧化物:白次要破例: Na2O2 浅黄 PbO 黄 K2O 黄 Pb3O4 红 K2O2 橙 Rb2O 亮黄Rb2O2 棕 Cs2O 橙红 Cs2O2 黄大少数过渡元素氧化物有颜色: MnO 绿 CuO 黑 MnO2黑 Ag2O 棕黑FeO 黑 ZnO 白 Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红V2O5 橙沉淀:1.一般为白色2.含铜离子的沉淀为蓝色3.含铁离子的沉淀为红褐色。

一些特殊物质的颜色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)蓝色:CuSO4•5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、液态固态O2(淡蓝色)红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)黄色:硫磺(单质S)、含Fe3+ 的溶液(棕黄色)绿色:FeSO4•7H2O、含Fe2+ 的溶液(浅绿色)无色气体:N2、CO2、CO、O2、H2、CH4有色气体:Cl2(黄绿色)、NO2(红棕色)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2有臭鸡蛋气味:H2S常见一些变化的判断:①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl (就这两种物质)②蓝色沉淀:Cu(OH)2、CuCO3③红褐色沉淀:Fe(OH)3Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐,如碳酸钙(白色)、碳酸钡(白色)⑤沉淀能溶于酸但没气体放出的:不溶的碱6,能溶于盐酸或稀HNO3的白色沉淀有CaCO3,BaCO3;不溶于稀HNO3的白色沉淀,有AgCl、BaSO4肯定是找题眼也就是突破口一般找到了突破口这个题就可以顺势做下来了。
比如遇到无色刺激性气味之类的肯定是氨气,让石灰水变浑肯定是CO2,黄色溶液是氯化铁,浅绿色的是氯化亚铁,蓝色的是硫酸铜或氯化铜(有时候也说氯化铜是蓝绿色的)。
不溶解的沉淀是氯化银,硫酸钡;溶解的是碳酸钡,碳酸钙。
红褐色沉淀是氢氧化铁,蓝色沉淀是氢氧化铜。
、找到了题眼,就可以顺着那条线,根据方程式的反应物啊,条件啊之类的推断出整个题中的物质。
做这种题,周密的思维是必须的,因为有时候两种物质不共存,这是通过大量的训练才能培养出来的白色沉淀有碳酸钙,氢氧化镁,硫酸钡,氯化银,碳酸钡。
红色固体单质有磷(初中阶段很少考),铜(一般都指铜)。
黑色粉末有氧化铜,二氧化锰,炭粉。

焰色反应实验报告焰色反应实验报告引言:焰色反应是一种常见的化学实验方法,通过观察物质在燃烧时所产生的颜色变化,可以初步判断该物质中所含的金属元素。
本次实验旨在通过焰色反应,探究不同金属离子在燃烧时所产生的特定颜色及其原理。
实验材料与方法:实验所需材料包括:盐酸、硝酸、硫酸、氯化钠、氯化钾、氯化钡、氯化铜、氯化锶、氯化钴、氯化钡等。
实验步骤如下:1. 将每种金属盐溶解于盐酸、硝酸和硫酸中,制备成10%浓度的溶液。
2. 在实验室安全条件下,取少量溶液倒入石英坩埚中。
3. 用酒精灯将溶液加热至燃烧状态,观察产生的火焰颜色。
4. 将实验结果记录下来,进行分析和总结。
实验结果与讨论:在实验过程中,我们观察到不同金属盐燃烧时产生了不同的火焰颜色。
以下是我们实验结果的总结:1. 氯化钠:产生明亮的黄色火焰。
2. 氯化钾:产生紫色火焰。
3. 氯化钡:产生明亮的绿色火焰。
4. 氯化铜:产生明亮的蓝绿色火焰。
5. 氯化锶:产生明亮的红色火焰。
6. 氯化钴:产生粉红色火焰。
通过对实验结果的观察和分析,我们可以得出以下结论:1. 火焰颜色的产生是由金属离子的激发态电子跃迁所引起的。
当金属盐燃烧时,金属离子被激发到高能级,随后电子从高能级跃迁回低能级时,会释放出特定波长的光,形成特定的颜色。
2. 氯化钠的黄色火焰是由钠离子的电子跃迁引起的。
钠离子的激发态电子跃迁产生的光波长在可见光谱范围内,因此我们能够看到明亮的黄色火焰。
3. 氯化钾的紫色火焰是由钾离子的电子跃迁引起的。
钾离子的激发态电子跃迁产生的光波长较短,超出了人眼可见的紫外光谱范围,但我们可以通过荧光屏或摄像机来观察到紫色的火焰。
4. 氯化钡的绿色火焰是由钡离子的电子跃迁引起的。
钡离子的激发态电子跃迁产生的光波长在可见光谱范围内,因此我们能够看到明亮的绿色火焰。
5. 氯化铜的蓝绿色火焰是由铜离子的电子跃迁引起的。
铜离子的激发态电子跃迁产生的光波长在可见光谱范围内,因此我们能够看到明亮的蓝绿色火焰。

氯化铜熔点
氯化铜是一种无机化合物,其化学式为CuCl2。
它是一种白色晶体,易溶于水和醇类溶剂。
氯化铜在工业上广泛用作催化剂、杀菌剂和颜料等用途。
氯化铜的熔点是在771摄氏度左右,在高温下它会分解释放出氯气和金属铜。
氯化铜在熔化时会发生吸热反应,因此熔化过程需要提供足够的热量。
氯化铜的熔点可以通过多种方法测定,例如热差示扫描量热法、差热分析法和热重分析法等,这些方法可以给出高精度的熔点数据。
总的来说,氯化铜的熔点是771摄氏度,它在高温下会分解释放出氯气和金属铜。
测定氯化铜熔点的方法有很多种,可以通过热差示、差热分析和热重分析等方法来获得高精度的数据。
- 1 -。
电解氯化铜溶液方程式介绍电解是指通过外加电压在溶液中引发氧化还原反应的过程。
在电解过程中,正极发生氧化反应,负极发生还原反应,并伴随着离子在溶液中的迁移。
本文将探讨电解氯化铜溶液的方程式及相关内容。
氯化铜的性质氯化铜是一种无机化合物,化学式为CuCl2。
它是一种蓝绿色晶体,可溶于水。
在溶液中,氯化铜会解离成Cu2+和2Cl-离子。
电解氯化铜溶液的实验为了了解电解氯化铜溶液的方程式,我们可以进行实验来观察和记录反应过程。
下面是一个简单的实验步骤:1.准备一个电解槽,将两块电极(一块铜电极作为阳极,一块不锈钢电极作为阴极)插入溶液中。
2.在电解槽中加入氯化铜溶液,制定合适的浓度和体积。
3.打开电源,使阳极与正电极相连,阴极与负电极相连。
4.施加适当的电压,启动电解过程。
5.观察和记录电解过程中的现象和变化。
电解过程及方程式在电解氯化铜溶液的过程中,发生了一系列的氧化还原反应。
具体的反应方程式如下所示:阳极(氧化反应): 2Cl- → Cl2 + 2e-阴极(还原反应): Cu2+ + 2e- → Cu综合方程式: 2Cl- + Cu2+ → Cl2 + Cu通过电解氯化铜溶液,氯离子被氧化为氯气,同时铜离子被还原为固体铜沉淀。
这个反应过程是一个非常典型的电解反应示例。
实验结果与讨论在实验过程中,我们可以观察到以下现象和变化:1.阳极产生气泡:在阳极上,氯离子被氧化生成氯气,因此会产生气泡。
2.阴极生成沉淀:在阴极上,铜离子被还原为固体铜沉淀,这使得阴极逐渐变得比较粘稠。
3.溶液的颜色变化:由于铜离子逐渐减少,溶液的颜色可能会从原来的蓝绿色变浅或变为无色。
通过实验观察和记录,我们可以了解电解氯化铜溶液的方程式和反应过程,并进一步理解氧化还原反应的基本原理。
应用领域电解氯化铜溶液在实际应用中有一些重要的领域,包括:1.电镀:由于电解氯化铜溶液中含有铜离子,因此该溶液可用于铜的电镀过程,将铜沉积在其他金属表面以提高其耐腐蚀性和装饰性。
【氯化铜溶液是什么颜色?】百度作业帮中学学习中有颜色的离子不多,需要记住:铜离子溶液是蓝色的,含铁离子溶液是黄褐色的,高锰酸根离子是紫色比较稀的CuCl2溶液:蓝色([Cu(H2O)4]2+的颜色)较浓的CuCl2溶液:绿色([CuCl3]-是黄色的,[Cu(H2O)4]2+是蓝色的,共存是绿色)一般浓度的CuCl2溶液:蓝绿色(介于上述二者之间)如果是初中化学,直接回答“蓝色”就行了(蓝色是Cu2+的颜色)较浓的CuCl2溶液:绿色([CuCl3]-是黄色的,[Cu(H2O)4]2+是蓝色的,共存是绿色)一般浓度的CuCl2溶液:蓝绿色(介于上述二者之间)如果是中学化学,直接回答“蓝色”就行了(蓝色是Cu2+的颜色)中学常见物质颜色及离子的颜色总结说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。
一、单质绝大多数单质:银白色。
主要例外:镧系锕系及下表物质 Cu 紫红 O2 无 Au 黄 S 黄 B 黄或黑 F2 淡黄绿 C(石墨)黑 Cl2 黄绿 C(金刚石)无 Br2 红棕 Si 灰黑 I2 紫黑 H2 无稀有气体无 P 白、黄、红棕二、氢化物LiH等金属氢化物:白NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外:NO2 棕红N2O5和P2O5 白 N2O3 暗蓝 ClO2 黄大多数主族金属的氧化物:白主要例外:Na2O2 浅黄 PbO 黄 K2O 黄 Pb3O4 红 K2O2 橙 Rb2O 亮黄 Rb2O2 棕 Cs2O 橙红 Cs2O2 黄大多数过渡元素氧化物有颜色 MnO 绿 CuO 黑 MnO2黑 Ag2O 棕黑 FeO 黑 ZnO 白 Fe3O4 黑 Hg2O 黑 Fe2O3 红棕 HgO 红或黄 Cu2O 红 V2O5 橙四、氧化物的水化物大多数:白色或无色其中酸:无色为主碱:白色为主主要例外:CsOH 亮黄Fe(OH)3红褐 HNO2 溶液亮蓝 Cu(OH)2 蓝 Hg(OH)2 桔红五、盐大多数白色或无色主要例外:K2S 棕黄CuFeS2 黄KHS 黄ZnS 白Al2S3 黄 Ag2S 黑 MnS 浅红 CdS 黄 FeS 黑棕 SnS 棕 FeS2 黄 Sb2S3 黑或橙红CoS 黑HgS 红NiS 黑PbS 黑CuS、Cu2S 黑Bi2S3 黑FeCl3·6H2O 棕黄 Na3P 红FeSO4·9H2O 蓝绿 NaBiO3 黄 Fe2(SO4)3·9H2O 棕黄 MnCl2 粉红 Fe3C 灰 MnSO4 淡红 FeCO3 灰 Ag2CO3 黄 Fe(SCN)3 暗红 Ag3PO4 黄 CuCl2 棕黄 AgF 黄CuCl2·7H2O 蓝绿 AgCl 白 CuSO4 白 AgBr 浅黄CuSO4·5H2O 蓝 AgI 黄 Cu2(OH)2CO3 暗绿盐溶液中离子特色:NO2- 浅黄Cu2+或[Cu(H2O)4]2+ 蓝 MnO4- 紫红 [CuCl4]2- 黄 MnO42- 绿 [Cu(NH3)4]2+ 深蓝 Cr2O72- 橙红 Fe2+ 浅绿 CrO42- 黄 Fe3+ 棕黄非金属互化物 PCl3 无 XeF2、XeF4、XeF6 无 PCl5 浅黄氯水黄绿 CCl4 无溴水黄—橙CS2 无碘水黄褐 SiC 无或黑溴的有机溶液橙红—红棕 SiF4 无 I2的有机溶液紫红六.其它甲基橙橙 CXHY(烃)、CXHYOZ 无(有些固体白色)石蕊试液紫大多数卤代烃无(有些固体白色)石蕊试纸蓝或红果糖无石蕊遇酸变红葡萄糖白石蕊遇碱变蓝蔗糖无酚酞无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓HNO3变黄纤维素白I2遇淀粉变蓝 TNT 淡黄 Fe3+遇酚酞溶液紫焰色反应 Li 紫红 Ca 砖红 Na 黄 Sr 洋红 K 浅紫(通过蓝色钴玻璃) Ba 黄绿 Rb 紫 Cu 绿稀有气体放电颜色 He 粉红 Ne 鲜红 Ar 紫状态物质 1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4 ▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
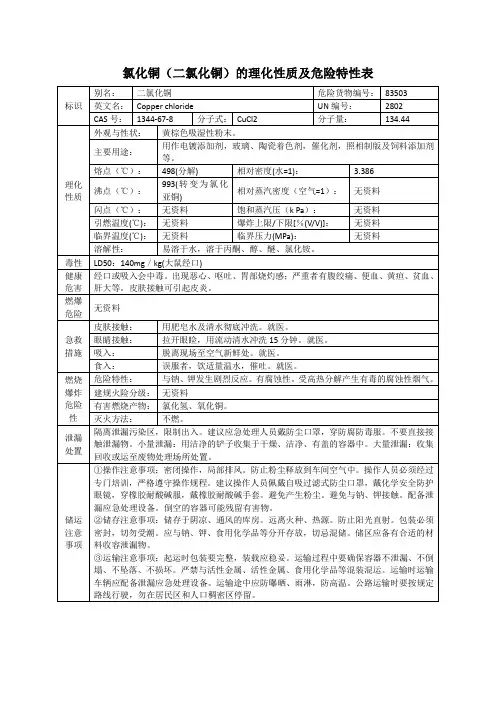
氯化铜转化为氧化铜温度
【原创版】
目录
一、引言
二、氯化铜和氧化铜的性质与用途
三、氯化铜转化为氧化铜的温度条件
四、总结
正文
一、引言
氯化铜和氧化铜是两种常见的化学物质,它们在工业和生活中有着广泛的应用。
然而,这两种化合物之间的转化过程并不为人所熟知。
本文将介绍氯化铜转化为氧化铜的温度条件。
二、氯化铜和氧化铜的性质与用途
1.氯化铜的性质与用途
氯化铜,化学式为 CuCl2,是一种蓝绿色的晶体,具有良好的导电性和导热性。
氯化铜广泛应用于电镀、印刷电路板制造、颜料、木材防腐等领域。
2.氧化铜的性质与用途
氧化铜,化学式为 CuO,是一种黑色或棕色的粉末,不溶于水。
氧化铜具有较高的熔点和良好的耐高温性能,因此常用于制造耐火材料、陶瓷、玻璃着色、催化剂等领域。
三、氯化铜转化为氧化铜的温度条件
氯化铜转化为氧化铜的过程,通常采用加热的方法。
在这个过程中,氯化铜在高温下发生分解反应,生成氧化铜和氯气。
根据实验数据,氯化
铜转化为氧化铜的温度一般在 180℃-200℃之间。
需要注意的是,这个温度范围并非绝对,实际操作中需要根据实验条件和设备进行适当调整。
四、总结
氯化铜和氧化铜在工业和生活中具有广泛的应用。
通过加热的方法,可以将氯化铜转化为氧化铜,其温度条件一般在 180℃-200℃之间。
硫酸铜溶液显蓝色,氯化铜溶液为绿色。
为什么同为铜盐, 但颜色不同?
如果仅仅用酸根离子不同作理由来解释,是不足以服人的。
要透彻解释应该从Cu2+的络离子说起。
Cu2+有配位数2、4、6的络离子。
在胆矾CuSO4·5H2O中,CuSO4·5H2O的化学式也可以写成[Cu(H2O)4]SO4·H2O。
胆矾呈蓝色是因为[Cu(H2O)4]2+呈蓝色。
CuSO4·5H2O溶于水后,
[Cu(H2O)4]2+存在于溶液中,若溶于过量水,还会形成
[Cu(H2O)6]2+,无论[Cu(H2O)4]2+还是[Cu(H2O)6]2+络离子,都是蓝色的,所以硫酸铜溶液呈蓝色。
无水氯化铜呈棕黄色,常以(CuCl2)n的形式存在,溶于少量水时形成[Cu(H2O)4]2+和[CuCl4]2-络离子:
(CuCl2)2+4H2O==[Cu(H2O)4]2++[CuCl4]2-
[Cu(H2O)4]2+显蓝色,[CuCl4]2-显绿色,它们共存时的混合色则为绿色,所以浓的CuCl2溶液显绿色。
稀释时由于水增加,电离平衡向右移动,[CuCl4]2-离子减少,[Cu(H2O)4]2+离子增加,绿色向蓝色变化。
当溶液相当稀时,几乎均为[Cu(H2O)4]2+,[CuCl4]2-很少,所以显蓝色。