做CuCl2的溶液电解实验.
- 格式:ppt
- 大小:168.50 KB
- 文档页数:18


电解原理及其应用一、电解池原理1、电解CuCl2溶液实验步骤:在装有CuCl2溶液的U型管两端,分别插入碳棒作电极,并接上电流计,接通12 V 的直流电源,形成闭合回路。
把湿润的淀粉碘化钾试纸放在与直流电源正极相连的电极附近,观察U 型管内碳棒、溶液颜色、试纸颜色的变化和电流计指针的偏转情况。
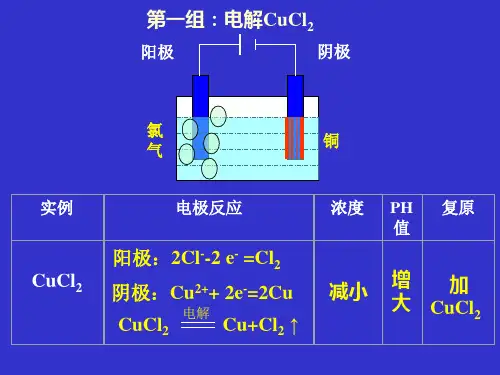
实验现象及分析:与电源的负极相连的碳棒上有一层红色的固体析出,说明有铜生成;与电源的正极相连的碳棒上有气泡产生,并有刺激性气味,发现湿润的淀粉碘化钾试纸变成了蓝色,说明有氯气生成;电流计指针发生偏转,说明有电流通过;溶液的颜色逐渐变浅,说明Cu2+的浓度逐渐减小。
实验注意事项:电解时间不宜太长,避免产生的氯气污染环境,或者可以将蘸有浓NaOH溶液的棉花塞在U型管两端,吸收有毒气体。
小结:CuCl2溶液在通电时发生了化学变化,生成了Cu和Cl2。
2、电解池及电解原理(1)电解:使电流通过电解质溶液或融熔电解质而在阴、阳两极引起氧化还原反应的过程。
(2)电解池:把电能转化为化学能的装置。
(3)电解池的电极名称:阴极:发生还原反应的电极。
与电源的负极相连的电极;吸引溶液中的阳离子。
阳极:发生氧化反应的电极。
与电源的正极相连的电极,吸引溶液中的阴离子。
(4)电解池的组成:直流电源、电极、电解质溶液或熔融的电解质,用导线连接成闭合电路。
(5)电解池的工作原理:在直流电源的作用下,使电解质溶液中的离子向阴阳两极移动,并在两极发生氧化还原反应。
电解质溶液的导电的过程就是电解过程。
以电解CuCl2溶液为例,通电前,存在两个电离过程:CuCl2=Cu2++2Cl - H2O H+ +OH–通电后,阴离子(Cl-、OH-)移向阳极,在阳极上失去电子发生氧化反应;阳离子(Cu2+、H+)移向阴极,在阴极得到电子发生还原反应。
阳极:Cu2++2e- = Cu(还原反应)阴极:2Cl--2e-= Cl2↑(氧化反应)总反应式:CuCl2Cu+Cl2↑3、放电顺序(1)放电:离子在电极失去或得到电子,发生氧化还原反应的过程。





电解氯化铜溶液方程式介绍电解是指通过外加电压在溶液中引发氧化还原反应的过程。
在电解过程中,正极发生氧化反应,负极发生还原反应,并伴随着离子在溶液中的迁移。
本文将探讨电解氯化铜溶液的方程式及相关内容。
氯化铜的性质氯化铜是一种无机化合物,化学式为CuCl2。
它是一种蓝绿色晶体,可溶于水。
在溶液中,氯化铜会解离成Cu2+和2Cl-离子。
电解氯化铜溶液的实验为了了解电解氯化铜溶液的方程式,我们可以进行实验来观察和记录反应过程。
下面是一个简单的实验步骤:1.准备一个电解槽,将两块电极(一块铜电极作为阳极,一块不锈钢电极作为阴极)插入溶液中。
2.在电解槽中加入氯化铜溶液,制定合适的浓度和体积。
3.打开电源,使阳极与正电极相连,阴极与负电极相连。
4.施加适当的电压,启动电解过程。
5.观察和记录电解过程中的现象和变化。
电解过程及方程式在电解氯化铜溶液的过程中,发生了一系列的氧化还原反应。
具体的反应方程式如下所示:阳极(氧化反应): 2Cl- → Cl2 + 2e-阴极(还原反应): Cu2+ + 2e- → Cu综合方程式: 2Cl- + Cu2+ → Cl2 + Cu通过电解氯化铜溶液,氯离子被氧化为氯气,同时铜离子被还原为固体铜沉淀。
这个反应过程是一个非常典型的电解反应示例。
实验结果与讨论在实验过程中,我们可以观察到以下现象和变化:1.阳极产生气泡:在阳极上,氯离子被氧化生成氯气,因此会产生气泡。
2.阴极生成沉淀:在阴极上,铜离子被还原为固体铜沉淀,这使得阴极逐渐变得比较粘稠。
3.溶液的颜色变化:由于铜离子逐渐减少,溶液的颜色可能会从原来的蓝绿色变浅或变为无色。
通过实验观察和记录,我们可以了解电解氯化铜溶液的方程式和反应过程,并进一步理解氧化还原反应的基本原理。
应用领域电解氯化铜溶液在实际应用中有一些重要的领域,包括:1.电镀:由于电解氯化铜溶液中含有铜离子,因此该溶液可用于铜的电镀过程,将铜沉积在其他金属表面以提高其耐腐蚀性和装饰性。

第1课时 电解原理[目标导航] 1.了解电解、电解池的概念,会描述电解池的工作原理。
2.能正确书写电解池的电极反应式和总反应方程式。
3.理解并掌握电解规律和电解产物的判断方法。
一、电解CuCl 2溶液的实验探究1.实验操作如图所示,在U 形管中注入CuCl 2溶液,插入两根石墨棒电极,把湿润的KI淀粉试纸放在与直流电源正极相连的电极(阳极)附近。
接通直流电源。
2.实验现象阴极石墨棒上逐渐覆盖一层红色物质,阳极石墨棒上有气泡逸出,并可闻到刺激性的气味,同时看到湿润的KI淀粉试纸变蓝色。
3.原理分析CuCl 2是强电解质且易溶于水,H 2O 是弱电解质,微弱电离生成H +和OH -,因此溶液中存在Cu 2+、H +、Cl -和OH -等4种离子。
通电前,离子做自由移动;通电后,Cl -和OH -向阳极移动,Cu 2+和H +向阴极移动。
在阳极,OH -、Cl -均可能被氧化,由于Cl -的放电能力比OH -强,Cl -优先于OH -在阳极上发生反应;在阴极,Cu 2+和H +都可能被还原,但Cu 2+的放电能力比H +强,Cu 2+优先于H +在阴极上发生反应。
电极反应为 阳极:2Cl --2e -===Cl 2↑(氧化反应); 阴极:Cu 2++2e -===Cu(还原反应)。
电解反应:CuCl 2=====电解Cu +Cl 2↑。
4.实验结论在直流电的作用下,电能转化为化学能,CuCl 2被电解为Cu 和Cl 2(Cu 在阴极生成,Cl 2在阳极生成)。
二、电解原理 1.电解让直流电通过电解质溶液(或熔融的电解质),而在两电极上分别发生氧化反应和还原反应的过程叫电解。
2.电解池(1)定义:将电能转化为化学能的装置。
(2)组成:与直流电源相连的两个固体电极;电解质溶液或熔融的电解质;形成闭合回路。
(3)电极名称与电极反应:阳极:与电源正极相连,溶液中阴离子移向此极,失去电子,发生氧化反应。

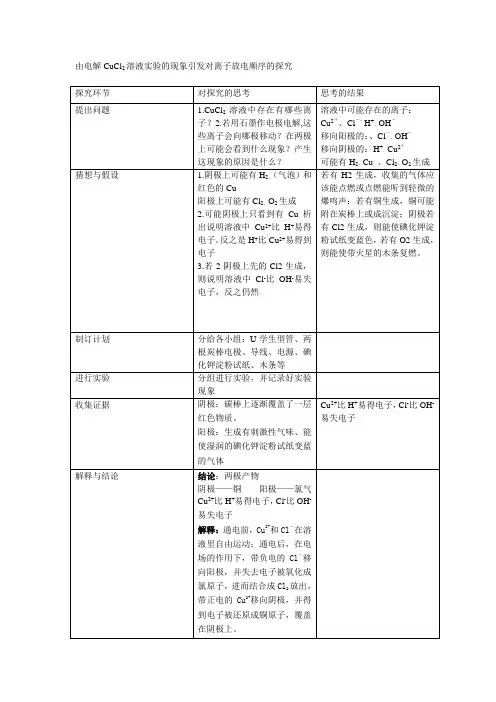
4-3-1 电解池(第一课时)【学习目标】1.理解电解原理,初步掌握一般电解反应产物的判断方法2.掌握电解质溶液中离子的放电顺序及电解质溶液的电解规律(惰性电极)3.掌握电解电极方程式的书写【学习重难点】学习重点:掌握电解电极方程式的书写;掌握电解质溶液中离子的放电顺序及电解质溶液的电解规律(惰性电极)学习难点:掌握电解电极方程式的书写;掌握电解质溶液中离子的放电顺序及电解质溶液的电解规律(惰性电极)【自主预习】一.电解原理1.实验探究:教材P79页“实验4-2”【问题1】通电前,CuCl2溶液中存在阳离子:阴离子:【问题2】如图所示:与电源正极相连的电极叫极,与电源负极相连的电极叫极。
通电后,溶液中的离子如何运动?阳离子向极移动,阴离子向极移动【问题3】预测一下将发生怎样的电极反应?在阴极上发生电极反应(或者说放电)的离子是在阳极上放电的离子是给CuCl2溶液通电时现象:阴极上:,经检验该物质是。
阳极上:,经检验该物质是。
电极反应式:阳极:反应类型:反应。
阴极:反应类型:反应。
总反应式:过程分析:CuCl2溶液能导电是因为存在,通电后这些自由移动的离子,在电场作用下作移动,带负电的氯离子向极移动,在阳极,氯离子失去电子被为氯原子,并两两结合成氯分子,从阳极放出,带正电的铜离子向极移动,在阴极铜离子获得电子被成铜原子,覆盖在阴极上。
2.电解:使电流通过溶液而在阴、阳两极引起的过程。
该过程中能转化为能。
这是一个过程(物理?化学?)显然:电解质溶液的导电过程就是的过程。
3.电解池:将能转化为能的装置。
4.原电池与电解池的比较二.电解电极反应的分析1.放电顺序阴极:由于阴极上要电子,不管阴极材料是金属还是石墨,此时都不能得电子,因此只能是溶液中的得电子。
阳离子氧化性越强就越得电子。
金属越不活泼,对应阳离子氧化性越,越得电子。
由此根据金属活动顺序表,分析下列离子得电子能力的强弱:(1)金属活动顺序表(2)(用“〉”表示)Ag+ Hg2+ (Fe3+ )Cu2+H+(酸)Pb2+ Fe2+ Zn2+ Al3+…(3)、、、、等活泼金属阳离子在水溶液中电解时不得电子。
氯化铜溶液的电解1. 引言电解是一种利用电流将化学反应进行到极限的方法。
在本次任务中,我们将研究氯化铜溶液的电解过程。
氯化铜溶液是一种常见的无机化合物,通过电解可以观察到一系列有趣的现象和反应。
本文将详细介绍氯化铜溶液的电解原理、实验操作步骤以及可能发生的反应。
2. 氯化铜溶液的电解原理2.1 电解概述电解是指通过外加电压使离子在溶液中迁移并进行化学反应的过程。
在一个典型的电解池中,有两个极板,一个为阳极(Anode),另一个为阴极(Cathode)。
当外加直流电压施加到该系统上时,阳离子(正离子)会向阴极迁移,而阴离子(负离子)则会向阳极迁移。
这一过程称为离子迁移。
2.2 氯化铜溶液氯化铜(CuCl2)是由一价铜离子(Cu+)和二价氯离子(Cl-)组成的化合物。
在溶液中,CuCl2会解离为Cu+和2Cl-两种离子。
因此,当氯化铜溶液进行电解时,Cu+和Cl-会分别向阴极和阳极迁移。
3. 氯化铜溶液电解实验操作步骤3.1 实验材料和设备•氯化铜溶液•电源•两个导电极(一根阴极和一根阳极)•直流电流表•手套、护目镜等个人防护装备3.2 实验步骤1.将氯化铜溶液倒入一个适合的容器中,并将容器放置在稳定的平台上。
2.将一根导电极连接到电源的正极(阳极),另一根导电极连接到电源的负极(阴极)。
3.将正负两个导电极分别插入氯化铜溶液中,确保它们不接触彼此。
4.打开电源,调整适当的电压和电流值。
5.观察实验过程中发生的变化,并记录实验数据。
4. 可能发生的反应在氯化铜溶液的电解过程中,可能发生以下几种反应:4.1 阴极反应在阴极上,Cu+离子会接受电子,还原成Cu金属。
Cu+ + e- -> Cu这一反应导致阴极上出现铜沉积。
4.2 阳极反应在阳极上,氯离子(Cl-)会失去电子,氧化成氯气(Cl2)。
2Cl- -> Cl2 + 2e-这一反应导致阳极处产生氯气的泡泡。
4.3 氧化还原反应除了阴极和阳极上的反应外,溶液中的Cu2+也可能参与一些氧化还原反应。
石墨电极电解cucl2电极方程式石墨电极(graphite electrode)在电解质溶液中的应用已经广泛应用于工业生产和实验室研究中。
其中,电解CuCl2是一种常见的实验,主要用于生产金属铜(Copper,Cu)。
本文将详细讨论石墨电极电解CuCl2的电极方程式,从而使读者对该过程有更清晰的理解。
首先,我们来了解一下石墨电极的特点和工作原理。
石墨电极是由高纯度的石墨材料制成,具有优良的导电性和化学稳定性。
在电解质溶液中,石墨电极的一个作为阴极(Cathode)或阳极(Anode)工作,这取决于电解体系的特性和实验需求。
在电解CuCl2中,石墨电极常常作为阴极。
接下来,我们来看看CuCl2的电离方程式。
CuCl2是由铜(Cu)和氯(Cl)离子组成的化合物。
在水溶液中,它会电离成Cu2+和2Cl-离子。
电离方程式如下:CuCl2 (aq) → Cu2+ (aq) + 2Cl- (aq)在电解CuCl2的过程中,Cu2+离子会在阴极上被还原成金属铜(Cu),而阴极上的氯(Cl)离子则不参与反应。
这是因为铜的标准电位(E0)比氯的标准电位更负,所以它更容易被还原成金属。
接下来,我们将讨论石墨电极电解CuCl2的电极反应方程式。
在阴极上,Cu2+离子被还原为金属铜(Cu)。
反应方程式如下:Cu2+ (aq) + 2e- → Cu (s)在该反应中,Cu2+离子获得了2个电子,并被还原成Cu(s)。
这是一个还原反应,因为铜离子的氧化态(+2)被还原成金属铜(0态)。
除了阴极上的反应,还有一个阳极上的反应。
由于Cl-离子并不参与阴极上的反应,所以它们在阳极上发生氧化反应。
具体来说,两个Cl-离子会失去两个电子,并在阳极上氧化成Cl2气体。
反应方程式如下:2Cl- (aq) → Cl2 (g) + 2e-在该反应中,Cl-离子失去了两个电子,并转化成了Cl2气体,同时释放出两个电子。
综上所述,石墨电极电解CuCl2的电极反应方程式包括阴极上的还原反应和阳极上的氧化反应。
电解氯化铜反应方程电解氯化铜是一种经典的电化学过程,可以通过电解氯化铜溶液来制备纯度较高的金属铜。
本文将详细介绍电解氯化铜的反应方程以及相关反应机制。
首先,我们需要了解氯化铜的化学性质。
氯化铜(CuCl2)是一种无色晶体,可溶于水,溶液呈现蓝绿色。
氯化铜溶液是一种良好的电解质溶液,可以通过电解来制备金属铜。
电解氯化铜的反应方程如下:在阳极(正极):2Cl- -> Cl2 + 2e-在阴极(负极):Cu2+ + 2e- -> Cu根据方程可知,氯离子在阳极被氧化生成氯气,而铜离子在阴极被还原成金属铜。
这也是电解过程的基本原理,阳离子被氧化,而阴离子被还原。
反应机制通过下面的步骤进行:1. 当导电性较好的氯化铜溶液被电解时,正极(阴极)释放出电子,形成一个富集电子的区域。
2. 电子从阴极流向阳极,而溶液中的铜离子(Cu2+)从阳极源流向阴极,氯离子(Cl-)从阴极源流向阳极。
这个过程被称为“离子迁移”。
3. 在阳极,氯离子被氧化成氯气,反应方程为2Cl- -> Cl2 + 2e-。
而在阴极,铜离子被还原成金属铜,反应方程为Cu2+ + 2e- -> Cu。
4. 氯气在阳极处被放出,而金属铜则在阴极上被析出。
金属铜以形成纳米颗粒状,最终逐渐沉淀和固化。
5. 随着电解的进行,溶液中的氯化铜浓度逐渐降低,直到反应结束。
可以发现,电解氯化铜的主要反应可以看作是阴极上的还原反应和阳极上的氧化反应。
通过电解,氯气和金属铜可以同时得到。
电解氯化铜是一种实用性较强的方法来制备金属铜。
根据反应方程,我们可以优化电解条件,如电流密度、电解时间等,以提高反应效率和纯度。
此外,电解氯化铜反应也可以应用于其他金属还原制备的过程中,具有一定的参考价值。
总结起来,电解氯化铜的反应方程为2Cl- -> Cl2 + 2e-(阳极)和Cu2+ + 2e- -> Cu(阴极)。
通过电解,在阳极处氯离子被氧化成氯气,而在阴极处铜离子被还原成金属铜。
电解氯化铜实验
实验演示
操作方法
向U形管中注入CuCl2溶液,插入两根石墨电极,用湿润的碘化钾淀粉试纸放在阳极碳棒附近,检验放出的气体。
接通直流电源,观察U形管内发生的现象。
实验现象
接通直流电流一段时间,可看到阴极碳棒上,有一层铜覆盖在它的表面,在阳极碳棒上有气泡放出,放出的气体能使湿润的碘化钾淀粉试纸变蓝,并有刺激性气味。
如淀粉碘化钾试纸放时间长一些,电解在进行中还会使变蓝的淀粉试纸褪色。
实验结论
从阳极放出气体的性质可知该气体为Cl2,遇淀粉碘化钾试纸(湿润)变蓝,如时间长一些,生成的I2与Cl2继续作用,使蓝色褪去。
阴极产生铜。
从以上实验可知,溶液受到电流的作用,在导电同时,发生了化学变化,生成铜和氯气,方程式为:CuCl2 Cu+Cl2↑
实验考点
1、电解原理;
2、氧化还原反应原理以及放电顺序;
3、电极反应式的书写与判断;
4、电子守恒、电荷守恒的应用
经典考题
1、下图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是。