鲁教版九年级化学溶液复习
- 格式:pptx
- 大小:752.16 KB
- 文档页数:23

第三单元溶液第一节溶液的形成一、物质在水中的分散二、溶液溶液:一种或几种物质分散到另一种物质形成的均一、稳定的混合物。
溶质:被溶解的物质溶剂:起溶解作用的物质1.溶液的外观:澄清透明。
(溶质是以肉眼看不见的分子或离子形式分散到溶剂中的,所以溶液是澄清透明的;但是溶液不一定是无色的)2.溶液的特点:均一性、稳定性、属于混合物3.溶质、溶剂的判断:①固体、气体溶解于液体:固体、气体是溶质,液体是溶剂②液体溶解于液体:少的是溶质,多的是溶剂;如果有水,无论多少,水是溶剂。
4.溶液的命名:“xx”(溶质)的“xx”(溶剂)溶液;如果溶剂是水,可以不说溶剂水。
氯化钠溶于水所得溶液的全称为“氯化钠的水溶液”,又可以叫做“氯化钠溶液”。
5.一些常见溶液的俗称:氯化钠溶液——食盐水氢氧化钙溶液——石灰水碘的酒精溶液——碘酒三、溶解时吸热、放热现象1.溶解时溶质的分子(或离子)向水中扩散,吸收热量,溶液温度降低。
2.溶解时溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量,溶液温度升高。
3.①溶解放热,所得溶液温度升高的物质有:氢氧化钠固体、生石灰氧化钙、浓硫酸②溶解吸热,所得溶液温度降低的物质有:硝酸铵晶体③氯化钠溶于水既不吸热也不放热四、溶液的性质①常见的酸、碱、盐的水溶液具有导电性。
原因是它们溶于水要发生电离,产生能自由移动的阳离子和阴离子。
如氯化钠溶解发生电离的电离方程式为NaCl=Na++Cl-;硫酸溶解发生电离的电离方程式为H2SO4=2H++SO42-②少量溶质溶于水中,形成的稀溶液的沸点升高,凝固点降低。
③常见的有色溶液:蓝色溶液(含Cu 2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液浅绿色溶液(含Fe 2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液黄色溶液(含Fe 3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液 紫红色溶液:高锰酸钾溶液 紫色溶液:石蕊溶液五、饱和溶液与不饱和溶液1. 定义:在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。

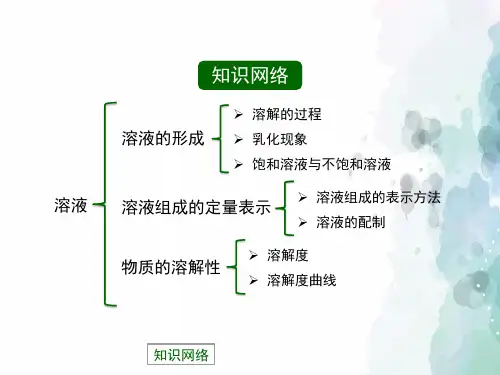
第三单元溶液第一部分知识梳理一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性的混合物注意:a、溶液不一定无色,如CuSO4为蓝色FeSO4为浅绿色Fe2(SO4)3为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量= 溶质的质量+ 溶剂的质量溶液的体积≠溶质的体积+ 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)碘酒中溶质是碘,溶剂是酒精。
盐酸溶质是HCl,石灰水溶质为Ca(OH)2,食盐水溶质为NaCl,氧化钙溶于水溶质为Ca(OH)2,三氧化硫溶于水溶质为H2SO4,胆矾CuSO4·5H2O溶于水溶质为CuSO4,医用酒精中溶质为C2H5OH。
固体、气体溶于液体,液体为溶剂2、溶质和溶剂的判断有水,水为溶剂液体溶于液体,3、饱和溶液、不饱和溶液无水,量多的为溶剂(1)概念:(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解(3)饱和溶液和不饱和溶液之间的转化①加水②升温饱和溶液不饱和溶液熟石灰对温度例外①增加溶质②降温③蒸发溶剂饱和石灰水变成不饱和的石灰水的方法是:①加水②降温对于同一种溶质的溶液来说,在同一温度下,饱和溶液一定比不饱和溶液要浓。
注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl二、溶解度1、固体的溶解度(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克20℃时,易溶物质的溶解度为﹥10g,可溶物质的溶解度1g—10g,微溶物质的溶解度为0.01g—1g,难溶物质的溶解度为﹤0.01g。


第三单元 溶液基础检测1.溶液:________或_________物质分散到_________物质里,形成的________的、________的混合物...。
2.特征:①________、②________。
溶质:________________ 3.组成 溶剂:________________(_____是常用的溶剂,_______、______也可以作溶剂),例如:碘酒中溶质是______,溶剂是________。
4.溶解时的吸热和放热现象⑴物质在溶解时,常常会使溶液的________发生变化,即溶解时会出现______现象和______现象。
43245.乳化现象,洗涤剂洗油污属于 。
6.溶液的分类或加入溶质不饱和溶液(适用于大多数固体..) 、蒸发溶剂或________) 降温结晶(适用于溶解度________________的物质)7.结晶方法 ________(适用于溶解度受温度影响不大的物质)升温结晶(适用于溶解度________________的物质)①固体物质溶解度四要素:一定温度、________、________、以克为单位。
②固体溶解度影响因素①内因:_______________②外因:_______________8.溶解度 ③气体溶解度:随温度________而________,随压强________而________。
________,结晶方法:________④溶解度曲线及意义 平缓型,例如________,结晶方法:________下降型,例如________,结晶方法:________①溶质的质量分数=%100)()g ( g 溶液质量溶质质量(适用于所有溶液) 9.溶质质量分数 ②m 溶液= _______+_______(溶液浓稀的表示方法) ③饱和溶液:溶质的质量分数= ______________(只适用于饱和溶液)④溶液稀释前后,_______的质量不变。


初三化学水和溶液 复习一. 本周教学内容: 第二单元 水和溶液(复习) [主要内容]1. 通过分析水分子的运动与水的三态变化及水的天然循环的关系,认识分子的特性,理解状态变化这类物理变化的本质;了解水的三态变化对生命体的重要意义。
2. 通过对“水的电解”和“氢气燃烧”实验的微观分析,初步揭示化学变化的本质。
3. 了解原子的结构,知道原子内部电子的特性和作用。
4. 通过对食盐等物质在水中的溶解的微观分析,认识溶解的本质并了解溶液的基本特点——均一性和稳定性。
5. 学习实验室和工业上提纯水的常用方法:学会定量表示溶液的组成,练习在实验室里配制一定溶质质量分数的溶液:学会科学表示原子质量大小的方法——相对原子质量 [知识要点](一)水分子的运动 1. 水的三态变化水分子的运动导致了水的状态变化。
水分子获得能量时,运动加快,分子间的间隔增大,水由液态变成了气态;失去能量时,运动减慢,分子间的间隔减小,水由气态又变回液态。
2. 水的天然循环。
3. 水的人工净化“沉降”“过滤”“灭菌” 4. 几种常见的水①纯净水——长期饮用降低免疫力 ②矿泉水——矿物质适中才是健康水 ③自来水——含天然水中有益矿物质 (二)水的组成 1. 电解水①正极:能使带火星的木条复燃——氧气(O 2) ②负极:能被点燃——氢气H 2 ③化学方程式通电22222H OH O ↑+↑④分解反应:由一种物质生成两种或两种以上的物质的化学反应。
⑤化学变化的实质分子原子新分子化分重新组合−→−−−→−−−⑥有些物质是由原子直接构成的:金属、稀有气体、碳、硅等单质。
⑦分子是保持物质化学性质的一种微粒。
原子是化学变化中的最小微粒。
分子和原子本质区别:在化学变化中,分子可以再分,而原子不能再分。
2. 氢气的燃烧①现象:产生淡蓝色火焰,烧杯壁凝结有水雾,放出热量。
②化学方程式:点燃22222H O H O +③化合反应:由两种或两种以上的物质生成一种物质的化学反应。


第三单元溶液复习第一节物质在水中的溶解知识点一概念_____________________________________________________溶质________________________________________________ 组成溶剂________________________________________________ 溶液_________性:是指溶液中各部分均匀一致,性质相同。
特征__________性:是指外界条件不变化时,将溶液长期放置,不会出现沉降或分层现象。
练习:下列物质中属于溶液的是()○1白醋○2面粉加入水中振荡后的液体○3泥水○4冰溶于水中○5豆油滴入水中振荡后的液体○6澄清的海水○7液态氧⑧啤酒⑼花生油滴入汽油中振荡知识点二:溶质、溶剂的判定(1)固体、气体溶于液体时,___________是溶质,________是溶剂。
例如:碘酒_____是溶质______是溶剂。
两种液体相互溶解时,通常把量多叫______,量少的叫______。
若溶液中有水,不论水的量多少,通常把水叫做________。
(2)溶液的命名:若A为溶质,B 为溶剂,则称为__________。
碘酒全名叫碘的酒精溶液。
如果水做溶剂,往往省去不写出或不读出,例如:硫酸的水溶液常称为______________。
练习:1.将下列溶液中溶质、溶剂的名称,填在相应的空格内。
2. 请你各举出一个实例,说明下列有关溶液的叙述是错误的。
(1)溶液一定是无色的实例:___________溶液不是无色的(2)均一、稳定的液体都是溶液实例:________是液体,但不是溶液(3)溶液中的溶质一定是固体实例:_________可做溶质,但不是固3.请你帮助小田理清下列关系:(用一定、不一定填空)⑴溶液_____是混合物,但溶液_____是无色的。
⑵溶液中______含有溶质,但溶质_____是一种,并且溶质_____是固体知识点三:电离:许多物质像氯化钠一样,溶解在水中时能产生____________的离子,这个过程叫做电离。
