第三章 第二节 乙烯第1课时(学生版)
- 格式:docx
- 大小:720.25 KB
- 文档页数:6


第二节水的电离和溶液的pH第1课时水的电离[核心素养发展目标] 1.认识水的电离,了解水的离子积常数。
2.能运用弱电解质的电离模型分析水的电离、分析外界条件对水的电离平衡的影响。
3.会计算酸碱溶液中水电离出的c(H+)或c(OH-),能分析应用水的电离平衡曲线。
一、水的电离平衡1.水的电离(1)水是一种极弱的。
(2)水的电离方程式为H2O+H2O H3O++OH-,简写为H2O H++OH-。
(3)水的电离是吸热过程。
2.水的离子积1.某温度时,水溶液中K w=4×10-14,那么该温度比室温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?提示。
2.水的离子积常数K w=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?提示。
1.下列关于水的离子积常数的叙述中,正确的是()A.因为水的离子积常数的表达式是K w=c(H+)·c(OH-),所以K w随溶液中c(H+)和c(OH-)的变化而变化B.水的离子积常数K w与水的电离平衡常数K电离是同一个物理量C.水的离子积常数是温度的函数,随着温度的变化而变化D.水的离子积常数K w与水的电离平衡常数K电离是两个没有任何关系的物理量2.与纯水的电离相似,液氨中也存在微弱的电离:2NH3NH+4+NH-2。
据此判断,以下叙述错误的是() A.液氨中含有NH3、NH+4、NH-2等粒子B.一定温度下,液氨中c(NH+4)·c(NH-2)是定值C.液氨中电离达到平衡时,c(NH3)=c(NH+4)=c(NH-2)D.只要不加入其他物质,液氨中c(NH+4)=c(NH-2)二、外界条件对水的电离平衡的影响分析下列条件的改变对水的电离平衡H2O H++OH-ΔH>0的影响,并填写下表:改变条件平衡移动方向c(H+)c(OH-)水的电离程度K w升高温度加入HCl(g)加入NaOH(s)加入活泼金属(如Na)加入NaHSO4(s)(1)升高温度,若K w增大到1×10-12,则纯水电离出的c(H+)=1×10-6 mol·L-1()(2)在纯水中加入少量酸,水的电离平衡逆向移动,K w减小()(3)25 ℃时,若溶液中c(H+)=1×10-6 mol·L-1,则溶液中c(OH-)=1×10-8 mol·L-1()(4)常温下,加水稀释稀醋酸溶液,溶液中所有的离子浓度都减小()(5)不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)总是相等的()分析下列过程中H2O的电离程度的变化(25 ℃)。






教学设计:人教版《化学2》必修第三章第2节第1课时乙烯【教材分析】本节课的内容位于化学必修2的第三章的第二节——来自石油和煤的两种基本化工原料。
教材介绍了乙烯是一种重要的基本化工原料,它的产量可以用来衡量一个国家的石油化工发展水平,从乙烯用途的角度激发学生的学习兴趣,着重介绍乙烯分子的组成和结构,乙烯的性质和重要的有机反应——加成反应。
乙烯的分子结构是掌握乙烯化学性质的基础,乙烯性质的重点放在化学性质上。
而在讲授乙烯的性质时,又紧紧围绕乙烯的结构展开,强调乙烯分子中碳碳双键有一个键容易断裂的特点,因此本节课在介绍性质之前,先从乙烯分子结构入手,使学生更深刻地理解结构与性质的关系。
本节课与生产生活结合紧密,具有STS教育价值。
【学情分析】在本节课之前,学生已经学习了甲烷和烷烃的性质,学生能初步从组成和结构的角度认识甲烷的性质,但需要对“结构与性质”的关系进一步强化认识;乙烯和苯的教学都能起到这种作用。
另外,学生能从生活实际出发,认识乙烯和苯的广泛应用,再学习它们的性质,初步学习如何进行理论与实际,使学生能够学以致用。
在前一节课,学生也掌握了碳的四价理论,理解了饱和烃的概念,为本节课不饱和烃的引入铺垫基础。
【教学目标】知识与技能:了解乙烯的。
认识乙烯的结构特点。
认识乙烯的主要物理性质和化学性质。
了解乙烯在生产生活中的应用。
过程与方法:提高学生分析、类比、迁移以及概括的能力。
认识有机化合物的存在—结构—性质—用途的主线。
培养学生抽象、概括形成规律性认识的能力。
深化学习具体物质的科学方法。
情感态度与价值观:通过有机化学中结构决定性质,反应条件决定产物的思想,领悟内外因的辩证关系;结合加成反应强化对化学反应本质的辩证认识。
通过乙烯性质实验培养学生严谨求实的科学态度和探索创新品质。
【教学重点和难点】乙烯的结构特点和主要性质。
乙烯的加成反应。
【教学策略】自主学习、合作学习、实验讨论、对比归纳。
【教学过程】(资料在线)原子的经济利用提供新的认识视角,从原子利用率上来看,加成反应是最经济实惠的。

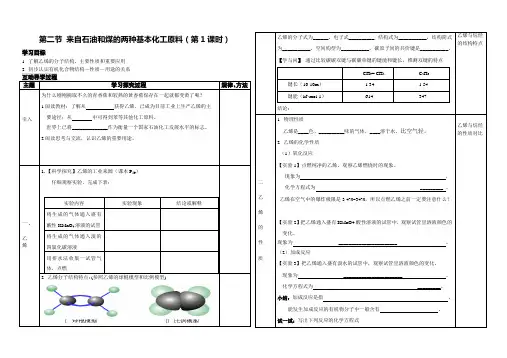
第二节来自石油和煤的两种基本化工原料(第1课时)学习目标1. 了解乙烯的分子结构、主要性质和重要应用互动导学过程主题学习探究过程规律、方法引入为什么刚刚摘取不久的青香蕉和较熟的黄香蕉保存在一起就都变黄了呢?1.阅读教材:了解从获得乙烯,已成为目前工业上生产乙烯的主要途径;从中可得到苯等其他化工原料。
世界上已将______________作为衡量一个国家石油化工发展水平的标志。
2.阅读思考与交流,认识乙烯的重要用途。
一、乙烯1.【科学探究】乙烯的工业来源(课本P59)仔细观察实验,完成下表:实验内容实验现象结论或解释将生成的气体通入盛有酸性KMnO4溶液的试管将生成的气体通入溴的四氯化碳溶液用排水法收集一试管气体,点燃2. 乙烯分子结构特点: (参照乙烯的球棍模型和比例模型)乙烯的分子式为______,电子式__________, 结构式为___________,结构简式为___________。
空间构型为___________。
碳原子间的共价键是___________。
【学与问】通过比较碳碳双键与碳碳单键的键能和键长,推测双键的特点结论:CH2= CH2C2H6键长(10-10m) 1.34 1.54键能(kJ·mol-1)614 347乙烯与烷烃的结构特点二乙烯的性质1. 物理性质乙烯是____色、__________味的气体,____溶于水,比空气轻。
2. 乙烯的化学性质(1)氧化反应【实验1】点燃纯净的乙烯。
观察乙烯燃烧时的现象。
现象为,化学方程式为_________ 。
乙烯在空气中的爆炸极限是3.4%~34%,所以点燃乙烯之前一定要注意什么?【实验2】把乙烯通入盛有KMnO4酸性溶液的试管中,观察试管里溶液颜色的变化。
现象为_______________________ 。
(2)加成反应【实验3】把乙烯通入盛有溴水的试管中,观察试管里溶液颜色的变化。
现象为_______________________ 。

第二节 来自石油和煤的两种基本化工原料第1课时 乙烯一、乙烯的组成和结构1.分子结构2.立体构型判断正误(1)乙烯的结构简式为CH 2CH 2(×) (2)乙烯的电子式为 (×)(3)乙烯分子中所有原子都在同一平面上(√) (4)乙烯分子中所有原子都在一条直线上(×)深度思考:丙烯(CH 3—CH===CH 2)中最多有多少个原子在同一平面?提示 7个 解析 因为乙烯中6个原子在同一平面,而甲烷为正四面体结构,最多只有3个原子在同一平面,而丙烯可以看作—CH 3取代乙烯中的一个氢原子,—CH 3中的C 与双键碳原子及其上的3个氢原子在同一平面,而—CH 3中最多只有一个H 与双键碳原子及其上的3个氢原子在同一平面。
二、乙烯的性质和用途1.实验探究(1)实验现象 ①B 中溶液紫色褪去; ②C 中溶液橙红色褪去; ③D 处点燃后,火焰明亮且伴有黑烟。
(2)实验结论:石蜡油(烷烃)分解产物中有不同于烷烃(饱和烃)的物质产生,即不饱和烃(烯烃)。
2.不饱和烃与烯烃3.物理性质乙烯是一种无色、稍有气味的气体,密度比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
4.化学性质(1)氧化反应:①乙烯在空气中燃烧、火焰明亮且伴有黑烟,生成二氧化碳和水,同时放出大量热。
CH 2===CH 2+3O 2――→点燃2CO 2+2H 2O 。
②乙烯能使酸性高锰酸钾溶液褪色,乙烯被氧化为CO 2。
(2)加成反应概念:有机物分子中的双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
写出乙烯与下列物质发生加成反应的方程式:①Br 2:CH 2===CH 2+Br 2―→CH 2BrCH 2Br ; ②H 2:CH 2===CH 2+H 2――→催化剂△CH 3CH 3; ③HCl :CH 2===CH 2+HCl ――→催化剂△CH 3CH 2Cl ; ④H 2O :CH 2===CH 2+H 2O ――→催化剂高温高压CH 3CH 2OH 。
第二节 来自石油和煤的两种基本化工原料第1课时 乙烯一、乙烯的组成和结构1.分子结构2.立体构型判断正误(1)乙烯的结构简式为CH 2CH 2( ) (2)乙烯的电子式为 ( )(3)乙烯分子中所有原子都在同一平面上( ) (4)乙烯分子中所有原子都在一条直线上( )深度思考:丙烯(CH 3—CH===CH 2)中最多有多少个原子在同一平面?提示 7个 解析 因为乙烯中6个原子在同一平面,而甲烷为正四面体结构,最多只有3个原子在同一平面,而丙烯可以看作—CH 3取代乙烯中的一个氢原子,—CH 3中的C 与双键碳原子及其上的3个氢原子在同一平面,而—CH 3中最多只有一个H 与双键碳原子及其上的3个氢原子在同一平面。
二、乙烯的性质和用途1.实验探究(1)实验现象 ①B 中溶液 ; ②C 中溶液 ; ③D 处点燃后,火焰 且伴有 。
(2)实验结论:石蜡油(烷烃)分解产物中有不同于烷烃(饱和烃)的物质产生,即不饱和烃(烯烃)。
2.不饱和烃与烯烃3.物理性质乙烯是一种无色、稍有气味的气体,密度比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
4.化学性质(1)氧化反应:①乙烯在空气中燃烧、火焰 且伴有 ,生成二氧化碳和水,同时放出大量热。
CH 2===CH 2+3O 2――→点燃2CO 2+2H 2O 。
②乙烯能使酸性高锰酸钾溶液 ,乙烯被氧化为CO 2。
(2)加成反应概念:有机物分子中的 (或 )两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
写出乙烯与下列物质发生加成反应的方程式:①Br 2:CH 2===CH 2+Br 2―→CH 2BrCH 2Br ; ②H 2:CH 2===CH 2+H 2――→催化剂△CH 3CH 3; ③HCl :CH 2===CH 2+HCl ――→催化剂△CH 3CH 2Cl ; ④H 2O :CH 2===CH 2+H 2O ――→催化剂高温高压CH 3CH 2OH 。
(3)加聚反应:乙烯能发生自身的加成反应生成高分子化合物聚乙烯,反应的化学方程式:n CH 2===CH 2――→催化剂CH 2—CH 2。
5.乙烯的用途(1)乙烯的产量可以用来衡量一个国家的石油化工发展水平。
(2)乙烯是一种植物生长调节剂,可作为果实催熟剂。
(3)乙烯是一种基本化工原料。
判断正误 (1) 的分子式是C 3H 6,符合通式C n H 2n ,故该烃是烯烃( )(2)从石油和煤中获得乙烯是目前工业上生产乙烯的主要途径( ) (3)乙烯可燃,能被O 2还原生成CO 2和H 2O( )(4)用溴水或酸性KMnO 4溶液可以区分甲烷和乙烯( )(5)乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应( )(6)乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色的原理相同( )(7)水果运输中为延长果实成熟期,常在车厢里放置浸泡过酸性KMnO 4溶液的硅藻土( )(8)工业上利用乙烯水化法制乙醇,是发生了取代反应( ) (9)乙烯和聚乙烯分子中均含有碳碳双键( ) 深度思考1.(1)在下述反应中,属于取代反应的是________;属于加成反应的是________,属于氧化反应的是________。
①由乙烯制氯乙烷 ②乙烷在空气中燃烧③乙烯使溴水褪色 ④乙烯使酸性高锰酸钾溶液褪色 ⑤乙烷在光照下与Cl 2反应制氯乙烷(2)请写出①、⑤的化学方程式:①________________________________________________________________________;⑤________________________________________________________________________。
(3)用乙烷(CH3CH3)和Cl2反应制取氯乙烷(CH3CH2Cl),用乙烯和HCl反应制氯乙烷,两种方法哪种更好?归纳总结加成反应与取代反应的比较(1)反应物、生成物:取代反应的生成物有两种(一般是一种有机物、一种无机物);加成反应的反应物一般含有双键等不饱和键,生成一种有机化合物。
(2)键的变化特点:取代反应的特点是“上一下一,有进有出”,是等价替换式。
加成反应的特点是“断一加二,都进来”。
“断一”是指双键中的一个不稳定键断裂;“加二”是指每一个不饱和碳原子上各加上一个原子或原子团,加成反应是开键加合式。
(3)定量分析:与氯气反应时,取代反应消耗的氯气量由分子内氢原子个数决定,完全取代时,分子内的氢原子个数与消耗的氯气分子数之比为1∶1;加成反应消耗的氯气量由分子中的双键数决定,双键数与消耗的氯气分子数之比为1∶1。
2.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次将其通过下列哪组试剂的洗气瓶()A.澄清石灰水,浓硫酸B.溴水,浓硫酸C.酸性高锰酸钾溶液,浓硫酸D.浓硫酸,酸性高锰酸钾溶液3.(2019·泰安高一统考)下列说法错误的是()A.无论是乙烯与Br2的加成反应,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有的碳碳双键有关B.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和甲烷C.相同质量的乙烯和甲烷完全燃烧后生成水的质量相同D.乙烯的化学性质比乙烷的化学性质活泼归纳总结(1)乙烯能被酸性KMnO4溶液氧化为CO2和H2O,故不能用酸性KMnO4溶液除去甲烷中的乙烯。
(2)溴水既可区别甲烷和乙烯,也可以除去甲烷中混有的乙烯。
随堂演练知识落实1.下列分子中的各原子均在同一平面的是()A.C2H4B.CHCl3 C.CH3CH2CH===CH2D.CH3CH32.(2019·衡阳四中期末)体育比赛中当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂氯乙烷(CH3—CH2Cl)(沸点为12.27 ℃),进行局部冷冻麻醉应急处理。
制取氯乙烷的最好方法是()A.乙烷与氯气发生取代反应B.乙烯与氯气发生加成反应C.乙烷与氯化氢混合D.乙烯与氯化氢发生加成反应3.(2019·淄博高一检测)下列关于乙烯和乙烷的各种说法中,错误的是()A.乙烯是不饱和烃,乙烷是饱和烃B.乙烯能使酸性高锰酸钾溶液和溴水褪色,乙烷则不能C.乙烯分子中碳碳双键的键能是乙烷分子中碳碳单键的键能的两倍,因此乙烯比乙烷稳定D.乙烯分子为平面结构,乙烷分子为立体结构4.能证明乙烯分子中含有一个碳碳双键的事实是()A.乙烯分子中碳、氢原子的个数比为1∶2 B.乙烯完全燃烧生成的CO2和H2O的物质的量相等C.乙烯易与溴水发生加成反应,且1 mol乙烯完全加成需消耗1 mol溴单质D.乙烯能使酸性KMnO4溶液褪色5.下列叙述错误的是()A.1 mol CH2===CH2先与HCl发生加成反应,再与Cl2发生取代反应,最多消耗Cl2 2.5 molB.实验室中可用如图所示方法除去CH3CH3气体中的CH2===CH2气体C.实验室中可用酸性的KMnO4溶液鉴别CH3CH3气体和CH2===CH2气体D.工业上可利用CH2===CH2与HCl的加成反应制得纯净的CH3CH2Cl6.(2019·杭州五校联盟高三月考)某烃A是有机化学工业的基本原料,还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。
根据图回答下列问题:(1)写出A、B、C、D的结构简式:A____________________,B____________________,C____________________,D____________________。
(2)写出②④两步反应的化学方程式,并注明反应类型:②___________________________________________,反应类型:____________________。
④___________________________________________,反应类型:____________________。
课时对点练题组一乙烯的分子结构1.(2019·佛山一中高一期中)下列说法正确的是()A.乙烯分子的电子式为B.乙烯分子的球棍模型为C.乙烯分子是平面结构D.乙烯分子的结构简式为CH2CH22.如图是某种有机物分子的球棍模型图,图中的“棍”代表单键或双键,不同大小的“球”代表不同的短周期元素的原子,对该有机物的叙述不正确的是()A.该有机物可能的化学式为C2HCl3B.该有机物可以由乙烯和氯化氢通过加成反应得到C.该有机物分子中的所有原子在一个平面上D.该有机物分子中一定有碳碳双键3.下列说法不正确的是( )A .乙烯属于不饱和链烃,乙烷属于饱和链烃B .乙烯分子中所有原子处于同一平面上,乙烷分子中所有原子不都在同一平面上C .1 mol 乙烯所含C—H 单键的数目与0.5 mol 乙烷所含C—H 单键的数目相同D .根据乙烯的结构可知,乙烯也可能发生取代反应题组二 乙烯的性质及应用4.下列各组物质在一定条件下反应,可以制得较纯净的1,2二氯乙烷的是( )A .乙烷与氯气在光照条件下反应B .乙烯与氯化氢气体混合C .乙烯与氯气混合D .乙烯通入浓盐酸5.(2019·泰安二中期中)①②是两种常见烃的球棍模型,则下列叙述正确的是( )A .都能在空气中燃烧B .都能使酸性高锰酸钾溶液褪色C .都能发生加成反应D .等质量的①②完全燃烧时,产生CO 2的量相同6.既能用来鉴别乙烯和乙烷,又能用来除去乙烷中混有的乙烯的方法是( )A .通入足量溴水中B .在空气中燃烧C .通入酸性高锰酸钾溶液中D .在一定条件下通入氢气7.由乙烯的结构和性质推测丙烯(CH 2===CH—CH 3)的结构或性质正确的是( )A .不能使酸性高锰酸钾溶液褪色B .不能在空气中燃烧C .能使溴的四氯化碳溶液褪色D .与HCl 在一定条件下能加成并只得到一种产物题组三 加成反应的概念与判断8.下列反应中,属于加成反应的是( )A .CH 4+Cl 2――→光CH 3Cl +HCl B .CH 2===CH 2+Cl 2―→CH 2ClCH 2ClC .2H 2+O 2=====点燃2H 2OD .CH 4+2O 2――→点燃CO 2+2H 2O9.下列物质不可能是乙烯加成产物的是( )A .CH 3CH 3B .CH 3CHCl 2C .CH 3CH 2OHD .CH 3CH 2Br 10.某烯烃与H 2加成后的产物为,则该烯烃可能的结构简式有( )A .1种B .2种C .3种D .4种 11.(2019·金华等三市部分学校高一联考)使1 mol 乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗氯气的总物质的量是( )A .3 molB .4 molC .5 molD .6 mol12.一种气态烷烃和一种气态烯烃组成的混合物共10 g ,混合气体的密度是相同状况下氢气密度的12.5倍,该混合物气体通过溴水时,溴水的质量增加8.4 g ,则该混合气体是( )A.甲烷、乙烯B.丙烷、乙烯C.乙烷、丙烯D.甲烷、丙烯综合强化13.下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。