2019第三章第二节第1课时 分子晶体语文
- 格式:doc
- 大小:109.11 KB
- 文档页数:11

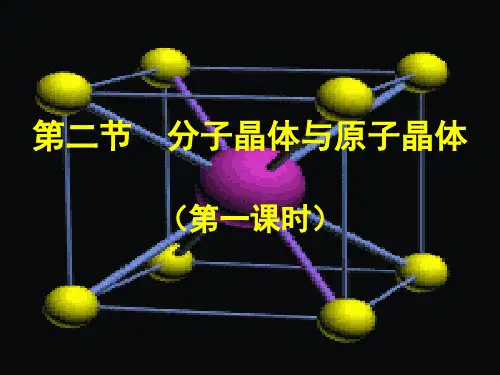









第二节分子晶体与原子晶体第1课时分子晶体一、分子晶体及其结构特点1.概念分子间通过分子间作用力相结合形成的晶体。
2.微粒间作用分子晶体中相邻的分子间以分子间作用力相互吸引。
3.常见分子晶体及物质类别物质类别实例所有非金属氢化物H2O、NH3、CH4等部分非金属单质卤素(X2)、O2、N2、白磷(P4)、硫(S8)等部分非金属氧化物CO2、P4O10、SO2、SO3等几乎所有的酸HNO3、H2SO4、H3PO4、H2SiO3等绝大多数有机物的晶体苯、乙醇、乙酸、乙酸乙酯等4.两种典型分子晶体的组成与结构(1)干冰①每个晶胞中有4个CO2分子,12个原子。
②每个CO2分子周围等距离紧邻的CO2分子数为12个。
(2)冰①水分子之间的作用力有范德华力和氢键,但主要是氢键。
②由于氢键的方向性,使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
判断正误(1)分子晶体中,一定存在共价键和分子间作用力() (2)分子晶体中只存在分子间作用力() (3)共价化合物一定属于分子晶体() (4)干冰晶胞中含有4个CO2分子()(5)分子晶体中一定含有分子间作用力,不一定含有化学键()答案(1)×(2)×(3)×(4)√(5)√1.下列物质中,属于分子晶体的是________。
①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸答案 ②④⑤解析 由常见分子晶体对应的物质类别可知:碘、蔗糖、磷酸都属于分子晶体。
2.甲烷晶体的晶胞结构如图所示(1)晶胞中的球只代表1个__________。
(2)晶体中1个CH 4分子有______个紧邻的CH 4分子。
(3)甲烷晶体熔化时需克服______。
(4)1个CH 4晶胞中含有______个CH 4分子。
答案 (1)甲烷分子 (2)12 (3)范德华力 (4)4解析 (1)题图所示的甲烷晶胞中的球代表的是1个甲烷分子。
(2)由甲烷晶胞分析,位于晶胞顶点的某一个甲烷分子与其距离最近的甲烷分子有3个,而这3个甲烷分子在晶胞的面上,因此每个都被2个晶胞共用,故与1个甲烷分子紧邻的甲烷分子数目为3×8×12=12。
第二节分子晶体与原子晶体第1课时分子晶体1.了解分子晶体的概念及其结构。
2.进一步理解分子间作用力对物质性质的影响,掌握分子晶体的物理性质及其影响因素。
分子晶体的概念和性质[学生用书P39] 1.分子晶体的概念及粒子间的相互作用力(1)概念只含分子的晶体称为分子晶体。
(2)粒子间的相互作用力分子晶体内相邻分子间以分子间作用力相互吸引,分子内原子之间以共价键结合。
2.常见的分子晶体(1)所有非金属氢化物,如水、硫化氢、氨、甲烷等。
(2)部分非金属单质,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、碳60(C60)等。
(3)部分非金属氧化物,如CO2、SO2、SO3、P4O6、P4O10等。
(4)几乎所有的酸,如H2SO4、HNO3、H3PO4、H2SiO3等。
(5)绝大多数有机物的晶体,如苯、乙醇、乙酸、葡萄糖等。
3.分子晶体的物理性质分子晶体熔、沸点较低,硬度较小。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)分子晶体中,一定存在共价键和分子间作用力。
()(2)酸性氧化物都属于分子晶体。
()(3)分子晶体熔化时一定会破坏范德华力,有些分子晶体还会破坏氢键。
()(4)有些分子晶体的水溶液能导电。
()(5)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大。
()(6)因水分子间存在着比分子间作用力更强的作用力——氢键,故水分子较稳定。
()(7)沸点:H2O>H2S>H2Se。
()答案:(1)×(2)×(3)√(4)√(5)×(6)×(7)×2.(2019·哈尔滨测试)下列各组物质各自形成晶体,均属于分子晶体的化合物是() A.NH3、P4、C10H8B.PCl3、CO2、H2SO4C.SO2、SiO2、P2O5D.CCl4、H2O、Na2O2解析:选B。
A中,P4(白磷)为单质,不是化合物;C中,SiO2为原子晶体;D中,Na2O2是金属氧化物,不是分子晶体。
1.分子晶体的物理性质(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。
有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
2.分子晶体的特例与熔、沸点高低的判断(1)稀有气体稀有气体单质是由原子直接构成的分子晶体,无化学键,晶体中只有分子间作用力。
(2)分子晶体熔、沸点高低的判断①组成和结构相似、不含氢键的分子晶体,相对分子质量越大,分子间作用力越强,熔、沸点越高。
如I2>Br2>Cl2>F2,HI>HBr>HCl。
②组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高。
如CH3OH>CH3CH3。
③含有分子间氢键的会导致熔、沸点反常升高。
如H2O>H2Te>H2Se>H2S。
④对于有机物中同分异构体,支链越多,熔、沸点越低。
⑤烃、卤代烃、醇、醛、羧酸等有机物一般随分子里碳原子数的增加,熔、沸点升高。
如C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
在解释下列物质性质的变化规律与物质结构间的因果关系时,可用范德华力解释的是()A.HF、HCl、HBr、HI 的热稳定性依次减弱B.F2、Cl2、Br2、I2的熔、沸点依次升高C.金刚石的熔点高于晶体硅D.C2H5OH 的沸点比CH3—O—CH3的高[解析]F2、Cl2、Br2、I2的相对分子质量依次增大,分子间的范德华力也依次增大,所以其熔、沸点也依次增大,B项符合题意;CH3—O—CH3的沸点比C2H5OH的低,是由于C2H5OH分子间形成氢键;HF、HCl、HBr、HI的热稳定性依次减弱,是由于H—X(X=F、Cl、Br、I)键的键能依次减小;键能:C—C键>Si—Si键,所以金刚石的熔点高于晶体硅。
[答案] B(1)分子晶体由于是通过分子间作用力结合在一起的,所以通常情况下熔、沸点较低,因此,可以通过熔、沸点的高低判断是否是分子晶体。
(2)组成相似的物质晶体类型一般也相同,因此同主族元素的化合物在比较时要特别注意这一方法的利用,如CO2和CS2的比较;但也有特例,如CO2和SiO2晶体类型并不相同。
分子晶体的概念1.下列说法中错误的是()A.只含分子的晶体一定是分子晶体B.所有的非金属氢化物都属于分子晶体C.几乎所有的酸都属于分子晶体D.碘升华时破坏了共价键解析:选D。
碘升华时,只破坏了分子间的范德华力,分子中的I—I键未被破坏(升华时I2分子不变)。
2.下列有关分子晶体的说法中一定正确的是()A.分子内均存在共价键B.分子间一定存在范德华力C.分子间一定存在氢键D.分子晶体全部为化合物解析:选B。
稀有气体元素组成的晶体中,不存在由多个原子组成的分子,分子间通过范德华力结合成晶体,分子内不存在任何化学键,故A项错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较强的氮、氧、氟原子结合的氢原子的分子之间或者分子之内,故B项正确,C项错误;部分非金属单质也是分子晶体,故D项错误。
分子晶体的特性3.(2019·南昌高二检测)下列性质适合于分子晶体的是()①熔点为1 070 ℃,易溶于水,水溶液导电②熔点为10.31 ℃,液态不导电,水溶液导电③能溶于CS2,熔点为112.8 ℃,沸点为444.6 ℃④熔点为97.81 ℃,质软,导电,密度为0.97 g·cm-3A.①④B.②③C.①③D.②④解析:选B。
分子晶体熔、沸点低,硬度小,不导电,故①④错误,选B。
4.下列分子晶体的熔、沸点由高到低的顺序是()①HCl②HBr③HI④CO⑤N2⑥H2A.①②③④⑤⑥B.③②①⑤④⑥C.③②①④⑤⑥D.⑥⑤④③②①解析:选C。
相对分子质量越大,分子间的范德华力越大,分子晶体的熔、沸点越高,相对分子质量接近的分子,极性越强,熔、沸点越高,故④>⑤。
典型的分子晶体(冰、干冰)的结构和性质[学生用书P40] 1.分子密堆积大多数分子晶体的结构有如下特征:如果分子间作用力只是范德华力,若以一个分子为中心,其周围通常可以有12个紧邻的分子,分子晶体的这一特征称为分子密堆积。
2.冰晶体(1)冰晶体的结构:冰晶体中,水分子间主要通过氢键形成晶体。
由于氢键具有一定的方向性,一个水分子与周围四个水分子结合,这四个水分子也按照同样的规律再与其他的水分子结合。
这样,每个O原子周围都有四个H原子,其中两个H原子与O原子以共价键结合,另外两个H原子与O原子以氢键结合,使水分子间构成四面体骨架结构。
其结构可用下图表示。
(2)冰晶体的性质:由于氢键具有方向性,冰晶体中水分子未采取密堆积方式,这种堆积方式使冰晶体中水分子的空间利用率不高,留有相当大的空隙。
当冰刚刚融化成液态水时,水分子间空隙减小,密度反而增大,超过4 ℃时,分子间距离加大,密度渐渐减小。
3.干冰(1)干冰的结构:固态CO2称为干冰,干冰也是分子晶体。
CO2分子内存在C===O共价键,分子间存在分子间作用力,CO2的晶胞呈面心立方体形,立方体的每个顶角有一个CO2分子,每个面上也有一个CO2分子。
每个CO2分子与12个CO2分子等距离相邻(在三个互相垂直的平面上各4个或互相平行的三层上,每层上各4个)(如图所示)。
(2)干冰的性质:干冰的外观很像冰,硬度也跟冰相似,熔点却比冰低得多;在常压下极易升华,在工业上广泛用作制冷剂;由于干冰中的CO2之间只存在范德华力不存在氢键,密度比冰的高。
(2019·济宁高二质检)下列有关冰和干冰的叙述不正确的是()A.干冰和冰都是由分子密堆积形成的晶体B.冰晶体中每个水分子周围只有4个紧邻的水分子C.干冰比冰的熔点低得多,常压下易升华D.干冰中只存在范德华力不存在氢键,一个分子周围有12个紧邻的分子解析:选A。
干冰晶体中CO2分子间作用力只是范德华力,分子采取密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性和饱和性,故每个水分子周围只有4个紧邻的水分子,采取非密堆积的方式,空间利用率小,因而密度小。
干冰熔化只需克服范德华力,冰融化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
冰、干冰晶体结构(1)水分子间主要作用力是氢键,具有特殊性。
冰的晶体结构如图。
冰晶体中,每个水分子与其他4个水分子形成氢键,每个水分子平均形成2个氢键(每个氢键由2个水分子均摊,故4×12=2)。
(2)干冰晶体的结构代表了分子晶体结构的普遍性,晶体中分子堆积方式为分子密堆积,即以一个分子为中心,其周围通常可以有12个紧邻的分子。
(1)如图为干冰的晶体结构示意图。
通过观察分析,每个CO 2分子周围紧邻等距离的CO 2分子有________个,有________种取向不同的CO 2分子。
将CO 2分子视作质点,设晶胞边长为a pm ,则紧邻的两个CO 2分子的距离为________pm 。
(2)在冰晶体中,水分子之间的主要作用力是________,还有________,由于其主要作用力与共价键一样具有________性,故1个水分子周围只能有________个紧邻的水分子,这些水分子位于________的顶角。
这种排列方式使冰晶体中水分子的空间利用率________(填“较大”或“较小”),故冰的密度比水的密度要________(填“大”或“小”)。
[解析] 观察并分析干冰和冰的晶体结构,可知在干冰晶体中,CO 2分子排列为面心立方堆积,顶角为一种取向,三对平行面分别为三种不同取向。
离顶角的CO 2分子最近的是面心的分子,两者的距离为面对角线的一半,即22a pm 。
每个CO 2分子周围紧邻等距离的CO 2共有12个。
在冰晶体中,水分子间的主要作用力是氢键,氢键具有方向性,1个水分子周围只有4个紧邻的水分子,使冰晶体中水分子的空间利用率小,密度较小。
[答案] (1)12 4 22a (2)氢键 范德华力 方向 4 四面体 较小 小 冰晶体中的主要作用力是氢键,氢键具有方向性,可形成如图的构架形式,则该晶体中每个水分子有________个氢键。
解析:每个水分子与四个方向的4个水分子形成氢键,每个氢键为2个水分子共用,故每个水分子中氢键个数为4×12=2。