醛酮α-H反应
- 格式:ppt
- 大小:453.50 KB
- 文档页数:7

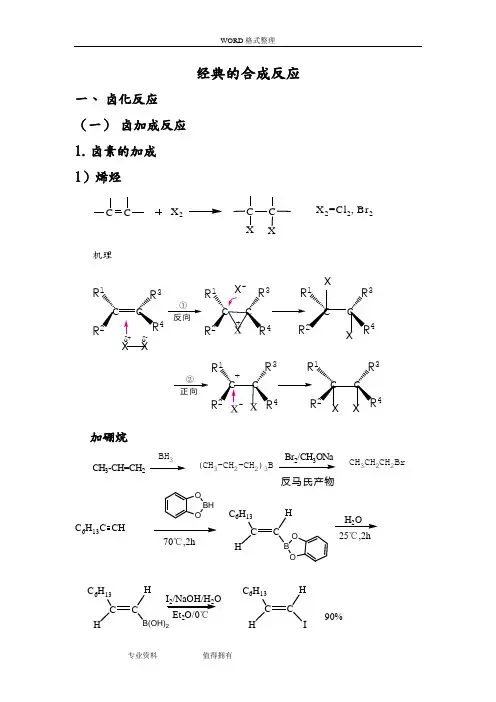
经典的合成反应一、 卤化反应 (一) 卤加成反应 1. 卤素的加成 1)烯烃X 2CC XX 2=Cl 2, Br 2机理c c c c c c x xR 1R R 34R 1R 4R 334R R ①x-R 1R 4R 3R 34R R 1②+c c c c δ-加硼烷CH 3-CH=CH 2BH 3(CH 3-CH 2-CH 2)3B23CH 3CH 2CH 2Br反马氏产物C 6H 13C CHBH O 70℃,2hC CC 6H 13HHO B 25℃,2hC CC 6H 13HH2C CC 6H 13HHI90%I 2/NaOH/H 2O 2H 2O3)不饱和羧酸 2. 卤化氢的加成加卤化氢H X C C H X =H C l, H B r, HI机理C R1R3+C R2C R2HH反向同向CH 3CH=CH 2CH 3CHBrCH 3CH 3CH 2CH 2BrMarkovnikov 加成反Markovnikov 加成Ph-CH=CH 2HBrHBr H 2O 2或光照Ph--C-CH 3Ph-CH 2CH 2Br Br反马氏规则3. 次卤酸(酯)、N-卤代酰胺加成C CX 2CCX+H 2OHXX 2=Cl 2, Br 2+(二) 卤代反应 1.烃类 1)脂肪烃芳烃卤代反应 机理+E+Eπ-络合物HEE +H +σ-络合物HX X-H ++-σ-络合物举例:Cl CH 3+CH 3CH 3CH 3CH 3CH 3BrClBr ++22OHOHBr°0 COH BrBr BrH 2O 2H 2O 2Br 22Br 2/Bu-NH 2-70 COHBrBr OHBrBr °OHOHOH2.羰基化合物羰基化合物的卤代反应机理OR R'δδCC OHB C COBHCOC COC C C等于C OHCOO HC OCHCOCH1)醛、酮酮α-H 卤代反应R- C - CH 3OR- C - CH 2BrO2亲电取代反应C CHCCC COC CH OHOH酸催化机理C C H OH慢C C C C X碱催化机理举例:O 2NC-CH 3O O 2N C-CH 2BrOHBrBr 2+氯霉素的制备溴对酮的加成CH 2CH 2CHH 2C OHC CHCH 2CH 33COHCH 2CH 23BrH 2C OCH 2CH 2CH 3H Br HBr-Br 2C CH 2CH 2CH 32C OCHCH 2CH 3H 3C OBr+(1.5%)(58%)酮自由基反应(饱和烃、苄位和烯丙位的卤取代反应、某些不饱和烃的卤加成反应以及羧基、重碳基的卤置换反应)α-羰基自由基取代OCC O R'H R''R'''+Br2+CC OR'Br R''R'''Br 22Br光O +HBrOHBrO O O OBrBr CHOCHO Br2)羧酸衍生物 3.醇、酚、醚 1)醇 2)酚 3)醚4.羧酸1)羧羟基2)羧酸脱羧5.其他官能团的卤代反应1)卤化物2)磺酸酯3)芳香重氮盐化合物二、烃化反应(一)碳原子的烃化反应1.芳烃的烃化Friedel-Crafts 烷基化反应芳烃与卤代烃、醇类或烯类化合物在Lewis催化剂(如AlCl3,FeCl3, H2SO4, H3PO4, BF3, HF等)存在下,发生芳环的烷基化反应。






大学有机化学反应方程式总结醛酮的还原与氧化反应醛酮是一类重要的有机化合物,其在有机合成和药物合成等领域扮演着重要角色。
了解和掌握醛酮的还原与氧化反应是有机化学学习的基础知识之一。
本文将总结大学有机化学中常见的醛酮还原与氧化反应的方程式和反应条件。
一、醛酮的还原反应醛酮的还原反应是指其被还原剂还原为相应的醇。
常见的醛酮还原反应的反应剂有金属氢化物和还原性金属,如氢气(H2)、亚磷酸(H3PO2)、亚硫酸氢钠(NaHSO3)等。
1. 醛的还原反应:醛在还原反应中可以被还原为一级醇。
常见的反应剂有氢气(H2)和催化剂(如铂、钯)。
下面是醛的还原反应方程式示例:RCHO + H2 -> RCH2OH其中,R为有机基团。
2. 酮的还原反应:酮在还原反应中可以被还原为二级醇。
常用的还原剂是亚磷酸(H3PO2)、亚硫酸氢钠(NaHSO3)等。
下面是酮的还原反应方程式示例:RCOR' + 2H3PO2 -> RCH(OH)R' + 2H3PO3其中,R和R'为有机基团。
3. α,β-不饱和醛酮的还原反应:α,β-不饱和醛酮在还原反应中会被还原为相应的醇。
常见的还原剂有亚磷酸(H3PO2)、亚硫酸氢钠(NaHSO3)等。
下面是α,β-不饱和醛酮的还原反应方程式示例:RCOCH=CHR' + H3PO2 -> RCH2CH(OH)R' + H3PO3其中,R和R'为有机基团。
二、醛酮的氧化反应醛酮的氧化反应是指其被氧化剂氧化为相应的羧酸。
常见的醛酮氧化反应的反应剂有氧气(O2)、過氧化氫(H2O2)和过氧化苯甲酰(PhCOOOH)等。
1. 醛的氧化反应:醛在氧化反应中可以被氧化为相应的羧酸。
常见反应剂是氧气(O2)和过氧化氢(H2O2)。
下面是醛的氧化反应方程式示例:RCHO + O2 -> RCOOH其中,R为有机基团。
2. 酮的氧化反应:酮在氧化反应中可以被氧化为相应的羧酸。


如化合物存在酮式烯醇式互变现象,在进行HPLC方法开发时则很可能出现同一化合物有两个响应接近的峰,或者是一个主峰伴随一个较大的未知峰,特别是后一种情况,如果把酮式烯醇式互变产生的未知峰当成杂质峰,却无论如何也精制不掉,造成错误的判断,甚至严重影响研究进度。
由于酮式烯醇式互变现象在药物合成及其他研究环节属于较为常见的情况,故有必要对此进行说明和探讨。
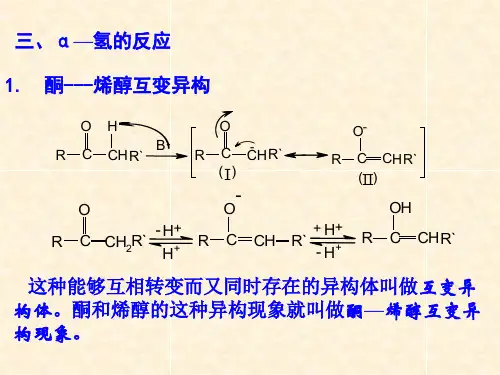
一、概念解析醛、酮分子中由于羰基的影响,α-H变得活泼,具有酸性,所以带有α-H的醛、酮具有互变异构的性质。
在溶液中有α-H的醛、酮是以酮式和烯醇式互变平衡而存在的。
如下图所示:有两类结构式在药物领域非常常见:1)β-二羰基化合物,如乙酰丙酮及其衍生物,由于其具有活泼的α-H,经常出现在药物合成的起始物料和中间体中。
2)苯酚衍生物或类似结构,如头孢羟氨苄,也属于极为常见的情况。
二、互变异构体的差异以乙酰丙酮为例,酮式状态为独立的两个碳氧双键,而烯醇式状态则形成共轭双键。
烯醇式的最大吸收波长相对酮式向长波长移动,且吸光度增加。
酮式状态没有亲水基团,极性非常小,而烯醇式状态有羟基,极性较大。
上述内容说明酮式与烯醇式在物理性质和化学性质都可能存在差异,在HPLC上的表现就是烯醇式在反相色谱中保留较弱,出峰较早,且光谱图、响应值均有可能不同于酮式。
三、影响因素1.溶剂极性以乙酰乙酸乙酯为例,实验测得,在不同极性溶剂中乙酰乙酸乙酯的烯醇式含量有所差异[1]。
表1 中列出18 ℃时,在不同极性溶剂的稀溶液中乙酰乙酸乙酯的烯醇式异构体的含量。
数据表明,溶剂介质的极性越强,其烯醇式含量越少。
为什么有如此现象呢?乙酰乙酸乙酯分子重排后,形成的烯醇式结构存在分子内氢键,构成环状结构,稳定性增加,因此在非极性溶剂中烯醇式结构的含量较大;而在极性介质中特别是含活泼氢的极性介质中,其活泼氢与酮式结构的羰基氧易于形成分子间氢键,比亚甲基上的氢竞争羰基氧形成氢键的能力强, 导致分子内氢键形成能力较小,从而使亚甲基上的氢重排能力减弱,因而,互变平衡有利于向酮式方向移动,使其烯醇式结构明显减少。
醛和酮 亲核加成反应一、基本要求1.掌握醛酮的命名、结构、性质;醛酮的鉴别反应;不饱和醛酮的性质 2.熟悉亲核加成反应历程及其反应活性规律;醛酮的制备二、知识要点(一)醛酮的分类和命名(二)醛酮的结构:醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。
C=O 双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。
(三)醛酮的化学性质醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。
氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是羰基中带正电荷的碳。
所以羰基易与亲核试剂进行加成反应(亲核加成反应)。
此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H )较活泼,能发生一系列反应。
亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。
1.羰基上的亲核加成反应醛,酮亲核加成反应的影响因素:羰基碳上正电性的多少有关,羰基碳上所连的烃基结构有关,亲核试剂的亲核性大小有关。
(1)与含碳的亲核试剂的加成 ○1氰氢酸: ○2 炔化物C OC O H C HO 121.8116.5。
sp 2杂化键键近平面三角形结构πσC CRO H H ( )δδ酸和亲电试剂进攻富电子的氧碱和亲核试剂进攻缺电子的碳涉及醛的反应 氧化反应( )αH 的反应羟醛缩合反应卤代反应C O C OH+ HCN CN 羟基睛α○3 有机金属化合物:(2)与含氮的亲核试剂的加成 ○11o 胺 ○2 2o 胺 ○3氨的多种衍生物:(3)与含硫的亲核试剂的加成-------亚硫酸氢钠产物α-羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、酮。
故此反应可用以提纯醛、酮。
反应范围: 醛、甲基酮、八元环以下的脂环酮。
反应的应用:鉴别化合物,分离和提纯醛、酮。