醛酮的加成反应
- 格式:doc
- 大小:95.50 KB
- 文档页数:1



醛酮的化学性质及应用醛酮是一类重要的有机化合物,它们的化学性质和应用非常广泛。
下面我将分别介绍醛和酮的化学性质和应用。
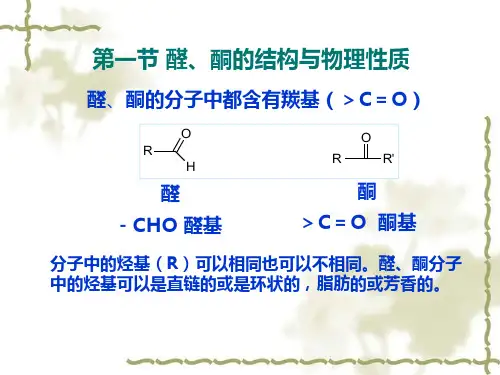
醛是含有羰基(C=O)官能团的有机化合物,通式为RCHO。
它们具有以下几个重要的化学性质:1. 氧化还原性:醛能够与氧气或氧化剂反应,发生氧化反应生成相应的酸。
例如,乙醛(CH3CHO)在空气中容易被氧化为醋酸(CH3COOH)。
2. 缩合反应:醛能够与众多化合物发生缩合反应,生成相应的缩合产物。
其中最常见的是与胺类化合物反应生成相应的胺缩合物。
3. 加成反应:醛能够与众多化合物发生加成反应,生成相应的加成产物。
其中最重要的是与氨、水、醇等发生加成反应生成相应的加成产物。
4. 氧化反应:醛在适当条件下可以发生氧化反应生成相应的羧酸。
例如,乙醛可以经过氧化反应生成醋酸。
酮则是含有羰基(C=O)官能团的有机化合物,通式为R2CO。
它们具有以下几个重要的化学性质:1. 氢化还原性:酮与氢气或还原剂反应,发生氢化还原反应生成相应的醇。
例如,丙酮(CH3COCH3)在适当条件下可以被氢气还原为异丙醇(CH3CH(OH)CH3)。
2. 缩合反应:酮也可以与众多化合物发生缩合反应,生成相应的缩合产物。
例如,在肟反应中,酮与氢氧胺可以发生缩合反应生成肟。
3. 亲核加成反应:由于酮分子中的羰基上没有可供亲核试剂进攻的活性氢原子,因此酮分子不容易发生亲核取代反应。
但在碱性条件下,酮的α-碳上的酸性氢可以被碱取代,形成相应的加成产物。
4. 氧化反应:酮在适当条件下可以发生氧化反应生成相应的酮酸。
例如,丙酮可以经过氧化反应生成丙二酸。
醛酮化合物具有广泛的应用领域,以下是其中几个重要的应用:1. 工业化学:醛酮化合物可以作为重要的合成原料,广泛用于合成有机合成试剂、药物、染料、香料等。
例如,乙醛被广泛用于合成乙醇、醋酸、醋酸乙酯等化合物。
2. 生物化学:醛酮化合物在生物化学中具有重要的作用,如醛酮化合物是糖的代谢中间产物,在糖的酵解和糖新生中起着关键作用。

原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。

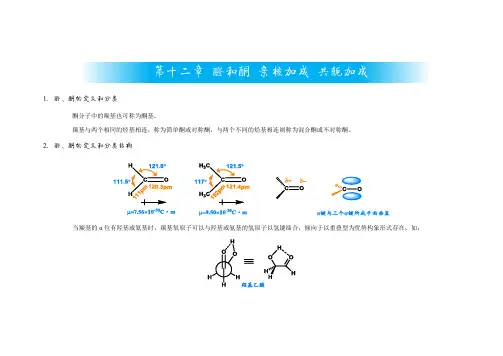
1. 醛、酮的定义和分类酮分子中的羰基也可称为酮基。
羰基与两个相同的烃基相连,称为简单酮或对称酮,与两个不同的烃基相连则称为混合酮或不对称酮。
2. 醛、酮的定义和分类结构当羰基的α位有羟基或氨基时,羰基氧原子可以与羟基或氨基的氢原子以氢键缔合,倾向于以重叠型为优势构象形式存在,如:第十二章 醛和酮 亲核加成 共轭加成3.醛、酮的物理性质由于羰基的偶极矩增加了分子间的吸引力,因此醛、酮的沸点比相应相对分子质量的烷烃高,但比醇低。
醛酮的氧原子可以与水形成氢键,因此低级醛酮能与水混溶(甲醛易溶于水,丙酮能与水以任意比例互溶,乙醛的溶解度为16g(100g H2O)-1)。
脂肪族醛酮相对密度小于1,芳香族醛酮相对密度大于1。
4.醛、酮的反应(1)羰基的亲核加成由于电子效应和空间位阻的原因,醛比酮表现的更活泼。
1)和含碳亲核试剂的加成①与有机金属化合物的加成此反应仅限于酮的烃基和格氏试剂的烃基都不太大,即空间位阻不很突出。
否则将发生两种“不正常”的反应:烯醇化反应及酮被还原。
烷基锂体积较小,因此当格氏试剂反应结果不好时,有时可以用烷基锂进行反应,会得到较好的结果,因此,格氏试剂与烷基锂可以相互补充。
当羰基与一个手性中心相连时,它与格氏试剂(也包括氢化铝锂等试剂)反应就是一个手性诱导反应。
亲核加成反应遵循Cram规则一,即:亲核试剂从空间位阻较小的一边进攻羰基碳原子。
为什么R与L取重叠型构象?因为这些试剂与羰基发生加成反应时,它们的金属部分须与羰基氧络合,因此羰基氧原子一端位阻增大,α碳上最大基团(L)与羰基处于反式,故R与L取重叠型构象为最有利于反应的构象。
②与HCN的加成丙酮与氢氰酸在氢氧化钠的水溶液中反应,生成丙酮羟腈,然后和甲醇在硫酸的作用下,即发生失水及腈的醇解反应,氰基变成甲氧酰基(-COOCH3):工业上就是利用这个反应步骤合成有机玻璃的。
碱性条件能加速该反应,这是由于氢氰酸是弱酸,其离解很少,[CN-]浓度很低,当加入NaOH时,碱与H+ 结合促使离解平衡右移,使亲核性的增大,但是碱性不能太强,因为最后还需要H+才能完成反应。
醛酮的羰基上的加成反应羰基双键与烯烃不同,由于n键的极化,氧原子带部分负电荷,碳原子带部分正电荷,由于氧原子可以形成稳定的氧负离子,有较大容纳负电荷的能力,所以碳氧双键中反应活性中心是带正电的碳原子,容易与带负电荷或有未共用电子对的原子或原子团(亲核试剂)相作用。
这种由亲核试剂进攻而发生的加成叫亲核加成。
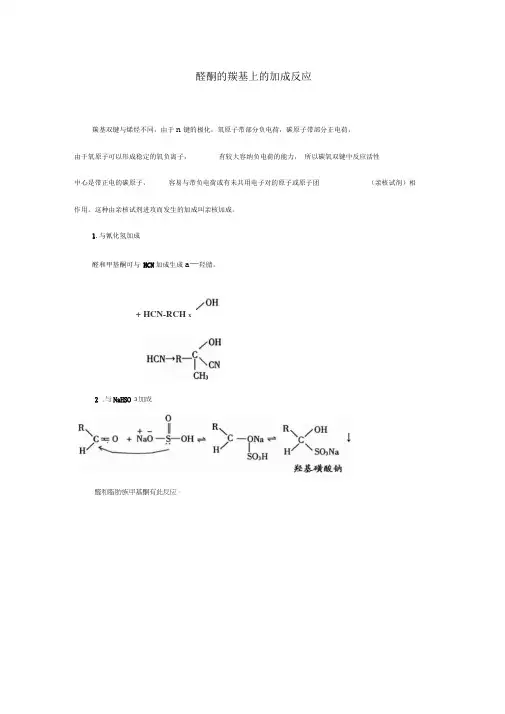
1.与氰化氢加成醛和甲基酮可与HCN加成生成a—羟腈。
+ HCN-RCH x2 .与NaHSO 3加成醛和脂肪族甲基酮有此反应。
这一反应是典型的可逆反应,所以NaHSO 3溶液是饱和的,而且需过量。
此反应常用于分离提纯醛酮。
RCHO+ NaQ+ SOi+ HiO R\ /OH:C H/X SOsNaRCHO+ NU2SO1+ H20 碳原子数小于8以下的环酮也有此反应。
3.与格氏试剂反应4 •与醇的加成⑴•醛与醇的反应干 HCt R \ /°H wh Z ™RCHO + fVOH {无水) ------ (涪泼):唁A :C(穗定)H /、OfV H /、0卍半缩醛 第醛等物质的量的醇与醛反应产物叫半缩醛, 半缩醛很活泼,通常可再和1mol 醇生成缩醛, 缩醛较稳定可分离出来。
缩醛在稀酸中加热可水解成原来的醛。
R\ /°R R\、C +HQ 皿;C = 0+2R ,0HH /、0R' H /有机合成中常利用此性质保护醛基。
⑵.酮在同样条件下可生成缩酮。
有些酮反应较难,可用二元醇反应,可生成环状缩酮。
5 .与氨的衍生物反应 NO JNHiNH -N0?醛酮与格氏试剂反应是合成醇的重要方法之一。
\ \ /R 0+ RMgX-+ X C Z Z X QMgX HiOH*从上式可看出,甲醛得 1 °ROH ,醛生成2 °ROH ,酮生成3 °ROH 。
例女口0+ 匸—CHj\ 诙/ 无水乙塔氨的衍生物如羟氨(NH2OH )、肼(NH2NH2)、2, 4 —二硝基苯肼()均为弱亲核试剂,可与醛酮羰基反应。



α,β—不饱和醛酮的反应
不饱和醛酮是一类含有碳碳双键和醛基或酮基的有机化合物。
它们可以参与多种反应,下面列举了其中一些常见的反应。
1. 加成反应:不饱和醛酮可以与亲核试剂发生加成反应。
例如,它们可以与碱性溶液中的亲核试剂如水、胺或醇反应,生成相应的加成产物。
2. Michael加成:不饱和醛酮可以参与Michael加成反应,与
含有可负电荷的亲核试剂(如醇、胺、硫醇等)反应,形成
1,4-加成产物。
3. 氧化反应:不饱和醛酮可以被氧化剂如氧气、过氧化氢等氧化,形成相应的醛酸或酮酸。
4. 还原反应:不饱和醛酮可以通过还原反应还原为相应的醇。
还原剂包括金属铝、钠、锂等还原剂,还有氢气与催化剂(如铂或钯)反应。
5. 缩合反应:不饱和醛酮可以与胺反应形成亲缘结构的胺缩合产物。
6. 羟基化反应:不饱和醛酮可以与水或醇反应,羰基碳上的氢可以被羟基取代。
需要注意的是,不同的不饱和醛酮结构对应的反应也会有所不
同。
因此,具体的反应条件和产物取决于具体的不饱和醛酮结构和试剂条件。