二组分固液相图
- 格式:doc
- 大小:178.50 KB
- 文档页数:7



⼆组分固液相图5.4⼆组分系统的固?液平衡5.4.1形成低共熔物的固相不互溶系统当所考虑平衡不涉及⽓相⽽仅涉及固相和液相时,则体系常称为"凝聚相体系" 或"固液体系"0固体和液体的可压缩性甚⼩,⼀般除在⾼压下以外,压⼒对平衡性质的影响可忽略不计,故可将压⼒视为恒量。
由相律:/="= C-^+2-n r=2-d> + 2-l = 3-£Z>因体系最少相数为①=1,故在恒压下⼆组分体系的最多⾃由度数 f * =2,仅需⽤两个独⽴变量就⾜以完整地描述体系的状态。
由于常⽤变量为温度和组成,故在⼆组分固液体系中最常遇到的是T?x (温度?摩尔分数)或T?①(温度?质量分数)图。
⼆组分固?液体系涉及范围相当⼴泛,最常遇到的是合⾦体系、⽔盐体系、双盐体系和双有机物体系等。
在本节中仅考虑液相中可以完全互溶的特殊情况°这类体系在液相中可以互溶,⽽在固相中溶解度可以有差别。
故以其差异分为三类:(1)固相完全不互溶体系;(2)固相部分互溶体系和(3)固相完全互溶体系。
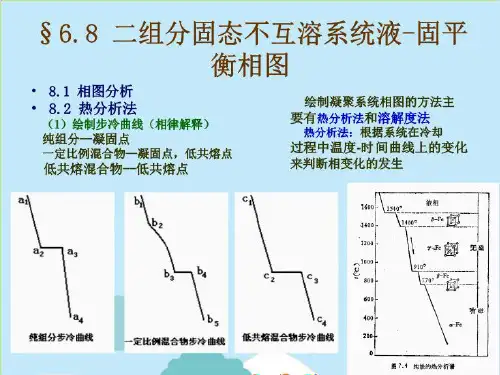
进⼀步分类可归纳如下:F『形成简单低共熔物休系固相完全不互溶体棗形成化合物体系⼻相合熔点化合物怵系不相合熔点化合物俸系EM体疾「没有最1■嚴最⾼熔点型固相完全互熔体茶最瞬点型最⾼熔点型■1固相部分互熔体系,⼀低共熔点型、转熔点型研究固液体系最常⽤实验⽅法为“热分析”法及“溶解度”法。
本节先在“形成低共熔物的固相不互溶体系”中介绍这两种实验⽅法,然后再对各种类型相图作⼀简介。
(⼀)⽔盐体系相图与溶解度法1 ?相图剖析图5-27为根据硫酸铵在不同温度下于⽔中的溶解度实验数据绘制的⽔盐体系相图,这类构成相图的⽅法称为 "溶解度法" 纵坐标为温度t 「C ),横坐标为硫酸铵质量分数(以①表⽰)。
图中FE 线是冰与盐溶液平衡共存的曲线,它表⽰⽔的凝固点随盐的加⼊⽽下降的规律,故⼜称为⽔的凝固点降低曲线。



二组分固液系统相图的测定1.实验目的①用热分析法(步冷曲线法)测绘Pb-Sn二组分固液系统相图②了解固液相图的特点,进一步学习和巩固相律等有关知识2.实验原理①步冷曲线法:是相图绘制工作中常用的一种实验方法。
它是利用金属或合金在加热或冷却过程中发生相变时,潜热的释出或吸收及热容的突变,来得到金属或合金中相变温度的方法。
通常的做法是先将金属或合金全部融熔化,然后让其在一定环境中自行冷却,并在记录仪上自动画出(或人工画出)温度随时间变化的步冷曲线。
②当熔融的系统均匀冷却时,如果系统不发生相变,则系统的温度随时间的变化是均匀的,冷却速度较快;若在冷却过程中发生了相变,由于在相变过程中伴随着放热效应,所以系统的温度随时间变化的速率发生变化,系统的冷却速率减慢,步冷曲线上出现转折。
当继续冷却到某一点时,系统以低共熔混合物的固体析出。
在低共熔混合物全部凝固以前,系统温度不变,因此步冷曲线上出现水平线段;完全凝固后,温度才迅速下降。
由此可知,对组成一定的二组分低共熔混合物系统,可以根据它的步冷曲线得出有固体析出的温度和低共熔点温度,根据一系列组成不同系统的步冷曲线的各转折点,即可画出二组分系统的相图。
③本实验通过步冷曲线法获得的数据构建一个相图,用于表示不同温度、组成下的固相、液相平衡。
不同组成的二组分溶液在冷却过程中析出固相的温度可以通过观察温度-时间的曲线斜率变化进行检测。
3.仪器与试剂SWKY-1型数字控温仪、KWL-09可控升降温电炉、PT-100热电阻温度传感器、配套软件、样品管锡(化学纯)、铅(化学纯)4.实验步骤①配置样品。
样品已事先配置好,放入编号为1~10的样品管中,含锡质量百分数分别为0%、10%、15%、20%、35%、50%、62%、80%、95%、100%。
②打开控温仪和电路开关。
启动数据采集系统,点击“设置-通讯口”设置通讯端口。
点击“设置-设置坐标系”设置采样时间长短(约60分钟)和采样温度区间(约50~350℃);设置控制温度,对控温仪按“工作/置数”键,再依次按“×100”、“×10”、“×1”、“×0.1”键(控制温度为380.0℃)。
实验 二组分固液金属相图的测绘I. 目的与要求一、 用热分析法测绘铅-锡二元金属相图,了解固-液相图的特点 二、 学会热电偶的制作、标定和测温技术 三、 掌握自动平衡记录仪的使用方法I I. 基本原理 一、二组分固-液相图人们常用图形来表示体系的存在状态与组成、温度、压力等因素的关系。
以体系所含物质的组成为自变量,温度为应变量所得到的T-x 图是常见的一种相图。
二组分相图已经得到广泛的研究和应用。
固-液相图多应用于冶金、化工等部门。
二组分体系的自由度与相的数目有以下关系:自由度 = 组分数 – 相数 + 2 (1)由于一般的相变均在常压下进行,所以压力P 一定,因此以上的关系式变为:自由度 = 组分数 – 相数 + 1 (2)又因为一般物质其固、液两相的摩尔体积相差不大,所以固-液相图受外界压力的影响颇小。
这是它与气-液平衡体系的最大差别。
图1以邻-、对-硝基氯苯为例表示有最低共熔点相图的构成情况:高温区为均匀的液相,下面是三个两相共存区,至于两个互不相溶的固相A 、B 和液相L 三相平衡共存现象则是固-液相图所特有的。
从式(2)可知,压力既已确定,在这三相共存的水平线上,自由度等于零。
处于这个平衡状态下的温度TE 、物质组成A 、B 和E x 都不可变。
TE 和E x 构成的这一点成为最低共熔点。
其它类型的固一液相图将在下面讨论。
二、热分析法和步冷曲线热分析法是相图绘制工作中常用的一种实验方法。
按一定比例配成均匀的液相体系,让它缓慢冷却。
以体系温度对时间作图,则为步冷曲线。
曲线的转折点表征了某一温度下发生相变的信息。
由体系的组成和相变点的温度作为T-x 图上的一个点,众多实验点的合理连接就成了相图上的一些相线,并构成若干相区。
这就是用热分析法绘制固-液相图的概要。
图1(b )为与图1(a )标示的三个组成相应的步冷曲线。
曲线(I )表示将纯B 液体冷却至T B 时,体系温度将保持恒定,直到样品完全凝固。
5.4二组分系统的固〜液平衡5.4.1形成低共熔物的固相不互溶系统当所考虑平衡不涉及气相而仅涉及固相和液相时,则体系常称为"凝聚相体系" 或"固液体系"0固体和液体的可压缩性甚小,一般除在高压下以外,压力对平衡性质的影响可忽略不计,故可将压力视为恒量。
由相律:/="= C-^+2-n r=2-d> + 2-l = 3-£Z>因体系最少相数为①=1,故在恒压下二组分体系的最多自由度数 f * =2,仅需用两个独立变量就足以完整地描述体系的状态。
由于常用变量为温度和组成,故在二组分固液体系中最常遇到的是T〜x (温度〜摩尔分数)或T〜①(温度〜质量分数)图。
二组分固〜液体系涉及范围相当广泛,最常遇到的是合金体系、水盐体系、双盐体系和双有机物体系等。
在本节中仅考虑液相中可以完全互溶的特殊情况°这类体系在液相中可以互溶,而在固相中溶解度可以有差别。
故以其差异分为三类:(1)固相完全不互溶体系;(2)固相部分互溶体系和(3)固相完全互溶体系。
进一步分类可归纳如下:F『形成简单低共熔物休系固相完全不互溶体棗形成化合物体系彳相合熔点化合物怵系不相合熔点化合物俸系EM体疾「没有最1■嚴最高熔点型固相完全互熔体茶最瞬点型最高熔点型■1固相部分互熔体系,一低共熔点型、转熔点型研究固液体系最常用实验方法为“热分析”法及“溶解度”法。
本节先在“形成低共熔物的固相不互溶体系”中介绍这两种实验方法,然后再对各种类型相图作一简介。
(一)水盐体系相图与溶解度法1 •相图剖析 图5-27为根据硫酸铵在不同温度下于水中的溶解度实验数据 绘制的水盐体系相图,这类构成相图的方法称为 "溶解度法" 纵坐标为温度t 「C ),横坐标为硫酸铵质量分数(以 ①表 示)。
图中FE 线是冰与盐溶液平衡共存的曲线,它表示水 的凝固点随盐的加入而下降的规律,故又称为水的凝固点降 低曲线。
二组分固液相图的绘制一、【目的要求】1.掌握热分析法绘制二组分固液相图的原理及方法;2.了解纯物质与混合物步冷曲线的区别并掌握相变点温度的确定方法;3.了解简单二组分固液相图的特点;4.掌握数字控温仪及KWL-80可控升温电炉的使用方法。
二、【实验原理】见教材三、【仪器试剂】SWKY数字控温仪1台;KWL-08可控升降温电炉1台,宽肩硬质玻璃样品管5只,纯Bi;纯Cd;石蜡油等。
四、【实验步骤】1.配制含Cd分别为0%、25%、50%、70%,100%的Bi、Cd混合物30g,分别装入硬质试管中,加少许石蜡油(1-3g)以防加热过程中样品氧化。
2.按图II-7-3连接SWKY数字控温仪与KWL-08可控升降温电炉,接通电源,将电炉置于外控状态。
3. 将不锈钢保护筒放入炉膛内,后把料管和传感器放在保护筒内,将电源开关置于“开”,仪器默认控温仪处于“置数”状态,“设定温度”为370℃,默认为320℃。
将控温仪调节到“工作”状态,系统开始升温。
【从炉体加热电源指示表上可以看到通电情况。
由于采用了外控控温方式,炉体上的加热调节开关不起作用。
】4.达到设定温度后,试样保温2-3 min,使试样熔化,再将传感器放入样品管中心。
(温度可能继续升高,可停止加热)5.将控温仪置于“置数”状态,电炉“外控”改为“内控”,“加热量调节”旋钮逆时针调至0,“冷风量调节”旋钮(电压 1 V左右)使体系冷却速度保持在4-6℃/ min 左右。
6.设定控温仪的定时时间间隔,15 s记录一次温度,直到出现平台以下,结束一组实验数据,画出步冷曲线。
7.换其它试样,重复3-6 步操作,依次测出所配试样的步冷曲线数据。
【注意事项】1. 加热时,将传感器至于炉膛内,以防温度过高。
2.实验炉加热时,温升有一定的惯性,炉膛温度可能会超过370℃,但如果发现炉体温度超过420C还在上升,应立即按“工作/置数”按钮,使控温仪上的“置数”灯亮,将测温探头插入样品管中,开启冷却风扇,转入测量步冷曲线的实验过程3. 冷却时,速度不宜过快,以防转折点不明显。
5.4二组分系统的固~液平衡5.4.1形成低共熔物的固相不互溶系统当所考虑平衡不涉及气相而仅涉及固相和液相时,则体系常称为"凝聚相体系"或"固液体系"。
固体和液体的可压缩性甚小,一般除在高压下以外,压力对平衡性质的影响可忽略不计,故可将压力视为恒量。
由相律:因体系最少相数为Φ=1,故在恒压下二组分体系的最多自由度数f*=2,仅需用两个独立变量就足以完整地描述体系的状态。
由于常用变量为温度和组成,故在二组分固液体系中最常遇到的是T~x(温度~摩尔分数)或T~ω(温度~质量分数)图。
二组分固~液体系涉及范围相当广泛,最常遇到的是合金体系、水盐体系、双盐体系和双有机物体系等。
在本节中仅考虑液相中可以完全互溶的特殊情况。
这类体系在液相中可以互溶,而在固相中溶解度可以有差别。
故以其差异分为三类:(1)固相完全不互溶体系;(2)固相部分互溶体系和(3)固相完全互溶体系。
进一步分类可归纳如下:研究固液体系最常用实验方法为“热分析”法及“溶解度”法。
本节先在“形成低共熔物的固相不互溶体系”中介绍这两种实验方法,然后再对各种类型相图作一简介。
(一)水盐体系相图与溶解度法1.相图剖析图5-27为根据硫酸铵在不同温度下于水中的溶解度实验数据绘制的水盐体系相图,这类构成相图的方法称为"溶解度法"。
纵坐标为温度t(℃),横坐标为硫酸铵质量分数(以ω表示)。
图中FE线是冰与盐溶液平衡共存的曲线,它表示水的凝固点随盐的加入而下降的规律,故又称为水的凝固点降低曲线。
ME线是硫酸铵与其饱和溶液平衡共存的曲线,它表示出硫酸铵的溶解度随温度变化的规律(在此例中盐溶解度随温度升高而增大),故称为硫酸铵的溶解度曲线。
一般盐的熔点甚高,大大超过其饱和溶液的沸点,所以ME不可向上任意延伸。
FE线和ME线上都满足Φ =2,f *=1,这意味温度和溶液浓度两者之中只有一个可以自由变动。
FE线与ME线交于E点,在此点上必然出现冰、盐和盐溶液三相共存。
当Φ=3 时,f*=0 ,表明体系的状态处于E点时,体系的温度和各相的组成均有固定不变的数值;在此例中,温度为 -18.3℃,相应的硫酸铵浓度为 39.8%。
换句话说,不管原先盐水溶液的组成如何,温度一旦降至 -18.3℃,体系就出现有冰(Q 点表示)、盐(I点表示)和盐溶液(E点表示)的三相平衡共存,连接同处此温度的三个相点构成水平线QEI,因同时析出冰、盐共晶体,故也称共晶线。
此线上各物系点(除两端点Q和I外)均保持三相共存,体系的温度及三个相的组成固定不变。
倘若从此类体系中取走热量,则会结晶出更多的冰和盐,而相点为E的溶液的量将逐渐减少直到消失。
溶液消失后体系中仅剩下冰和盐两固相,Φ=2,f*=1,温度可继续下降即体系将落入只存在冰和盐两个固相共存的双相区。
若从上向下看E点的温度是代表冰和盐一起自溶液中析出的温度,可称为"共析点"。
反之,若由上往下看E点温度是代表冰和盐能够共同熔化的最低温度,可称为"最低共熔点"。
溶液E凝成的共晶机械混合物,称为"共晶体"或"简单低共熔物"。
不同的水盐体系,其低共熔物的总组成以及最低共熔点各不相同,表5-7列举几种常见的水盐体系的有关数据。
表5-7 某些盐和水的最低共熔点及其组成FE线和EM线的上方区域是均匀的液相区,因f *=3-Φ=3-1=2,故只有同时指定温度和盐溶液浓度两个变量才能确定一个物系点。
FQE是冰~盐溶液两相共存区。
MEIJ是盐与饱和盐溶液两相共存区。
在受制约的两相区内Φ=2,f*=1 ,只能有一个自由度,即液相的组成随温度而变。
而QABI为一不受制约的区域,温度及总组成可以任意变动。
但因各相组成(纯态)固定,故常选温度为独立变量,即仍f*=1 。
为确定两相区内某物系点的两相点,可通过该物系点作水平线(即结线)交于两端点,例如MEIJ区内的物系点g的两个相点就是y和z,y为浓度约 44% 的饱和盐溶液相,z为固相纯盐,两相质量比应遵守杠杆规则,即〔例5〕试计算 200 克含 (NH4)SO4 60% 的溶液冷至10℃ 时(图5-27中的x 点),各相中各组分的质量?〔解〕按图5-27可知根据杠杆规则:从中解出固相(NH4)2SO4质量为液相质量为:∴液相中(NH4)2SO4的质量:液相中水的质量为:2.相图的应用水~盐体系的相图可用于盐的分离和提纯,帮助人们有效地选择用结晶法分离提纯盐类的最佳工艺条件,视具体情况可采取降温、蒸发浓缩或加热等各种不同的方法。
例如,欲自80℃,20%(NH4)2SO4溶液中不能得到纯净的 (NH4)2SO4晶体应采取哪些操作步骤?此物系点即图5-27中的P点,显然,若单纯降温,则进入FQE冰~液两相区,得到 (NH4)2SO4晶体。
因为继续降温,冰不断析出,溶液的组成往FE线下滑,至E点(-18.3℃)出现三相共存。
此时体系的温度及溶液的组成均恒定不变,直至全部液相变为固相为止,最终得到的只能是冰和固体 (NH4)2SO4的混合物。
由此可见,当溶液的组成落在ME线左边时,用单纯降温的方法是分离不出纯粹的盐。
唯一可取的途径是先将此溶液蒸发浓缩,使物系点P沿水平方向移至c点,此时溶液中 (NH4)2SO4含量约达 50%,冷却此溶液到K点(约50℃),溶液已成饱和。
若再降低温度,无疑将析出 (NH4)2SO4固体,当温度降至g点(10℃),体系中则有组成为y的溶液和纯盐共存。
若降至 -18.3℃ 则整个体系又成三相共存状态,析不出纯盐。
故最佳方案是先行浓缩而后降温,但温度又不能降至冰~盐共析点,同时,也不必将温度降得太低,因为根据相图分析,10℃ 时体系中固相所占的百分率与0℃ 时所占的百分率相差无几,所以一般以冷却至 10~20℃ 为宜。
根据上述原则,就可以利用相图确定 (NH4)2SO4的纯化条件;如c点代表粗盐的热溶液组成,先滤去杂质,然后降温,由冷至50℃ 即K点时,便有纯 (NH4)2SO4晶体析出,继续降温,结晶不断增加,至10℃ 时,饱和液浓度相当于y点。
至此,可将晶体与母液分开,并将母液重新加热到H点,再溶入粗 (NH4)2SO4,适当补充些水分,物系点又自H移到C,然后又过滤、降温、结晶、分离、加热、溶入粗盐……如此使溶液的相点沿HCgyH路程循环多次,从而达到粗盐的提纯精制目的。
循环次数多少,视母液中杂质浓缩程度对结晶纯度的影响而定。
水~盐相图具有低共熔点特征,可用来创造科学实验上的低温条件。
例如,只要把冰和食盐(NaCl)混合,当有少许冰熔化成水,又有盐溶入,则三相共存,溶液的浓度将向最低共熔物的组成E逼近,同时体系自发地通过冰的熔化耗热而降低温度直至达到最低共熔点。
此后,只要冰和盐存在,且三相共存,则此体系就保持最低共熔点温度(-21.1℃)恒定不变。
(二)合金体系相图与"热分析"原理现以二组分合金体系为例说明相图的另一种实验方法"热分析"的原理。
对于象锑~铝,铋~镉等合金体系及两种化合物(如 KCl~AgCl,C6H6~CHBr3)体系,都可以组成形成低共熔物的固相互不相溶体系,以Sb~Pb体系为例,其相图如图5-28所示,ME、NE线分别为金属 Sb(即 A )和金属 Pb(即 B )熔体的凝固点曲线,由其斜率可知,各自的熔点都随着第二种组分的增加而降低。
由式(4-155):其中x指某组分的摩尔数,Δfus H m指纯组分时的溶解焓变,T f*指纯组分熔点,T f为某组分当其摩尔分数为x时的熔点。
图中E点是两条熔点曲线的交点,在此点上,固态 Sb 和 Pb 以及溶液三态共存,常称为金属 Sb 和 Pb 的"最低共熔点"。
最低共熔点温度为246℃,其质量分数为含 Pb88%,含 Sb12%,此溶液所析出之固体混合物称为"共熔合金"(普遍情况下称为"最低共熔物")。
显然,MQE为金属溶液和固体金属 Sb 的两相平衡区。
NEI为溶液和固体金属 Pb 的两相平衡区。
水平线QEI则为纯固体 Sb、纯固体 Pb 和组成E的熔液平衡共存的三相线,此线下面则是纯 Sb 和纯 Pb 的两相区。
此类相图能提供制备低熔点合金的方法;如在水银中加入铊(Tl),能使水银凝固点(-38.9℃)降低,但通过相图可明断最低只能降到 -59℃,若想进一步降低,则需采用更多组分的体系。
其他如保险丝,焊锡等低熔点合金均可参照这类相图的实验数据配制。
表5-8列出一些二组分简单最低共熔型相图体系中低共熔物的熔点与组成(摩尔分数)。
表5-8 某些简单低共熔型相图体系热分析法研究固液平衡体系相图主要是依据体系发生相变时伴随着相变潜热的吸收或放出,导致体系冷却速度的变化,来研究相变过程的规律。
由实验数据所绘制的温度(T)与时间(t)的曲线,称为“步冷曲线”,由步冷曲线斜率的变化可提供相的产生、消失、和达成相平衡的信息。
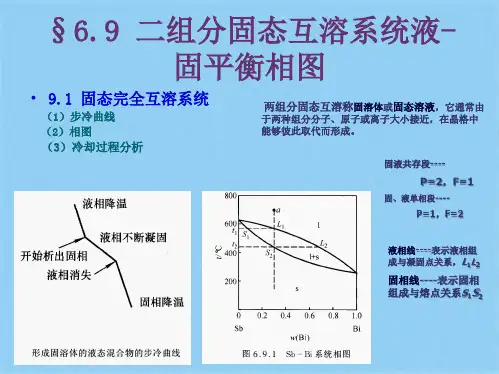
下面以Sb~Pb 合金体系为例,讨论绘制步冷曲线及由此确定相应的温度~组成图的方法。
首先配好一定组成的混合物,如含 Pb 量 0.0%、40%、60%、88%、95%、100%等六个样品,加热使其全部熔解,然后让其缓慢地自行冷却,分别记录每个样品温度随时间变化的数据作出如图5-29(a)的六条步冷曲线。
其中样品①是纯 Sb 属单组分。
其步冷曲线可分析如下:由恒压下凝聚体系相律表达式可得f *=C-Φ+2-1=1-Φ+1=2-Φ。
可见,温度若在凝固点以上,则Φ=1,f *=1,体系温度可变化而不影响其单相特征,若仅有降温可得出曲线上部的平滑段。
当降温至 Sb 的凝固点(631℃)将有固相析出,固液两相平衡存在Φ=2,f*=0 ,此时温度应维持不变,这就出现如曲线上所示的平台线段。
直到液体全部凝固,体系又变成单一固相,其自由度f *=1,温度可以变化,冷却过程可用曲线下部的平滑段表示。
同理,曲线⑥为 Pb 单组分步冷曲线,形状与曲线①类似,而差别在于其凝固点较低(327℃),出现平台段较迟。
曲线②为含 Pb40% 的二组分体系,C =2,由相律,高温时为熔融液相,温度和组成在一定范围内均可变化而不影响其单相特征。
当组成恒定时,温度仍可均匀下降,如曲线的上部平滑线。
当温度降至 H 点时,熔液中的金属 Sb 达饱和而析出固体 Sb,出现了固~液两相平衡,此时,温度仍可不断下降,而平衡液相含Pb量逐增浓度,另固体析出所放出凝固潜热,可部分抵偿环境吸走的热,于是冷却速度较前缓慢,出现斜率较小的中间平滑线Ha,步冷线上拐点(或转折点)H 的出现意味着新相的产生。