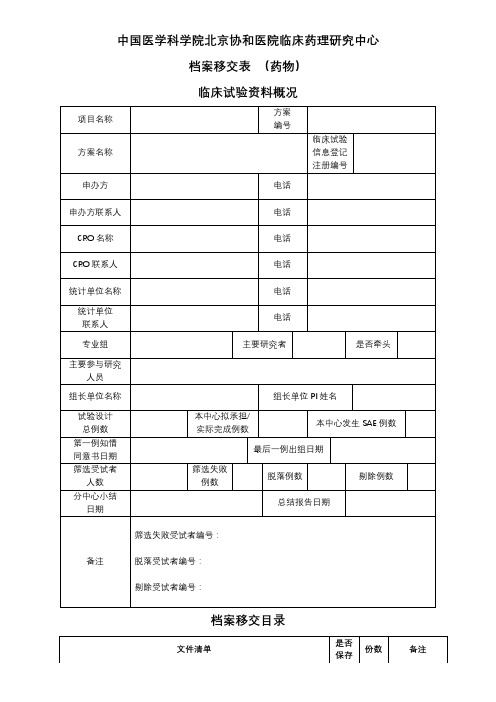
AA医学科学院AA协和医院临床药理研究中心档案移交表(药物)临床试验资料概况
- 格式:doc
- 大小:94.00 KB
- 文档页数:5


北京协和医院药物临床试验机构
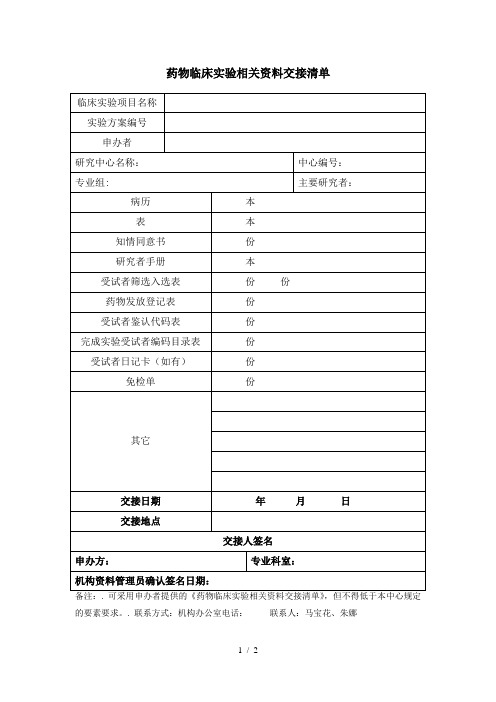
文件递交信
尊敬的北京协和医院药物临床试验机构:
在北京协和医院___________________专业组进行的药物/医疗器械临床试验,以下资料递交临床试验机构请审阅。
试验方案名称:
_____________________________________________________________
试验方案编号:
_____________________________________________________________
申办方:
_____________________________________________________________
本次递交的资料为:
1.________________________________________________________
2.________________________________________________________
主要研究者签字:_________________ 日期:年月日
北京协和医院药物临床试验机构文件递交回执
本临床试验机构已收到上述递交资料,我们将会:
□同意试验继续进行
暂停
终止临床试验
采取进一步措施___________________________________________________ 其他,说明
临床试验机构授权人:日期:。
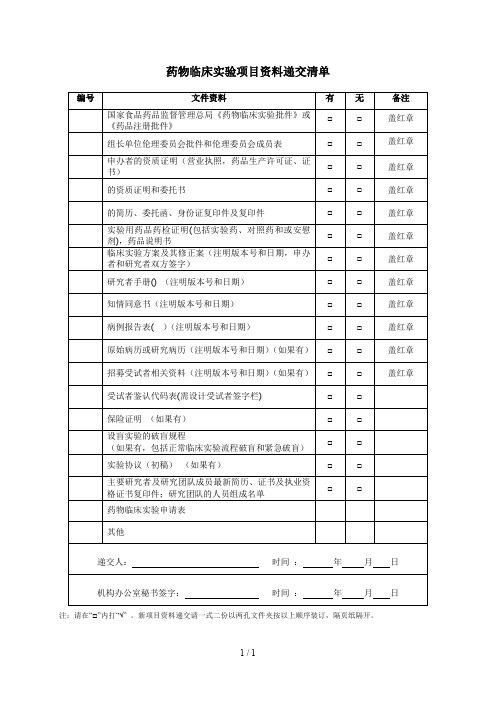

药物临床试验项目需要递交的资料目录附件2:药物临床试验申办方、统计单位、参加单位以及研究者信息表(国内项目国际多中心项目)(注:若为国际多中心项目,请先填写国际多中心的内容,国内项目可以不填)附件3:申办方前期提交机构办的备案资料封面模板试验药物名称:______________________________________药物临床试验批件号:________________________________药物临床试验方案号:________________________________我机构专业的中心号:________________________________(除项目名称用三号字居中之外,其余内容均用小四号字,1.5倍行距)项目名称(三号字,居中)青岛大学附属医院机构办备案资料手机号码:_______________________________电子邮箱:_______________________________传真;___________________________________所属部门和职务:_________________________详细通讯地址:___________________________邮政编码:_______________________________备案单位:_______________________________(加盖公章)备案单位性质:□申办方□CRO □其他________________备案时间:年月日项目名称xxxx药物临床试验资料目录资料目录请按照附件1中的目录排列,有版本号的必须注明版本号,制定日期,中心伦理通过时间.(该目录最终版本必须与相关资料顺序对起来)机构备案资料递交申请函青岛大学附属医院国家药物临床试验机构管理办公室:兹有青岛大学附属医院国家药物临床试验机构________专业申请参加一项____________________________________________________公司的多中心II期临床试验:_______________________________________________________我院为□组长单位(□参加单位),主要研究者为:__________。
北京协和医院临床药理研究中心北京协和医院临床药理研究中心(简称“中心”)成立于1995年,负责组织管理全院的药物临床试验,承担卫生部临床药理基地及后来国家食品药品监督管理总局(CFDA)药物临床试验机构的职能。
其行政上直属院长领导,业务上受CFDA指导和视察。
当时被批准为14类药物的专业组,1998年又被批准扩大为17类药物的专业组。
“中心”成立后次年即设立了独立的药物临床试验伦理委员会,审核所有的I 、II、III、IV期药物临床试验及医疗器械临床试验。
1999年经国家科技部、卫生部及CFDA联合验收通过,建成“国家新药(综合)临床试验研究中心”,简称国家GCP中心,是全国10个GCP中心中唯一的综合性药物临床试验中心,负责组织、协调及监督全院药物和医疗器械的临床试验。
2008年“机构”及17个老专业组被CFDA复核重新确认,8个专科被批准为国家药物临床试验机构的新增专业组。
2012年10月经过CFDA的资料审查和现场核查,25个老专业组顺利通过复核检查, 并有11个新申报专业组获得临床试验资格。
到目前为止,共有被批准的专业组36个,是国内专业组数量最多的机构之一。
中心”成立近20年来,各届院领导班子对药物临床试验工作及“中心”的发展给予了高度重视,不断加大投资,改善硬件条件,目前“中心”占地面积已达到2469m2,是国内规模最大的药物临床试验机构之一。
“中心”成立以来逐渐建立和完善了各项管理制度及各类标准操作规程(SOP),严格执行国家各项政策和规定,不断提高临床试验数量及质量。
“中心”秉承“方法科学、操作规范、管理完善、服务优质”的精神,不断改善研究条件、加强研究能力、提高研究水平,成为国内一流的临床药理研究机构。
为我国临床药物研究做出了巨大的贡献。
临床药理研究中心管辖25类药物专业组及I期临床试验研究室。
平均每年新接受临床试验项目百余项,试验质量获各国内外制药企业和国家权威机构的好评。
1.负责国家食品药品监督管理局(SFDA)药物临床试验机构和国家科技部国家新药(综合)临床试验研究中心的管理工作。