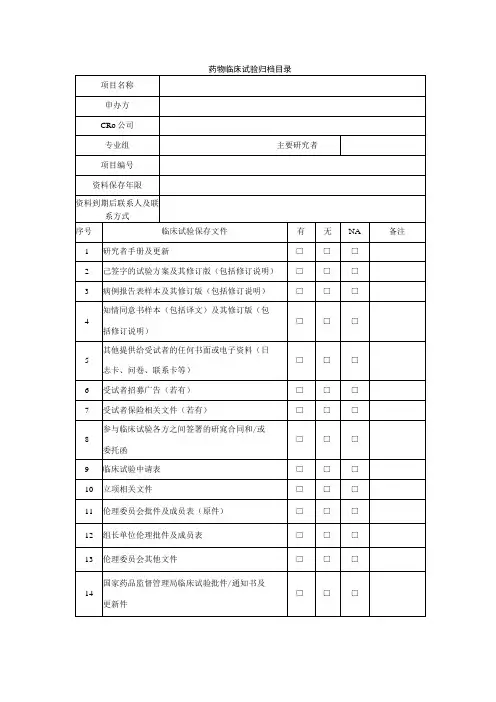
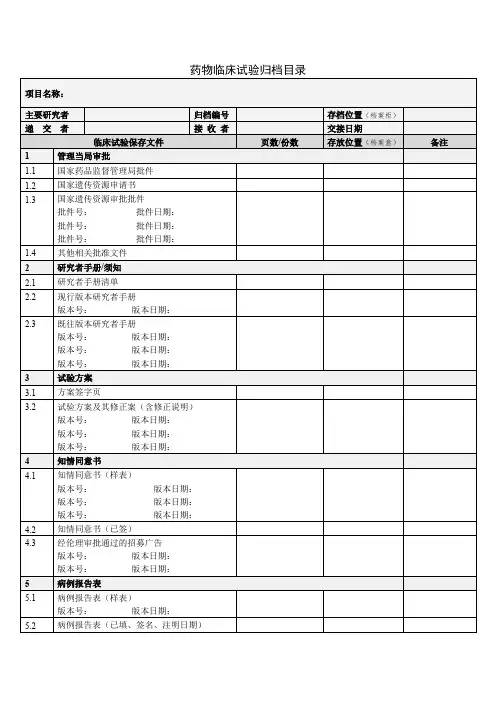
药物临床试验资料归档清单
- 格式:doc
- 大小:102.50 KB
- 文档页数:5

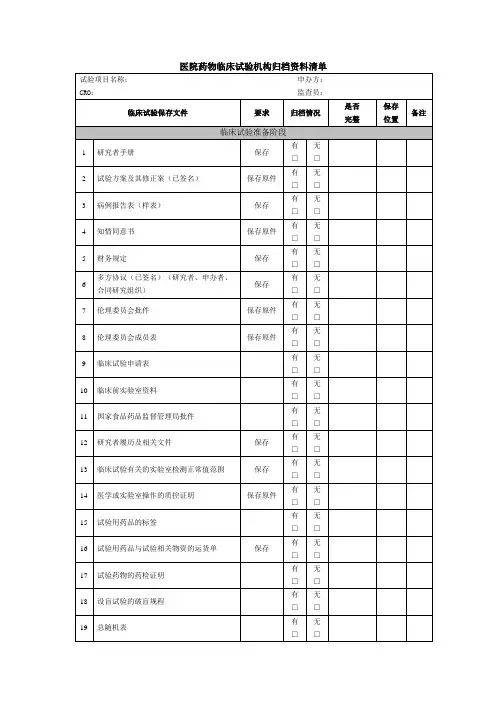
医院药物临床试验机构归档资料清单
科室质控员签名:日期:
主要研究者签名:日期:
资料递交人签名:日期:
机构办公室人员签名:日期:
资料保存到期联系人及联系方式:
归档要求
1. 所有文件请用黑色A4打孔两孔文件夹,厚薄根据递交内容选择
2. 每个文件夹侧面标签格式为:机构编码:留空方便机构填写;项目名称;类别;申办方;CRO;PI;研究时间;归档时间。
3. 不同项用隔页纸隔开归档
4. 项目归档每个文件夹需有中文目录
5. 以上“保存位置”需说明保存在第几个归档文件夹第几个目录下
6. 需在多项保存的文档,仅在一项保存,其他项告知在哪项保存即可
7. 研究者手册、试验方案、知情同意书、病例报告表有多个版本的必须罗列清单,内容包括版本,版本日期,被批准使用日期。
8. 本院发生的SAE请归档时,罗列清单(见SAE附表)
9. 对于缺项的内容,请予以说明缺失原因
10. 请确保内容齐全,再递交至机构(根据本院机构的归档资料清单表,先自检有无每项相关资料,并在备注项注明在哪个文件夹中)
11. 请确保所有CRF中,研究者均签署姓名及日期
12.根据合同要求,所有款项已付清,请研究者审核实际发生费用,并签字确认无误
13.所有问题都在关闭中心访视期间解决
14.项目归档前,请各级质控员完成质量控制工作,最后需科室质控员签字确保所归档资料完整,已完成科室质量控制工作;由主要研究者签名确保试验归档资料完整、数据真实可靠。

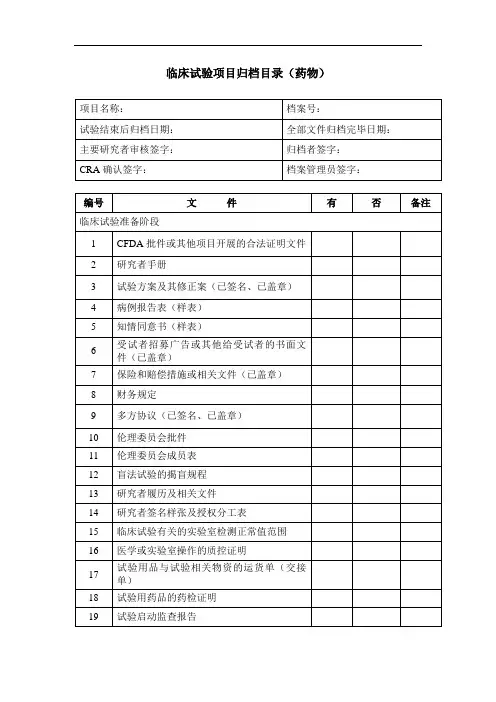
药物临床试验提供资料目录
1.临床试验申请表(需相关人员签名)
2.国家药品监督管理局批件/临床试验通知书
3.试验方案及修正案(申办方盖章+主要研究者签名)
4.知情同意书(样表)
5.其他提供给受试者的书面资料
6.病例报告表(样表)
7.研究者手册
8.招募受试者和向其宣传的程序性文件
9.受试者保险的相关文件(若有)
10.试验用药品的检验报告(试验药物和对照药品,按批次加盖申办者红
章)
11.试验用药品的包装盒标签样本
12.试验用药品管理相关表单(关注机构网页:试验用药物Sc)P)
13.申办者资质证明(三证、CRo公司营业执照,复印件加盖红章)
14.委托书(如临床试验委托书、申办者对CRO的委托书)
15.研究者履历及相关文件(包括:简历、资质证书、GCP证书)
16.样表:受试者鉴认代码表、受试者筛选入选表等
17.遵守《中华人民共和国人类遗传资源管理条例》的承诺书(P1签名)
18.其他相关文件。


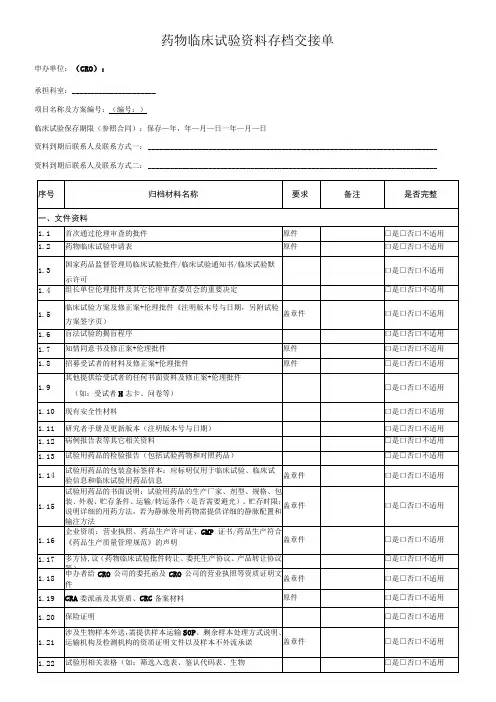
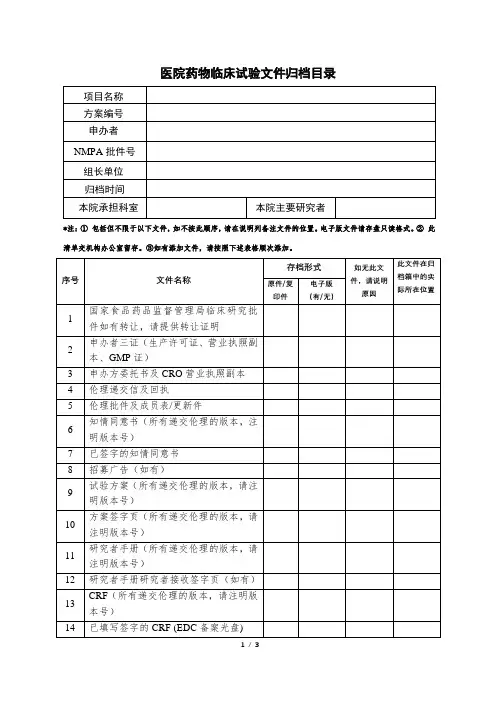
药物临床试验资料存档交接单邵逸夫医院药物临床试验资料存档交接单申办单位:(CRO):研究单位(科室):项目名称及方案编号:临床试验保存期限:保存年,年月日—年月日项目负责人/资料保存到期联系人(及其联系方式):临床试验保存文件研究者有√无X1 国家食品药品监督管理局批件2 伦理委员会批件保存原件3 伦理委员会成员表保存原件4 临床试验申请表(申办方确认研究单位和项目负责人并签名)5 研究者手册(包括临床前实验室资料)及更新件保存6 试验方案及其修正案(已签名)保存原件7 病例报告表(样表)及更新件保存8 知情同意书(样本)及更新件保存原件9 多方协议包括财务规定(已签名)保存原件10 研究者、新研究者履历及相关文件保存原件11 启动会(研究者签名样章,分工表等)保存原件12 医学或实验室操作的质控证明,有关的实验室检测正常值范围保存13 试验用药物的标签14 试验相关物资的运货单保存15 试验药物的药检证明16 设盲试验的破盲规程17 总随机表18 已签名的知情同意书保存原件19 原始医疗文件保存原件临床试验保存文件研究者有√无X20 病例报告表(已填写,签名,注明日期)纸质/电子版保存副本21 研究者致申办者的严重不良事件报告保存原件22 申办者致药品监督管理局、伦理委员会的严重不良事件报告保存23 中期或年度报告保存24 受试者鉴认代码表保存原件25 受试者筛选表与入选表保存原件26 受试者试验用药品登记表保存原件27 试验用药物接收、入库、申办方回收和或销毁证明保存28 完成试验受试者编码目录保存29 稽查证明件30 监查员访视记录、访视报告、最终总监查报告31 治疗分配与破盲证明32 试验完成报告(致伦理委员会国家食品药品监督管理局)33 总结报告保存34 其他监查员:负责项目协调研究者签名:联系方式:临床试验机构办公室签名:档案室接收员签名:档案移交日期:年月日。
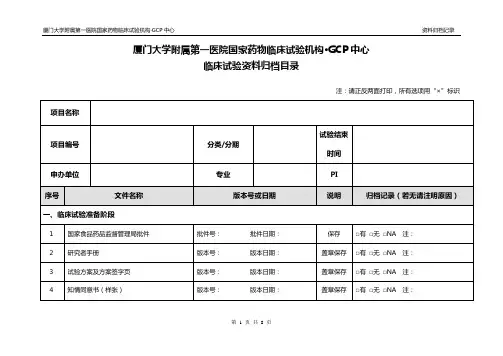
药物临床试验提供资料目录
1.临床试验申请表(需相关人员签名)
2.国家药品监督管理局批件/临床试验通知书
3.试验方案及修正案(申办方盖章+主要研究者签名)
4.知情同意书(样表)
5.其他提供给受试者的书面资料
6.病例报告表(样表)
7.研究者手册
8.招募受试者和向其宣传的程序性文件
9.受试者保险的相关文件(若有)
10.试验用药品的检验报告(试验药物和对照药品,按批次加盖
申办者红章)
11.试验用药品的包装盒标签样本
12.试验用药品管理相关表单(关注机构网页:试验用药物SOP)
13.申办者资质证明(三证、CRO公司营业执照,复印件加盖红
章)
14.委托书(如临床试验委托书、申办者对CRO的委托书)
15.研究者履历及相关文件(包括:简历、资质证书、GCP证书)
16.样表:受试者鉴认代码表、受试者筛选入选表等
17.遵守《中华人民共和国人类遗传资源管理条例》的承诺书(PI
签名)
18.其他相关文件。