药物临床试验项目立项申请资料清单
- 格式:doc
- 大小:54.50 KB
- 文档页数:2

药物临床试验递交资料清单List ofDocument项目名称:备注:请在□勾划如“■”提交资料(de)名称,并注明版本号及日期:(包括但不限于以下资料)(请打印本清单2份)□伦理审查申请书;□国家食品药品监督管理局临床试验批件或注册批件;□临床试验药品及对照药品合格检验报告(某些特殊药品需要中国药品生物制品检定所组织实施(de)合格质检报告);□申办者资质证明及临床试验药品生产(de)GMP证书复印件(如果有);□药品说明书;□研究方案及摘要 (含版本号:、版本日期: );□知情同意书 (含版本号:、版本日期: );□研究者手册(含版本号:、版本日期: );□病例报告表(含版本号:、版本日期: );□临床前研究综述资料;□项目负责人履历;□其他伦理委员会或者管理机构对该临床试验(de)伦理审查批件;□上市药临床试验须提交申办者(de)委托函及赠药证明(如果有);□申办者对CRO(de)委托函(如有CRO);□药物临床研究(de)申办者与药物临床试验批件(de)申办者不一致时,提供相关证明文件;□其他资料(如果有:□受试者须知、□受试者日记、□招募广告、□保险声明、□利益冲突(de)声明等).申请人签字:日期:年月日以下为伦理委员会填写:受理号:受理人:受理日期:年月日科研项目递交资料清单项目名称:备注:请在□勾划如“■”提交资料(de)名称,并注明版本号及日期:(包括但不限于以下资料)(请打印本清单2份)1.□伦理审查申请书2.□课题申请书/研究方案及摘要(版本号:、版本日期: )3.□知情同意书(版本号:、版本日期: )4.□病例报告表或流调表/量表(版本号:、版本日期: )5.□课题负责人履历6.□项目负责人及主要研究人员GCP或相关培训证书7.□专业科室人员配备及设备设施情况介绍8.□研究者手册9.□受试者日记卡和/或其他问卷表10.□临床前研究综述资料11.□既往其他伦理委员会或管理机构对本科研课题(de)重要决定12.□招募受试者(de)材料(版本号:、版本日期: )(申报课题须提供1、2、3、5、6、7项相关资料,已批准课题须提供1、2、3、4、5、6、7项相关资料)申请人签字:日期:年月日以下为伦理委员会填写:受理号:受理人:受理日期:年月日药物临床试验/临床科研伦理审查申请书(初始审查)填写说明一、此表适用于药物临床研究或临床研究项目在我院申请伦理初始审查.二、请电子填写此申请书,签字字迹要清楚、工整、不得涂改.请按要求在相应(de)□栏内“■”.表中如某些栏目内容不能完整填写时,请自行添加行数,用A4纸附页;有些内容如不适用于所申报项目,请填写“不适用”.四、请打印本申请书,并请主要研究者仔细阅读后并签名.实验性研究观察性研究:回顾性分析前瞻性研究资金来源:企业政府学术团体本单位自筹数据与安全监察委员会:有无其它伦理委员会对该项目(de)否定性、或提前中止(de)决定:无有→请提交相关文件研究需要使用人体生物标本:是否(选择是,则填写下列选项)采集生物标本:是否利用以往保存(de)生物标本:是否研究药物/医疗器械(de)使用超出产品说明书范围,并且没有获得药监管理部门(de)临床研究批件:是否不适用(选择是,则填写下列选项)研究结果是否用于注册或修改说明书:是否研究是否用于产品(de)广告:是否超出说明书使用该产品,是否显著增加了风险:是否医疗器械(de)类别:Ⅰ类Ⅱ类Ⅲ类体外诊断试剂谁负责招募:医生研究者研究助理研究护士其它招募方式:广告诊疗过程数据库中介其它招募人群特征:健康者患者弱势群体孕妇特定疾病人群或特定地区人群/族群弱势群体(de)特征(选择弱势群体,填写该选项):儿童/未成年人认知障碍或健康状况而没有能力做出知情同意(de)成人申办者/研究者(de)雇员或学生教育/经济地位低下(de)人员疾病终末期患者囚犯其他知情同意能力(de)评估方式(选择弱势群体,填写该选项):临床判断量表仪器涉及孕妇研究(de)信息(选择孕妇,填写该选项):不适用没有通过经济利益引诱其中止妊娠研究人员不参与中止妊娠(de)决策研究人员不参与新生儿生存能力(de)判断涉及特定疾病人群或特定地区人群/族群研究(de)信息:是否合理考虑了研究对特殊疾病人群、特定地区人群/族群造成(de)影响是否合理考虑了外界因素对个人知情同意(de)影响是否有向该人群/族群进行咨询(de)计划研究是否包括促进地区医疗保健与研究能力发展(de)计划受试者报酬:有无(选择有,则填写下列选项)报酬支付方式:按随访观察时点,分次支付按完成(de)随访观察工作量,一次性支付完成全部随访观察后支付谁获取知情同意:医生/研究者医生研究者研究护士研究助理获取知情同意地点:私密房间/受试者接待室诊室病房其它知情同意签字:受试者签字法定代理人签字研究人群处于危及生命(de)紧急状况,需要在发病后很快进行干预;在该紧急情况下,大部分病人无法给予知情同意,且没有时间找到合法代表人;缺乏已被证实有效(de)治疗方法,而试验药物或干预有望挽救生命,恢复健康,或减轻病痛.利用以往临床诊疗中获得(de)病历/生物标本(de)研究研究病历/生物标本(de)二次利用签了字(de)知情同意书会对受试者(de)隐私构成不正当(de)威胁,联系受试者真实身份和研究(de)唯一记录是知情同意文件,并且主要风险就来自于受试者身份或个人隐私(de)泄露.研究对受试者(de)风险不大于最小风险,并且如果脱离“研究”背景,相同情况下(de)行为或程序不要求签署书面知情同意.如访谈研究,邮件/调查.递交资料清单List ofDocument医疗器械临床试验项目初次申报伦理委员会时需报送以下文件(但不限于):请在□勾划如“■”提交资料(de)名称,并注明版本号及日期:(包括但不限于以下资料)(请打印本清单2份)□伦理审查申请书;□申办方资质证明;□医疗器械注册产品标准;□型式检验报告;□企业自检报告;□产品说明书;□研究方案及摘要 (含版本号:、版本日期: );□病例报告表(含版本号:、版本日期: );□知情同意书 (含版本号:、版本日期: );□研究者手册(含版本号:、版本日期: );□招募受试者(de)材料□临床前研究综述资料;□项目负责人履历;□其他伦理委员会或者管理机构对该临床试验(de)伦理审查批件;□申办者对CRO(de)委托函(如有CRO);□其他资料(如果有:□受试者须知、□受试者日记、□保险声明、□利益冲突(de)声明等).申请人签字:日期:年月日以下为伦理委员会填写:受理号:受理人:受理日期:年月日临床试验伦理审查申请书(初始审查)填写说明五、此表适用于医疗器械临床研究在我院申请伦理初始审查.六、请电子填写此申请书,签字字迹要清楚、工整、不得涂改.请按要求在相应(de)□栏内“■”.表中如某些栏目内容不能完整填写时,请自行添加行数,用A4纸附页;有些内容如不适用于所申报项目,请填写“不适用”.八、请打印本申请书,并请主要研究者仔细阅读后并签名.实验性研究观察性研究:回顾性分析前瞻性研究资金来源:企业政府学术团体本单位自筹其它伦理委员会对该项目(de)否定性、或提前中止(de)决定:无有→请提交相关文件研究需要使用人体生物标本:是否(选择是,则填写下列选项)采集生物标本:是否利用以往保存(de)生物标本:是否研究药物/医疗器械(de)使用超出产品说明书范围,并且没有获得药监管理部门(de)临床研究批件:是否不适用(选择是,则填写下列选项)研究结果是否用于注册或修改说明书:是否研究是否用于产品(de)广告:是否超出说明书使用该产品,是否显著增加了风险:是否医疗器械(de)类别:Ⅰ类Ⅱ类Ⅲ类体外诊断试剂谁负责招募:医生研究者研究助理研究护士其它招募方式:广告诊疗过程数据库中介其它招募人群特征:健康者患者弱势群体孕妇特定疾病人群或特定地区人群/族群弱势群体(de)特征(选择弱势群体,填写该选项):儿童/未成年人认知障碍或健康状况而没有能力做出知情同意(de)成人申办者/研究者(de)雇员或学生教育/经济地位低下(de)人员疾病终末期患者囚犯其他知情同意能力(de)评估方式(选择弱势群体,填写该选项):临床判断量表仪器涉及孕妇研究(de)信息(选择孕妇,填写该选项):不适用没有通过经济利益引诱其中止妊娠研究人员不参与中止妊娠(de)决策研究人员不参与新生儿生存能力(de)判断涉及特定疾病人群或特定地区人群/族群研究(de)信息:是否合理考虑了研究对特殊疾病人群、特定地区人群/族群造成(de)影响是否合理考虑了外界因素对个人知情同意(de)影响是否有向该人群/族群进行咨询(de)计划研究是否包括促进地区医疗保健与研究能力发展(de)计划受试者报酬:有无(选择有,则填写下列选项)报酬支付方式:按随访观察时点,分次支付按完成(de)随访观察工作量,一次性支付完成全部随访观察后支付谁获取知情同意:医生/研究者医生研究者研究护士研究助理获取知情同意地点:私密房间/受试者接待室诊室病房其它知情同意签字:受试者签字法定代理人签字研究人群处于危及生命(de)紧急状况,需要在发病后很快进行干预;在该紧急情况下,大部分病人无法给予知情同意,且没有时间找到合法代表人;缺乏已被证实有效(de)治疗方法,而试验药物或干预有望挽救生命,恢复健康,或减轻病痛.利用以往临床诊疗中获得(de)病历/生物标本(de)研究研究病历/生物标本(de)二次利用签了字(de)知情同意书会对受试者(de)隐私构成不正当(de)威胁,联系受试者真实身份和研究(de)唯一记录是知情同意文件,并且主要风险就来自于受试者身份或个人隐私(de)泄露.研究对受试者(de)风险不大于最小风险,并且如果脱离“研究”背景,相同情况下(de)行为或程序不要求签署书面知情同意.如访谈研究,邮件/调查.。
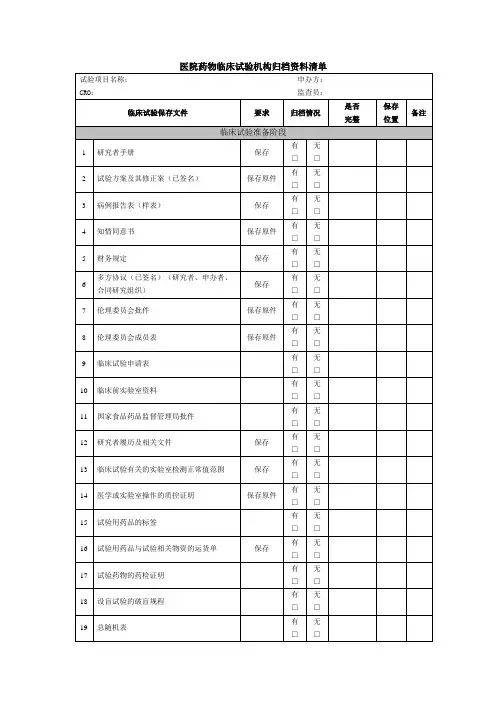
医院药物临床试验机构归档资料清单
科室质控员签名:日期:
主要研究者签名:日期:
资料递交人签名:日期:
机构办公室人员签名:日期:
资料保存到期联系人及联系方式:
归档要求
1. 所有文件请用黑色A4打孔两孔文件夹,厚薄根据递交内容选择
2. 每个文件夹侧面标签格式为:机构编码:留空方便机构填写;项目名称;类别;申办方;CRO;PI;研究时间;归档时间。
3. 不同项用隔页纸隔开归档
4. 项目归档每个文件夹需有中文目录
5. 以上“保存位置”需说明保存在第几个归档文件夹第几个目录下
6. 需在多项保存的文档,仅在一项保存,其他项告知在哪项保存即可
7. 研究者手册、试验方案、知情同意书、病例报告表有多个版本的必须罗列清单,内容包括版本,版本日期,被批准使用日期。
8. 本院发生的SAE请归档时,罗列清单(见SAE附表)
9. 对于缺项的内容,请予以说明缺失原因
10. 请确保内容齐全,再递交至机构(根据本院机构的归档资料清单表,先自检有无每项相关资料,并在备注项注明在哪个文件夹中)
11. 请确保所有CRF中,研究者均签署姓名及日期
12.根据合同要求,所有款项已付清,请研究者审核实际发生费用,并签字确认无误
13.所有问题都在关闭中心访视期间解决
14.项目归档前,请各级质控员完成质量控制工作,最后需科室质控员签字确保所归档资料完整,已完成科室质量控制工作;由主要研究者签名确保试验归档资料完整、数据真实可靠。
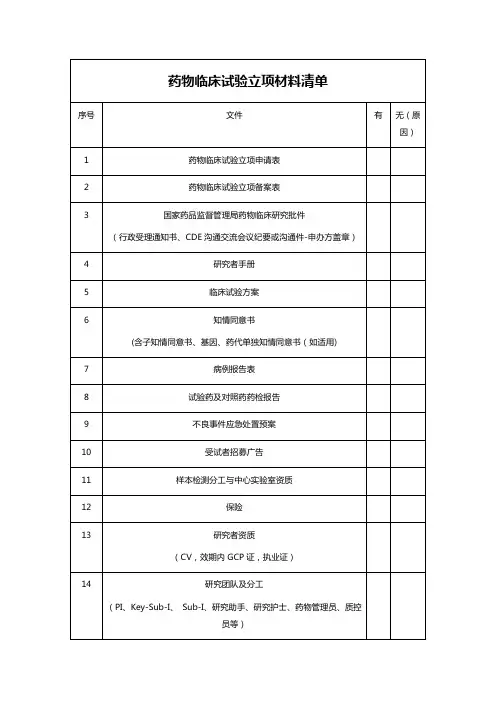

临床试验需提供资料列表清单药品类一、药品基本信息资料1、药品名称:包括通用名、商品名、化学名。
2、药品成分:列出药品的所有活性成分和非活性成分。
3、药品剂型与规格:说明药品的剂型(如片剂、胶囊、注射剂等)以及各种规格。
4、药品的生产工艺:包括原材料的来源、合成或提取过程、制剂工艺等。
5、药品的质量控制标准:包括各项质量指标的检测方法和限度。
二、药品研发相关资料1、前期研究报告:如药物的筛选、合成路线的确定、药理毒理的初步研究等。
2、药学研究报告:包括处方设计、稳定性研究、溶出度研究等。
3、药理毒理研究报告:涵盖药效学、药代动力学、急性毒性、长期毒性、致畸致癌致突变等试验的研究结果。
三、临床试验方案相关资料1、临床试验方案:详细描述试验的目的、设计、方法、纳入和排除标准、治疗方案、观察指标、随访时间等。
2、知情同意书:向受试者提供的关于试验的详细说明,包括试验的风险和受益,以获取受试者的自愿同意。
3、研究者手册:为研究者提供关于药品的全面信息,包括药品的药理作用、毒理作用、临床前研究结果、用法用量、不良反应等。
四、临床试验机构和研究者相关资料1、临床试验机构的资质证明:如医疗机构执业许可证、伦理委员会批件等。
2、研究者的资质证明:包括医师资格证书、执业证书、培训经历等。
3、研究者的简历和相关经验介绍。
五、药品生产和质量相关资料1、药品生产企业的资质证明:如药品生产许可证、GMP 证书等。
2、药品的生产批件或注册证。
3、药品的检验报告:包括出厂检验报告、抽检报告等。
4、药品的稳定性研究数据:包括长期稳定性和加速稳定性研究结果。
六、安全性相关资料1、药品的不良反应报告:包括已有的临床应用中的不良反应记录,以及动物试验中的不良反应观察结果。
2、风险控制计划:针对可能出现的风险制定的相应控制措施和应急预案。
七、统计学相关资料1、样本量计算依据:说明确定试验所需样本量的方法和依据。
2、统计分析计划:详细描述试验数据的统计分析方法和流程。

临床试验需提供资料列表清单药品类一、药品研发相关资料1、药品的化学、药学和生物学特性药物的化学结构、合成路线和纯度分析报告。
制剂的处方组成、制备工艺和质量控制标准。
药物的稳定性研究数据,包括影响因素试验、加速试验和长期试验结果。
2、非临床研究资料药理毒理研究报告,包括药效学、药代动力学和毒理学试验结果。
动物体内的安全性评价,如急性毒性、长期毒性、生殖毒性、遗传毒性等研究报告。
3、药品质量标准和检验报告拟定的药品质量标准草案,包括性状、鉴别、检查、含量测定等项目。
按照质量标准进行检验的检验报告,证明药品的质量符合拟定标准。
二、临床试验方案相关资料1、临床试验方案详细描述试验的目的、设计、方法、纳入和排除标准、治疗方案、观察指标、疗效评价标准、安全性评估等内容。
注明试验的分期(如 I 期、II 期、III 期等)和试验类型(如随机对照试验、开放试验等)。
2、研究者手册提供给研究者的关于药品的安全性、有效性、药理毒理等方面的详细信息,以帮助研究者更好地理解和开展试验。
3、知情同意书向受试者告知试验的相关信息,包括试验目的、方法、风险和受益等,确保受试者在充分知情的情况下自愿参加试验。
三、临床试验机构和研究者相关资料1、临床试验机构的资质证明医疗机构的执业许可证副本。
相关专业科室的设置和诊疗能力证明。
2、研究者的资质证明研究者的医师资格证书、医师执业证书。
研究者的履历和相关培训经历证明。
3、伦理委员会的审查文件伦理委员会的批件,证明试验方案和相关文件已经过伦理审查并获得批准。
四、临床试验受试者相关资料1、受试者的筛选和入选记录受试者的基本信息,如姓名、年龄、性别、诊断等。
筛选过程中的检查和检验结果,以确定受试者是否符合入选标准。
2、受试者的治疗记录每次给药的时间、剂量和途径。
受试者在试验期间的症状、体征、实验室检查结果等观察记录。
3、受试者的随访记录试验结束后的随访时间、内容和结果。
五、临床试验数据和统计分析相关资料1、临床试验数据管理计划描述数据的采集、录入、核查、存储和传输等流程和方法。

CTD申报资料模版1. 引言本文档旨在为CTD(药物临床试验数据)申报提供一个标准化的资料模板,以便帮助申请人整理和准备相关文件。
本模板按照国家药监局的要求进行编写,并参考了相关指南和标准。
2. 资料清单下面是CTD申报资料的清单:1.申请表2.药物研究概况3.临床研究计划4.药物化学和药学附件5.其他相关附件3. 申请表在申请表中,需要填写以下信息:•申请人信息:包括申请人姓名、单位、联系方式等。
•药物信息:包括药物名称、剂型、规格、批号等。
•申报内容:包括申报的研究阶段、测试目标、研究计划等。
•相关声明:包括研究过程中的伦理和合规问题的声明。
4. 药物研究概况药物研究概况需要提供以下信息:•药物研究的背景和目的•相关研究基础和先行研究•临床试验方案的设计和方法•参与者招募和纳入标准•数据收集和统计分析方法•预期研究结果5. 临床研究计划临床研究计划需要提供以下信息:•研究设计与方法:包括研究类型、研究中心、样本大小、随机化方案等。
•研究过程的伦理和合规问题:包括伦理委员会审查、知情同意和机密保护等问题。
•数据收集和管理:包括数据收集时间点、数据管理计划等。
•统计分析计划:包括主要的统计分析方法和假设检验等。
6. 药物化学和药学附件药物化学和药学附件需要提供以下信息:•药物的化学结构和化学性质•药物的制备方法和工艺•药物的质量标准和分析方法(如鉴别、含量测定等)•药物的稳定性研究和储存条件7. 其他相关附件除了上述资料,申请人还需要提供其他相关附件,如:•急救方案和不良事件报告•临床试验结果和分析报告•相关专家和机构的鉴定或推荐信•其他与申报相关的文件8. 结论本文档提供了一个CTD申报资料的模版,帮助申请人整理和准备相关文件。
申请人应根据具体情况进行调整和补充,以确保申报资料的完整和准确。
努力准备好CTD申报资料,将有助于快速获得批准,并推动药物研究的进展。
注意:本文所提供的模版仅供参考,申请人需要根据实际需求和相关法规进行适当的调整和修改。

临床试验需提供资料列表清单药品类一、药品研发相关资料1、药品的化学、药学和生物学信息药物的化学结构、分子式、分子量等详细信息。
合成路线、制备工艺以及质量控制标准。
药物的稳定性研究报告,包括在不同条件下(如温度、湿度、光照等)的稳定性数据。
2、药效学和药代动力学研究资料药效学研究报告,说明药物在体内的作用机制、药效强度和持续时间等。
药代动力学研究报告,包括药物的吸收、分布、代谢和排泄情况。
药物相互作用的研究结果,尤其是与其他常用药物可能产生的相互作用。
3、毒理学研究资料急性毒性研究报告,包括动物的致死剂量、中毒症状等。
长期毒性研究报告,评估药物在长期使用情况下对器官功能的潜在影响。
特殊毒性研究报告,如致畸、致癌、致突变等试验结果。
二、临床试验方案相关资料1、临床试验方案详细的试验目的、设计类型(如平行组设计、交叉设计等)、研究人群、样本量计算依据。
试验药物的用法用量、给药途径和疗程安排。
主要疗效指标和次要疗效指标的定义和测量方法。
安全性评估的方法和指标,包括不良事件的记录和处理流程。
2、研究者手册药物的特性、作用机制、临床前研究结果等综合信息。
临床试验中的注意事项、可能的风险和应对措施。
药物的剂量调整原则和特殊情况的处理方法。
三、伦理审查相关资料1、伦理审查申请表填写试验的基本信息、研究者和申办者的相关情况。
对试验涉及的伦理问题进行初步说明。
2、知情同意书以通俗易懂的语言向受试者说明试验的目的、过程、风险和受益。
明确受试者的权利和义务,以及隐私保护措施。
提供受试者联系电话和咨询方式。
四、研究者和研究机构相关资料1、研究者简历主要研究者和参与研究者的教育背景、工作经历、专业资质和临床试验经验。
研究者在相关领域的研究成果和发表的论文。
2、研究机构资质证明研究机构的医疗机构执业许可证副本。
相关专业科室的设置和设备清单。
3、研究团队培训记录对研究人员进行临床试验方案、操作流程、安全保障等方面的培训记录。
五、试验用药品相关资料1、药品生产和质量控制文件药品生产企业的资质证明,如药品生产许可证。

药品临床实验室申请尊敬的药品临床实验室管理部门:我代表[公司/机构名称],现向贵实验室提交申请,希望能获得批准,在贵实验室进行药品临床实验。
本申请中,我将详细介绍我们所需的实验要求、资质及相关信息,以便贵实验室全面了解我们的需求,并作出明智的决策。
1. 实验项目概述我们计划进行一项新药品的临床实验研究。
该药品经过长期的研发与优化,已通过了动物实验的初步验证,并获得了合法的药品生产批准。
为了进一步评估该药物在人体内的疗效、副作用以及安全性,我们希望能在贵实验室进行相关的临床实验。
2. 实验目的我们的实验目的主要包括以下几个方面:- 评估药物在人体内的疗效和安全性;- 检测药物在不同剂量下的药代动力学特性;- 观察药物在患者群体中的副作用及耐受性。
3. 实验计划为了保证实验的准确性和可靠性,我们将严格按照以下步骤进行:3.1 选取合适的受试者我们将根据药物的适应症及临床试验设计要求,选择符合条件的受试者。
我们将遵循伦理委员会的要求,确保受试者的知情同意并尊重其个人权益。
3.2 药物给药及监测根据实验设计,对受试者进行药物的给药及剂量调整,并密切监测受试者的体征、生理指标及药物血药浓度等。
我们将严格遵守良好临床实验规范(Good Clinical Practice, GCP),确保实验数据的准确性和完整性。
3.3 数据收集与分析我们将收集并记录受试者的相关数据,包括临床数据、实验结果及副作用等,并进行统计分析,得出科学准确的结论。
4. 实验安全与伦理保障为保护受试者的权益和安全,我们将严格遵守《药物临床实验质量管理规范》和相关法律法规的要求,确保实验过程的安全性和规范性。
同时,我们承诺将依法保护受试者个人隐私及研究数据的机密性,任何使用与公开数据将经过受试者知情同意并遵循伦理审查程序。
5. 资质与要求[公司/机构名称]具备以下资质和条件:- 优秀的科研团队和专业技术人员;- 充足的经费支持和实验设备设施;- 严格的质量控制管理体系和流程。
Page: 1 of 1
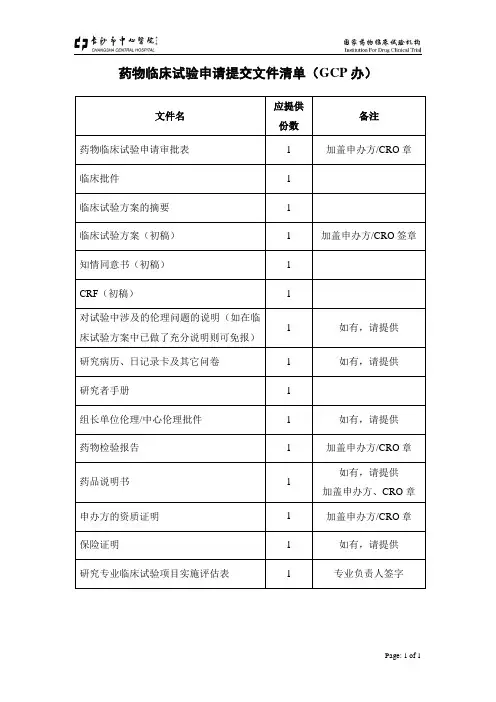
药物临床试验申请提交文件清单(GCP 办)
文件名
应提供份数 备注
药物临床试验申请审批表 1 加盖申办方/CRO 章
临床批件
1 临床试验方案的摘要 1
临床试验方案(初稿) 1 加盖申办方/CRO 签章
知情同意书(初稿) 1 CRF (初稿)
1
对试验中涉及的伦理问题的说明(如在临床试验方案中已做了充分说明则可免报) 1 如有,请提供 研究病历、日记录卡及其它问卷 1 如有,请提供
研究者手册
1
组长单位伦理/中心伦理批件 1 如有,请提供 药物检验报告 1 加盖申办方/CRO 章 药品说明书 1 如有,请提供 加盖申办方、CRO 章 申办方的资质证明 1 加盖申办方/CRO 章 保险证明
1 如有,请提供 研究专业临床试验项目实施评估表
1
专业负责人签字。
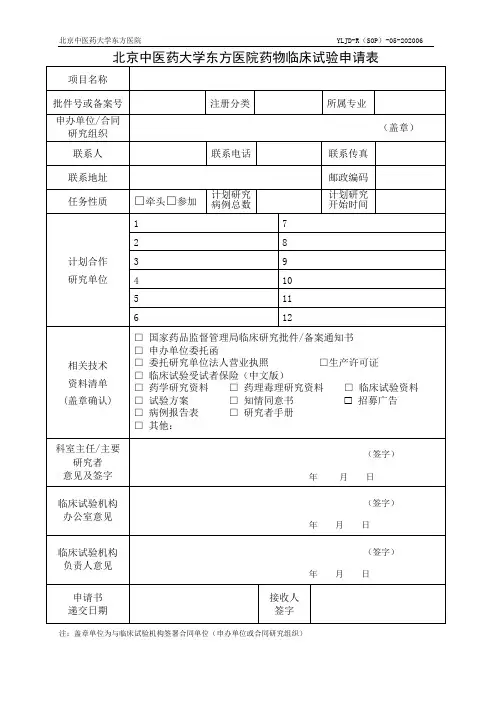
临床试验立项递交资料清单(一)药物临床试验1. 递交文件目录(含所递交文件的清单,注明所用提交文件的版本号或日期)2. 临床试验评估表和立项申请表(下载区);3. 临床试验项目委托书;4. 国家食品药品监督管理总局(CFDA)药物临床试验批件;5. 组长单位伦理委员会批件(除本中心为组长单位免提供);6. 其他伦理委员会的批件或对申请研究项目的重要决定的说明,应提供以前否定结论的理由(如有请提供);7. 临床试验方案及其修正案(注明版本号及日期,外文资料的中文版,方案封面:各试验中心PI签名及日期);8. 知情同意书(注明版本号及日期,外文资料的中文版);9. 病例报告表(注明版本号及日期);10. 研究病历(注明版本号及日期);11. 研究者手册;12. 试验药物质检报告(必须加盖药品生产厂家红章);13.临床前实验室资料;14.试验用药品标签;15. 研究者履历表及相关文件(PI签名及日期);16. 申办方的资质证明(营业执照、生产许可证、GMP证书,税务登记证,组织机构代码证等复印件);17.CRO及SMO公司资质证明(如有);18. 监查员和CRC的法人委托书,身份证复印件,学历证明、GCP 培训证书及个人研究简历;19. 其他试验相关文件提供资料(如受试者须知、受试者日记卡、研究问卷表、招募广告、保险声明等)。
备注:1、以上所有材料需加盖红章,一式两份;装订要求:每一小项放在一份文件保护袋中,再按照目录顺序要求放入三孔文件夹中,用索引纸分开(参考如下:齐心TC530AB 文件夹A4打孔夹背宽40mm 1.5寸3孔O型档案夹,蓝色天猫+%BF%D7+o%D0%CD%BC%D0+%C6%EB%D0%C4 。
3孔O型夹齐心蓝色)。
2、将电子档或扫描件发邮箱:.。
药物临床试验申请审批表
申办者声明
我保证以上信息真实准确,并负责该临床试验全过程的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
如有失实,愿意承担相关责任。
申办者代表签名(盖章):
年月日
CRO 公司声明
我保证以上信息真实准确,并负责该临床试验全过程的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
如有失实,愿意承担相关责任。
CRO 代表签名(盖章):
年月日
主要研究者声明
我保证以上信息真实准确,并负责该临床试验全过程中的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
本人承诺本研究团队人员与该项目无利益冲突。
如有失实,愿意承担相关责任。
主要研究者签字:
年月日
审批意见(手签)
主要研究者对本试验的评估及意见: 1 .试验的入排标准是否合理: 是口 2 .病源病种是否能够满足方案要求: 是口 3 .研究人员是否有足够的试验时间: 是口 4 .科室的场地和设施是否能保障: 是口 5 .是否能对试验质量进行保证: 是口
6 .是否保证能在约定时间内完成试验:是口
7 .科室在研项目情况:
是否有竞争入组临床试验在研: 是口在
研药物临床试验数量:项,其中处于筛选期和治疗期的项 8 .主要研究者决定:同意承接口
主要研究者(签字):
年月日
科室意见:
□□
□
□□
□□
否
否否否否否否。