高等有机化学各章习题及答案 (5)
- 格式:doc
- 大小:77.50 KB
- 文档页数:3

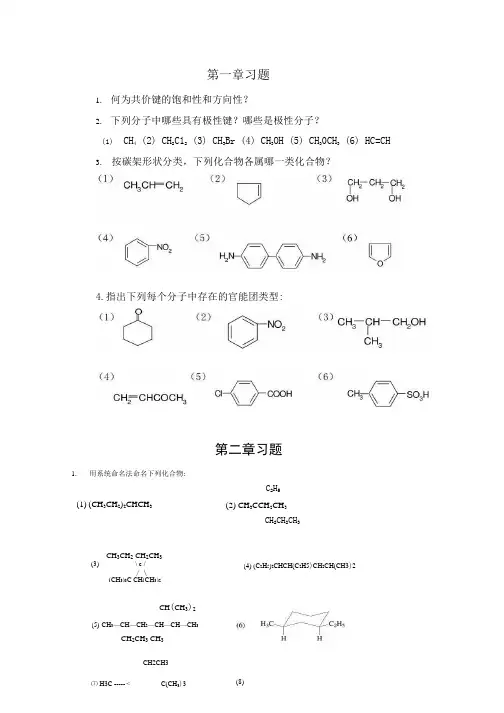
第一章习题1.何为共价键的饱和性和方向性?2.下列分子中哪些具有极性键?哪些是极性分子?(1)CH4 (2) CH2C12 (3) CH3Br (4) CH3OH (5) CH30CH3 (6) HC=CH3.按碳架形状分类,下列化合物各属哪一类化合物?第二章习题1.用系统命名法命名下列化合物:(1) (CH3CH2)2CHCH3C2H5 (2) CH3CCH2CH3CH2CH2CH3CH3CH2 CH2CH3(3)\ c // \(CH3)3C CH(CH3)2(4) (C2H5)2CHCH(C2H5)CH2CH(CH3)2CH(CH3)2(5)CH3—CH—CH2—CH—CH—CH3CH2CH3 CH3CH2CH34.指出下列每个分子中存在的官能团类型:⑺ H3C ----- < C(CH3)3 (8)2. 写出下列化合物的构造式:(1) 由一个叔丁基和异丙基组成的烷炷; (2) 含一侧链甲基,分子量为98的环烷炫(3) 分子量为114,同时含有1°、2°、3。
、4。
碳的烷炷。
3.写出下列化合物的结构式,如其名称与系统命名原则不符,请予以改正。
(1)3, 3-二甲基丁烷 (2)2, 3-二甲基-2-乙基丁烷 (3) 4 -异丙基庚烷(4) 3> 4-二甲基-3 -乙基戊烷(5)3, 4, 5-三甲基-4-正丙基庚烷 ⑹2 -叔丁基-4, 5 -二甲基己烷4. 相对分子质量为72的烷任进行高温氯化反应,根据氯化产物的不同,推测各种烷炷的结构式。
(1)只生成一种一氯代产物(2)可生成三种不同的一氯代产物(3) 生成四种不同的一氯代产物 (4)只生成二种二氯代产物 5.不查表将下列烷炷的沸点由高至低排列成序: (1)2, 3-二甲基戊烷 (2) 2-甲基己烷 (3)正庚烷 (4) 正戊烷(5)环戊烷6. 写出下列化合物的优势构象—( 「CH2CH3 (1) BrCH 2CH 2Cl (2) CH 3CH 2CH 2CH 2CH 3 (3) '、'、—/(4)反-1-甲基-4-叔丁基环己烷7. 写出1, 3-二甲基环已烷和1-甲基-4-异丙基环已烷的顺、反异构体优势构象,并比较每组中哪个稳定。


第一章 习 题(一) 用简单的文字解释下列术语:(1) 有机化合物:碳氢化合物及其衍生物。
(2) 键能:形成共价鍵时体系所放出的能量。
(3) 极性键:成鍵原子的电负性相差为0.5~1.6时所形成的共价鍵。
(4) 官能团:决定有机化合物的主要性质的原子或原子团。
(5) 实验式:能够反映有机化合物元素组成的相对比例的化学式。
(6) 构造式:能够反映有机化合物中原子或原子团相互连接顺序的化学式。
(7) 均裂:共价鍵断裂时,两个成鍵电子均匀地分配给两个成鍵原子或原子团,形成两个自由基。
(8) 异裂:共价鍵断裂时,两个成鍵电子完成被某一个成鍵原子或原子团占有,形成正、负离子。
(9)sp 2杂化:由1 个s 轨道和2个p 轨道进行线性组合,形成的3个能量介于s 轨道和p 轨道之间的、能量完全相同的新的原子轨道。
sp 2杂化轨道的形状也不同于s 轨道或p 轨道,而是“一头大,一头小”的形状,这种形状更有利于形成σ键。
(10) 诱导效应:由于成键原子的电负性不同而引起的电子云的转移。
诱导效应只能通过σ键传递,并且随着碳链增长,诱导效应迅速减弱。
(11) 氢键:由氢原子在两个电负性很强的原子之间形成“桥梁”而导致的类似化学键的分子间或分子内作用力。
氢键具有饱和性和方向性,但作用力比化学键小得多,一般为20~30kJ/mol 。
(12) Lewis 酸:能够接受的电子的分子或离子。
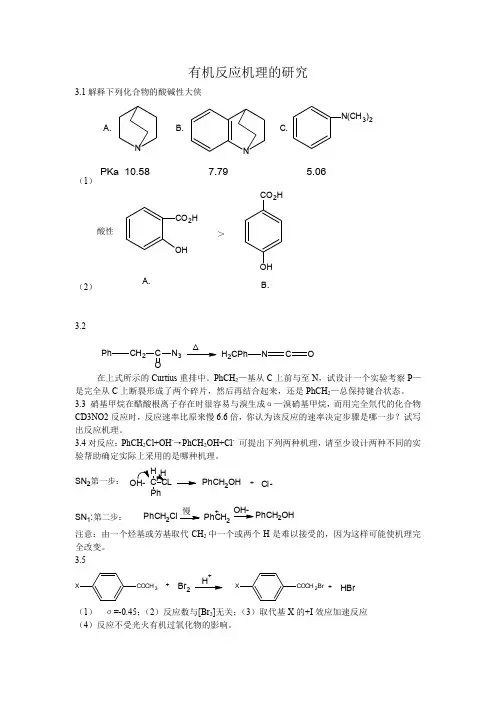
(二) 下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
(1)C H 3N H 2 (2) C H 3O C H 3 (3)CH 3C OH O(4) C H 3C H =C H 2 (5) C H 3C C H (6) CH 2O 解:分别以“○”表示氢原子核外电子,以“●”表示碳原子核外电子,以“★”表示氧原子核外电子,以“△”表示氮原子核外电子,题给各化合物的Lewis 结构式如下:(1) C HHH H H。
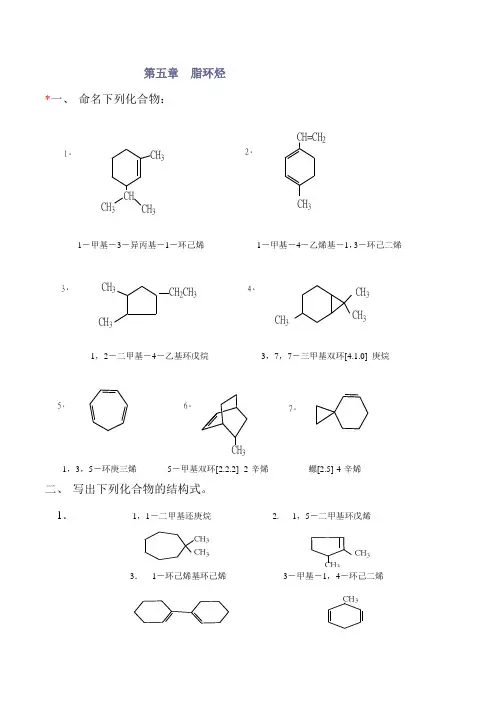
第五章 脂环烃*一、 命名下列化合物:1.CH CH 3CH 3CH 32.CH=CH 2CH 33.CH 3CH 3CH 2CH 34.CH 3CH3CH 35.6.37.1,3,5-环庚三烯 5-甲基双环[2.2.2] -2-辛烯 螺[2.5]-4-辛烯二、 写出下列化合物的结构式。
1. 1,1-二甲基还庚烷 2. 1,5-二甲基环戊烯CH 3CH 3CH CH 3CH 35.双环[4.4.0]癸烷 6.双环[3.2.1]辛烷7.螺[4.5]-6-癸烯三、写出分子式为C5H10的环烷烃的所有构造异构体和顺反异构体的结构式,并命名之。
CH3CH3CH3CH3CH3CH3CH3C2H5环戊烷甲基环丁烷1,1-二甲基环丙烷顺-1,2-二甲基环丙烷反-1,2-二甲基环丙烷乙基环丙烷四、下列化合物是否有顺反异构体?若有,写出它们的立体结构式。
CHCH3CH3CH=C(CH3)2CH3CH3 1.2.3.没有没有没有CH3CH3CH3CH3CH34.Cl CH=CHCH3C=CHCH3HCH3HCH3HCH3 5.6.ClClClCl H*五、写出下列化合物最稳定构象的透视式。
CH(CH 3)2CH(CH 3)2CH 3CH(CH 3)2CH 3CH 2CH 3C(CH 3)3CH 3CH 3(CH 3)3C5.CH 3CH3C(CH 3)3*六、完成下列反应式。
CH3CH 3CH 2CH 2CH 3BrCH 2CH 2CHCH 3CH 3CH 2CHCH 3I2.CH3HCH 3CH 3CH 3Br BrBrO CH 3OOCH 3COCH 2CH 2CH 2CHO3.BrBrBrBrCNCOOC 2H 5CH 2=CHCN5BrCH 3+Br 2hv CH 34.1.七、1,3-丁二烯聚合时,除生成高分子聚合物之外,还得到一种二聚体。
该二聚体能发生下列反应:①①催化加氢后生成乙基环己烷②②和溴作用可加四个溴原子③③用适量的高锰酸钾氧化能生成β-羧基己二酸,根据以上事实,推测该二聚体的结构,并写出各步反应式。

《有机化学》习题参考答案引 言这本参考答案是普通高等教育“十二五”规划教材《有机化学》(周莹、赖桂春主编,化学工业出版社出版)中的习题配套的。
我们认为做练习是训练学生各种能力的有效途径之一,是对自己所学内容是否掌握的一种测验。
因此,要求同学们在学习、消化和归纳总结所学相关知识的基础上完成练习,即使有些可能做错也没有关系,只要尽心去做就行,因为本参考答案可为读者完成相关练习后及时核对提供方便,尽管我们的有些参考答案(如合成题、鉴别题)不是唯一的。
北京大学邢其毅教授在他主编的《基础有机化学习题解答与解题示例》一书的前言中写道:“解题有点像解谜,重在思考、推理和分析,一旦揭开了谜底,就难以得到很好的训练。
” 这句话很符合有机化学解题的特点,特摘录下来奉献给同学们。
我们以为,吃透并消化了本参考答案,将会受益匪浅,对于报考研究生的同学,也基本够用。
第一章 绪论1-1解:(1)C 1和C 2的杂化类型由sp 3杂化改变为sp 2杂化;C 3杂化类型不变。
(2)C 1和C 2的杂化类型由sp 杂化改变为sp 3杂化。
(3)C 1和C 2的杂化类型由sp 2杂化改变为sp 3杂化;C 3杂化类型不变。
1-2解:(1) Lewis 酸 H +, R +,R -C +=O ,Br +, AlCl 3, BF 3, Li +这些物质都有空轨道,可以结合孤对电子,是Lewis 酸。
(2)Lewis 碱 x -, RO -, HS -, NH 2, RNH 2, ROH , RSH这些物质都有多于的孤对电子,是Lewis 碱。
1-3解:硫原子个数 n=5734 3.4%6.0832..07⨯=1-4解:甲胺、二甲胺和三甲胺都能与水形成氢键,都能溶于水。
综合考虑烷基的疏水作用,以及能形成氢键的数目(N 原子上H 越多,形成的氢键数目越多),以及空间位阻,三者的溶解性大小为:CH 3NH 2 >(CH 3)2NH >(CH 3)3N1-5解: 32751.4%1412.0Cn ⨯==,327 4.3%141.0H n ⨯==,32712.8%314.0N n ⨯==,3279.8%132.0S n ⨯==, 32714.7%316.0O n ⨯==, 3277.0%123.0Na n ⨯==甲基橙的实验试:C 14H 14N 3SO 3Na 1-6解: CO 2:5.7mg H 2O :2.9mg第二章 有机化合物的分类和命名2-1解:(1) 碳链异构(2)位置异构(3)官能团异构(4)互变异构2-2解:(1) 2,2,5,5-四甲基己烷 (2 ) 2,4-二甲基己烷(3)1-丁烯-3-炔(4)2-甲基-3-氯丁烷(5)2-丁胺(6)1-丙胺(7)(E)-3,4-二甲基-3-己烯(8)(3E,5E)-3-甲基-4,5-二氯-3,5-辛二烯(9)2,5-二甲基-2,4-己二烯(10)甲苯(11)硝基苯(12)苯甲醛(13)1-硝基-3-溴甲苯(14)苯甲酰胺(15)2-氨基-4-溴甲苯(16)2,2,4-三甲基-1-戊醇(17)5-甲基-2-己醇(18)乙醚(19)苯甲醚(20) 甲乙醚 (21) 3-戊酮 (22 ) 3-甲基-戊醛(23)2,4-戊二酮(24)邻苯二甲酸酐(25)苯乙酸甲酯(26)N,N-二甲基苯甲酰胺(27)3-甲基吡咯(28)2-乙基噻吩(29)α-呋喃甲酸(30)4-甲基-吡喃(31)4-乙基-吡喃(32)硬脂酸(33)反-1,3-二氯环己烷(34)顺-1-甲基-2-乙基环戊烷(35)顺-1,2-二甲基环丙烷2-3解:(1)CH3CHCH3CH3CH3CHCH3CH3C(2)CH3CHCH3CH2CH2CH2CH3C2H5(3)CH3CHCH3CHCH2C2CH3C2H525 (4)C2H5HCH3H(5) H2252CH2CH3(6)(7)HCH3HCH3HH(8)3(9)52H5 (10)(11) CH3NO2NO2 (12)H3(13) (14)OHCOOHBr(15) BrCHOCH3CH3 (16)CH3CH2OH(17) OH (18)OH BrBr(19)OHSO3HNO2(20)OO O(21) O(22)O(23)HCH3HCHO(24)H33(25)NHCH3O(26)NH2NH(27)NHO(28)S(29)NCH2H5OCH2H5(30) CH3(CH2)7CH=CH(CH2)7COOH(31)NH2ONH2(32)H2N-CONH-C-NH2(33) OOO(34)OCHO2-4解:(1)C H3CH2CH3CH3CHCH3CH3C命名更正为:2,3,3-三甲基戊烷(2)C H3CH2CHCHCH3CH3CH3(3)(4)(5)(6)(7)(8)2-5解:可能的结构式2-6解:(1)(2)CH3C2H5CH2CH2CH3CH2CH2CH2CH3(3)CH3CH3CH2CH2CH3CH3C2H5C2H5C2H5CH2CH2CH3 2-7解:1,3-戊二烯 1,4-戊二烯H2CH2CH32CH3H31-戊炔 2-戊炔H2C2H5CH3CH CH31,2-戊二烯 2,3-戊二烯H2333-甲基-1,2-丁二烯第三章饱和烃3-1解:(1) 2,3,3,4-二甲基戊烷 (2) 3-甲基-4-异丙基庚烷(3) 3,3-二甲基戊烷 (4) 2,6-二甲基-3,6-二乙基辛烷 (5) 2,5-二甲基庚烷 (6) 2-甲基-3-乙基己烷(7)2-甲基-4-环丙基自己烷(8)1-甲基-3-乙基环戊烷3-2解:(1)H3332CH3(2)(3) H333(4)(5) (6)3-3解:(1) 有误,更正为:3-甲基戊烷(2) 正确(3) 有误,更正为:3-甲基十二烷(4) 有误,更正为:4-异丙基辛烷(5) 4,4-二甲基辛烷(6) 有误,更正为:2,2,4-三甲基己烷3-4解:(3) > (2) > (5) > (1) > (4)3-5解:BrHH HHBr BrHHHHBrBrHHBrHHBrHB rHH(A)对位交叉式 (B)部分重叠式 (C)邻位交叉式 (D)全重叠式A>C>B>D3-6解:(1)相同 (2)构造异构(3)相同(4)相同(5)构造异构体 (6)相同3-7解:由于烷烃氯代是经历自由基历程,而乙基自由基的稳定性大于甲基自由基,故一氯甲烷的含量要比一氯乙烷的含量要少。

第五章饱和烃5-1 写出符合下列条件的C7H16的构造式,并各以系统命名法命名。
(1)庚烷(3)3-甲基已烷(4)2,2-二甲基戊烷(5)2,3-二甲基戊烷(6)2,4-二甲基戊烷(7)3,3-二甲基戊烷(8)3-乙基戊烷(9)2,2,3-三甲基丁烷5-2 写出下列烷基的名称及常用缩写符号。
(1)甲基(Me—);(2)乙基(Et—);(3)正丙基(n-Pr—);(4)异丙基(i-Pr—);(5)正丁基(n-Bu—);(6)异丁基(i-Bu—);(7)仲丁基(s-Bu—);(8)叔丁基(t-Bu—)。
5-3 比较下列化合物沸点的高低,并说明原因。
(1) CH3(CH2)4CH3(2) (CH3)2CH(CH2)2CH3(3)CH3CH2C(CH3)3(4) CH3CH2CH(CH3)CH2CH3(1)>(4) >(2)>(3)同碳数的烷烃异构体,含支链越多,分子间作用力越弱,沸点越低。
5-4 完成下列反应式:OSO3HBrBrBr(1)HO2C(CH2)4CO2HHNO3+(2)BrBr-60℃Br 2+(3)CH(CH 3)2CO 2H 2OCl+ClClCl碳正离子重排导致的产物++CH(CH 3)2BrC(CH 3)2Br+(4)BrHBr(5)5-5 比较下列化合物构象的稳定性大小。
1,4-二甲基环已烷的构象稳定性(1)<(2)。
原因是(1)中的二个甲基均处于a 键上,而(2)中的二个甲基则皆处于e 键上,后者构象能量较低,较稳定。
3H 33CH 3CH 3H 3CCH 3(1)(2)5-6 下列异构体中哪个最稳定?题目所示二甲基环已酮三个异构体对应的构象式如下,从中可看出(3)最稳定,因为其两个甲基均处于e 键上,体系能量较低。
O OO(1)(2)(3)5-7 环丙烷内能高是由哪些因素造成的?环丙烷分子中碳原子为不等性sp 3杂化,轨道重叠比开链烷烃的小,形成的碳碳共价键键能小(即有角张力),容易断裂,不如开链烷烃牢固;其次是环丙烷的三个碳原子共平面,相邻两个碳原子上的C —H 键是重叠式构象,存在扭转张力。
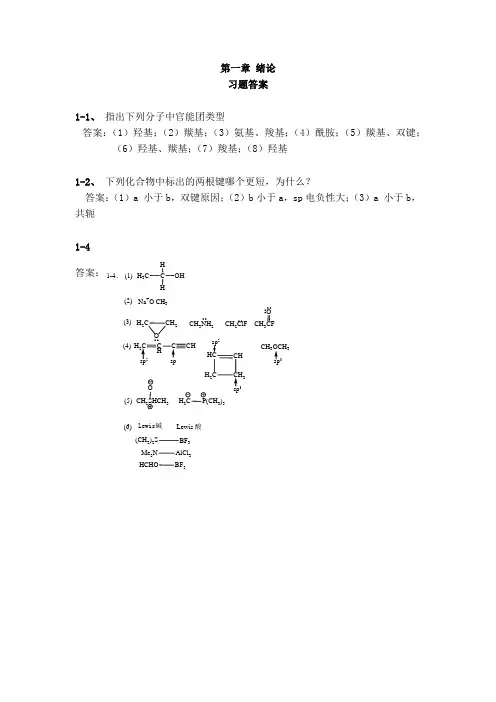
第一章 绪论 习题答案1-1、 指出下列分子中官能团类型答案:(1)羟基;(2)羰基;(3)氨基、羧基;(4)酰胺;(5)羰基、双键;(6)羟基、羰基;(7)羧基;(8)羟基1-2、 下列化合物中标出的两根键哪个更短,为什么?答案:(1)a 小于b ,双键原因;(2)b 小于a ,sp 电负性大;(3)a 小于b ,共轭 1-4 答案:(1)C HHH 3COH(2)Na +O -CH 3(3)H 2C CH 2O(4)CH 3NH 2CH 2ClF3HHC CH H 2CCH2sp 23CH 333(5)CH 2SHCH 3OH 2CP(CH 3)3(6)Lewis 酸Lewis 碱(CH 3)2S BF 3Me 3N AlCl 3HCHOBF 31-4、第2章 烷烃和环烷烃习题及答案2-1 用中文系统命名法命名或写出结构式。
答案: (1)2,6,6-三甲基-3-乙基辛烷 (2)2,6,7-三甲基壬烷(3)1-甲基-1-氯环己烷 (4) 顺-1,2-二溴环己烷 (5(6)(7)CCCC CH 3CH 3CH 3CH 3H 3H 3(8) (CH 3)2CHCH 2CH 2CH 32-2 用不同符号标出下列化合物中伯、仲、叔、季碳原子,并给以命名。
答案: (1) CH 3CH CH 2C C CH 3CH 3CH 2CH 3CH 3CH 3CH 2CH 31o 1o 1o1o1o1oo 2o2o 21o o 3o4o 43,3,4,4,6-五甲基辛烷 (2) CH3CH(CH 3)CH 2C(CH 3)2CH(CH 3)CH 2CH31o1o1o1o1oo2o2o 3o 3o 42,4,4,5-四甲基庚烷2-3 指出下列四个化合物的命名中不正确的地方并给以重新命名。
答案: (1)主链选错。
应为:2,4,6-三甲基-6-乙基辛烷 (2)主链、碳原子编号错。
应为:2-甲基-3乙基己烷 (3)碳原子编号错。

5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。
第一章绪论 (1)第二章饱和烃 (3)第三章不饱和烃 (7)第四章环烃 (14)第五章旋光异构 (22)第六章卤代烃 (27)第七章波谱分析 (33)第八章醇酚醚 (34)第九章醛、酮、醌 (41)第十章羧酸及其衍生物 (50)第十一章取代酸 (58)第十二种含氮化合物 (65)第十三章含硫和含磷有机化合物 (72)第十四章碳水化合物 (74)第十五章氨基酸、多肽与蛋白质 (78)第十六章类脂化合物 (82)第十七章杂环化合物 (88)第一章绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 4b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H H c.H N HHd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OO H H或1.5 下列各化合物哪个有偶极矩?画出其方向。
5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。
《有机化学》(第五版,李景宁主编)习题答案 第五章2、写出顺-1-甲基-4-异丙基环己烷的稳定构象式。
CH 3HCH(CH 3)23)2H HH 3C稳定构象4、写出下列的构造式(用键线式表示)。
(1)1,3,5,7-四甲基环辛四烯 (3) 螺[5,5]十一烷5、命名下列化合物(1)反-1-甲基-3乙基环戊烷 (2)反-1,3-二甲基-环己烷 (3)2,6-二甲基二环[2,2,2]辛烷 01(4)1,5-二甲基-螺[4,3]辛烷 6、完成下列反应式。
(2)C=CH 2CH 3KMnO 4COCH3+ CO 2(3)Cl 300CCl(4)(6)(7)+ClCl(10)(11)Br2/CCl4CH2CH2CHCH38、化合物物A分子式为C4H8,它能是溴溶液褪色,但不能使烯的高锰酸钾溶液褪色。
1mol (A)与1molHBr作用生成(B),(B)也可以从(A)的同分异构体(C)与HBr作用得到。
化合物物(C)能使溴溶液褪色,也能使烯的高锰酸钾溶液褪色。
试推论化合物(A)、(B)、(C)的构造式,并写出各步的反应式。
答:根据化合物的分子式,判定A是烯烃或单环烷烃9、写出下列化合物最稳定的构象式。
(1)反-1-甲基-3-异丙基环己烷HH 3)2|CH 3(2) 顺-1-氯-2-溴环己烷第六章 对映异构2、判断下列化合物哪些具有手性碳原子(用 * 表示手性碳原子)。
哪些没有手性碳原子但有手性。
(1)BrCH 2-C *HDCH 2Cl 有手性碳原子(3)**Br OH有手性碳原子(8)CH=CH-CH=CH 2无手性碳原子,无手性(10没有手性碳原子,但有手性5、指出下列构型式是R 或S 。
6、画出下列化合物所有可能的光学异构体的构型式,标明成对的对映体和内消旋体,以R 、S 标定它们的构型。
(2)CH 3CHBrCHOHCH 3Br Cl(5)H2C CHCl H27、写出下列各化合物的费歇尔投影式。
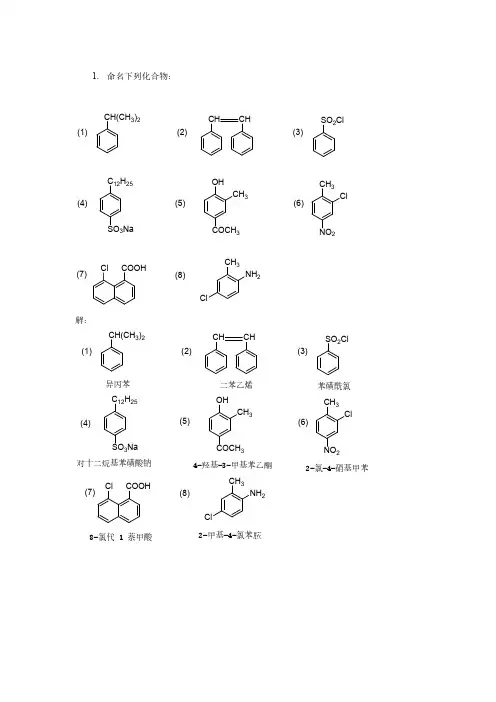
第五章 芳烃 芳香性思考题P152 习题5.1 写出四甲(基)苯的构造异构体并命名。
解:CH 3CH 3CH 3CH 3CH 3CH 3CH 3H 3CCH 3CH 3CH 3H 3C1,2,3,5-四甲(基)苯1,2,3,4-四甲(基)苯1,2,4,5-四甲(基)苯P152 习题5.2 命名下列各化合物或基:解:CH 3C 2H 5CH(CH 3)2CH 2CH 2C=CCH 3HH 3C1-甲基-2-乙基-4-异丙基苯1,2-二苯乙烷顺-2-苯基-2-丁烯(E)-2-苯基-2-丁烯CH 3CH 3CHC(CH 3)3(CH 3)3C 2,6-二甲基苯基β-苯乙基2,2,4,4-四甲基-3-苯基戊烷CH 2CH 22-苯乙基P153 习题5.3 写出下列各化合物或基的结构式:(1) 异丁苯CH 2CHCH 3CH 3(2) 间甲苯基环戊烷CH 3(3) (E)-1,2-二苯乙烯C=CH PhPhH(4) 顺-5-甲基-1-苯基-2-庚烯C=CHHCH 2CHCH 2CH 3CH 2CH 3(5) 二苯甲基CH C 6H 5C 6H 5(6) 3-苯基-2-丙烯基CH 2CH=CH C 6H 5P156 习题5.4 甲苯的沸点比苯高30.5℃,而熔点低~100℃,为什么?解:甲苯的相对分子质量大于苯,分子间色散力大于苯,因比甲苯的沸点也高于苯;但苯分子的对称性好,晶格能大于甲苯,因此苯的熔点高于苯。
P161 习题5.5 写出乙苯与下列试剂作用的反应式(括号内是催化剂):(1) Cl 2(FeCl 3) (2) 混酸 (3) 正丁醇(BF 3) (4) 丙烯(无水AlCl 3) (5) 丙酸酐(CH 3CH 2CO)2O(无水AlCl 3) (6) 丙酰氯CH 3CH 2COCl(无水AlCl 3) 解:(1)CH 3CH 2CH 3CH 2ClClCH 2CH 3Cl FeCl 3+(2) 混酸CH 3CH 2CH 3CH 2NO 2+NO 2CH 2CH 3(3)BF 3323C 2H 5CHCH 2CH 3CH 3CH 2CH 3+CHCH 2CH 3CH 2CH 3CH 3(4)233+CH(CH 3)2CH 2CH 3CH 2CH 3CH 2CH 3CH(CH 3)2(5)(CH 3CH 2CO)2O 3+COCH 2CH 3CH 2CH 3CH 2CH 3CH 2CH 3CCH 2CH 3O(6)323CH 2CH 3+COCH 2CH 3CH 2CH 3CH 2CH 3CCH 2CH 3OP161习题5.6 由苯和必要的原料合成下列化合物:(1)解:HO H SO +(或环己烯)(2) 叔丁苯解:C CH 3CH 3CH 3+ CH 2=C CH 3CH 3H SO (3) CH 2(CH 2)5CH 3解:HCl+C(CH 2)5CH 3OCH 3(CH 2)5C O3CH 2(CH 2)5CH3(4)C CH 2CH 2OC OH O解:OOO+3CCH 2CH 2C OH OOP164 习题5.7 试以苯和必要的原料合成正丙苯。
有机反应机理的研究
3.1解释下列化合物的酸碱性大侠
(1)
N
N
N(CH 3)2
PKa 10.58 7.79 5.06
A.
B.
C.
(2)CO 2H
OH
A.
酸性
CO 2H
B.
>
3.2
CH 2
C N 3
Ph
△
H 2CPh
N C O
在上式所示的Curtius 重排中。
PhCH 2—基从C 上前与至N ,试设计一个实验考察P —是完全从C 上断裂形成了两个碎片,然后再结合起来,还是PhCH 2—总保持键合状态。
3.3 硝基甲烷在醋酸根离子存在时很容易与溴生成α—溴硝基甲烷,而用完全氘代的化合物CD3NO2反应时,反应速率比原来慢6.6倍,你认为该反应的速率决定步骤是哪一步?试写出反应机理。
3.4对反应:PhCH 2Cl+OH -→PhCH 2OH+Cl - 可提出下列两种机理,请至少设计两种不同的实验帮助确定实际上采用的是哪种机理。
C H PhCH 2OH
Cl-
+
SN 2第一步:
SN 1:第二步:PhCH 2慢
PhCH 2
+
OH-
PhCH 2OH
注意:由一个烃基或芳基取代CH 2中一个或两个H 是难以接受的,因为这样可能使机理完全改变。
3.5
X
COCH 3
+
Br 2
H
+
HBr
X
COCH 2Br +
(1) σ=-0.45;(2)反应数与[Br 2]无关;(3)取代基X 的+I 效应加速反应
(4)反应不受光火有机过氧化物的影响。
试按以上给出的条件设计合理的反应历程。
3.6 α—醋酸—对硝基乙烯的水解是酸催化反应
OCOCH 3
NO 2
C CH 2
O
NO 2
C CH 3
H 2O
+
CH 3CO 2H
在6%的硫酸中,动力学同位素效应k (H2O )/k (D2O )是0.75,多少69%的硫酸中,动力学同位素效应改变为3.25,试推测此反应的机理。
3.7 下列反应:
H 3C
SO 2OCH 3
LiX
+
CH 3X
DMF
3C
SO 3Li
相对反应速率分别为:Cl-(7.8)>Br-(3.2)>I-(1.0),若分别在上述反应中加入9%的水,在与LiCl 反应,反应速率比不加水时慢24倍,而与KI 反应,反应速率只慢2倍,试解释之。
3.8 2,2—二甲基—4—苯基—3—丁烯酸进行热脱羧反应,得到2—甲基—4—苯基—2—丁烯和二氧化碳。
CH CMe 2CO
H HCPh
H 2CPh
CH
CMe 2
+
CO 2
a
b
c
在a 位上用D 取代H ,观察到同位素效应k H /k D =2.87,同样,在b 位上碳的同位素效应k 12/k 14=1.035(对碳而言,这是大值),这些现象如何说明脱羧反应是协同机理,试拟定一个可能的过渡态。
答案:
3.1(1)A 中氮上的孤电子对,使其具有碱性。
B 中氮上孤电子对,可与苯环共轭,碱性变小。
C 中氮上孤电子对,与苯环共轭的同时和氮相连的两个甲基使氮上孤电子对不裸露,
碱性比B 稍小。
(2) 因为A 中COOH 与OH 形成分子内氢键,酸性较大。
即:
O
C
O OH
3.2使用一个光活性的迁移基团,如在PhCH (CH 3)CON 3中,若消旋化意味着该基团完全
断裂离去。
构型保持则意味着不是这样(后者是真实的结果)。
3.3重氢化合物反应更慢,因为C —D 键比C —H 键更强,这时决定速率的步骤应是硝基甲烷的电离,醋酸根负离子可以作为催化这步反应的碱,然后是硝基甲烷负离子与溴的快速反应。
CH 3NO 2+CH 3COO--CH 2NO 2+CH 3COOH
-CH 2NO 2
+
Br 2快
CH 2BrNO 2
+
Br-
3.4(1)D 取代一个H ,然后使用光活性的PhCHDCl 确定是构型转化(S N 2)还是消旋化(S N 1)。
(2)S N 2机理是双分子的,速率取决与卤代物及OH -两者的浓度;S N 1机理是单分子的,速率仅决定于卤代物的浓度。
所以测量速率是取决于OH -浓度还是与OH -浓度无关,将有助于确定其反应机理。
(3)S N 1机理过渡态中出现正电荷,这意味着环上的吸电子基团将使反应变慢,所以测量环上带有m-和p-取代基的反应速率并计算ρ,ρ值为负时,表明是S N 1;ρ值为正则证实为S N 2。
3.5由给出的反应条件,可以推断这一反应为亲电反应,反应速率取决于H +与酮络合形成碳正离子这一步。
因而推电子取代基对反应有利。
碳正离子形成后迅速使H +离解,变成取代苯乙酮的烯醇式,由于碳碳双键上同时带了给电子的—OH 和苯环,故和Br +的亲电加成非常快,这样溴的浓度变化也就无关紧要了。
反应可用如下历程表示:
X
C 3
O
X
C
3
OH
X C CH 2
OH
H
+
+-H
+
C
2Br
O
Br
H X
2
+
3.6动力学同位素效应的转化说明反应机理发生了变化。
在稀酸中,是一般酯水解机理,由水分子进攻质子化的酯,而D 3O +的酸性比H 3O +强,质子化酯在D 2O 中比在H 2O 中浓度高,故在D 2O 中反应速率也快。
在浓酸中,因速率决定步骤是质子化的酯先变为碳正离子,然后水分子进攻碳正离子,这时慢步骤包括O —H(O —D)键断裂,所以在D 2O 中比在H 2O 中水解慢。
NO 2
COCH 3
NO 2
C
CH 2
H 3COCO NO 2
C
CH 3
H 3COCO
+H 3O
+
慢
H 2O
CH 3
COOH
H
+
++++H 2O
3.7 DMF 是极性非质子性溶剂,卤素离子在DMF 中的亲核性为:Cl ->Br ->I -。
各负离子在质子溶剂(如H 2O )中的溶剂化能力为:F ->Cl ->Br ->I -。
溶剂化程度愈强,负离子的亲核反应活性愈低。
3.8在控制步骤的过渡态中,如观察到原子化学键被减弱,通常此反应就显示初级同位素效应,据此,在上述反应中的H a 和C b 键必然是在慢步骤中断裂,在多数情况下,一个键的断裂即构成了慢步骤,而在上述反应中观察到两个同位素效应,说明这是一个“协同”或者“没有机理”的反应,此现象和双键的移动,说明存在一个环状的过渡态。
C C C
O C
O
Ph
H Me
Me H。