无机化学---第四章 氧化还原反应
- 格式:ppt
- 大小:3.46 MB
- 文档页数:7

无机化学中的重要反应一、氧化还原反应氧化还原反应是无机化学中最为重要的反应之一,广泛应用于工业生产和实验室研究中。
在氧化还原反应中,物质失去或获得电子,从而引发化学反应。
常见的氧化还原反应包括金属与酸的反应、金属与非金属的反应等。
例如,铜与硝酸反应的氧化还原反应方程式为:Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O在这个反应中,铜原子失去两个电子被氧化为正二价铜离子,硝酸接受这两个电子而被还原为一氧化氮和水。
通过这种氧化还原反应,铜被转化为铜离子,而硝酸则被还原为一氧化氮和水。
二、沉淀反应沉淀反应是无机化学中常见的反应类型之一,涉及到溶液中的离子型态的变化和沉淀物的生成。
当两种水溶液中的阳离子和阴离子发生反应时,有可能会产生一种不溶于水的盐类沉淀物,在反应液中以固体形式存在。
例如,铵氢氟化物与铵镉硫酸反应的沉淀反应方程式为:(NH4)HF2 + (NH4)2Cd(SO4)2 + 2H2O → CdF2↓ + 2NH4HSO4在这个反应中,铵氢氟化物和铵镉硫酸反应生成了不溶于水的氟化镉(CdF2)沉淀物。
沉淀反应在实验室中常用于检测阳离子和阴离子的存在,通过观察产生的沉淀物可以判断化合物的组成。
三、酸碱中和反应酸碱中和反应是无机化学中常见的反应类型,涉及到酸和碱之间的反应。
在这种反应中,酸和碱发生中和反应,生成盐和水。
例如,硫酸和氢氧化钠反应的酸碱中和反应方程式为:H2SO4 + 2NaOH → Na2SO4 + 2H2O在这个反应中,硫酸是酸,氢氧化钠是碱,它们反应生成硫酸钠盐和水。
酸碱中和反应广泛应用于实验室和工业生产中,例如在制备药品、肥料和清洁剂等过程中。
四、配位反应配位反应是无机化学中的重要反应类型,涉及到配合物中的配体与中心金属离子之间的结合和解离过程。
在配位反应中,配体可以与中心金属离子发生配位键的形成和断裂。
例如,氯化铂与氨水反应的配位反应方程式为:PtCl2 + 4NH3 → [Pt(NH3)4]Cl2在这个反应中,氯化铂和氨水反应形成了四个氨配体的[Pt(NH3)4]Cl2配合物。

无机化学是研究无机化合物及其反应的一门学科,而氧化还原反应是无机化学中的重要内容之一。
所谓氧化还原反应,是指物质的电荷状态发生变化的化学反应,其中涉及到电子的转移过程。
本文将详细介绍无机化学中的氧化还原反应的定义、特征以及其在日常生活和工业生产中的应用。
首先,我们来了解氧化还原反应的定义。
氧化还原反应是指,在化学反应中,物质的电荷状态发生变化的过程。
在这个过程中,一个物质丧失电子,被氧化称为氧化剂;另一个物质获得电子,被还原称为还原剂。
氧化剂和还原剂总是成对存在的,一个物质的氧化只能与另一个物质的还原同时发生。
这是因为根据电子转移的守恒定律,电子不能被丢失或产生。
氧化还原反应有一些特征。
首先,氧化还原反应可以通过观察电子转移的过程来判断。
当一个物质失去电子时,它被氧化,同时它的氧化态增加。
当一个物质获得电子时,它被还原,同时它的氧化态减少。
其次,氧化还原反应是通过电子在反应过程中的转移而发生的。
电子的转移可以是直接的,也可以通过中间物质媒介。
最后,氧化还原反应一般伴随着能量的转化。
氧化剂和还原剂之间的电子转移通常会释放出能量,这使得氧化还原反应在生物体内的能量转化和工业生产中的能源开发中发挥着重要作用。
在日常生活中,氧化还原反应无处不在。
例如,金属的生锈就是一种常见的氧化还原反应。
当金属与氧气接触时,金属表面的金属离子会失去电子,被氧化生成金属氧化物。
同样,食物的烹调和焊接等过程中,也会出现氧化还原反应。
此外,许多化妆品的制备和使用也离不开氧化还原反应。
在工业生产中,氧化还原反应的应用也非常广泛。
例如,炼铁和生产钢铁时,氧化还原反应是不可或缺的过程。
在这个过程中,铁矿石中的铁被还原为金属铁,同时氧气与碳反应生成二氧化碳气体。
此外,电池的工作原理也是建立在氧化还原反应的基础上的。
电池中的化学反应产生电流,从而产生电能。
总之,无机化学中的氧化还原反应是一种重要的反应类型,它涉及电子转移、能量转化等多个方面。


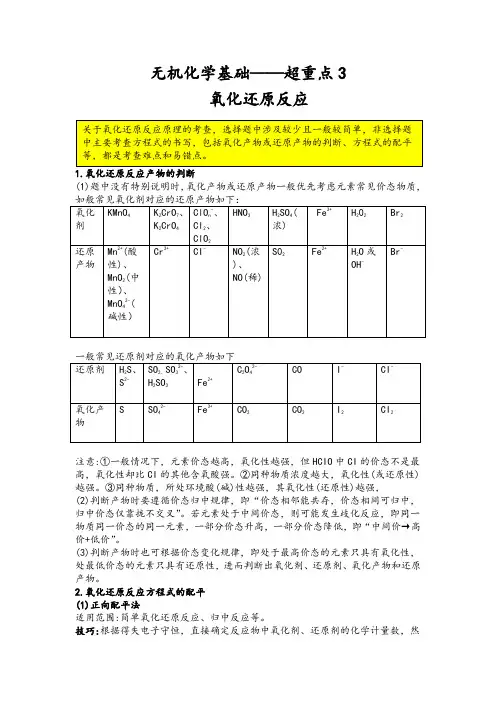
无机化学基础——超重点3氧化还原反应1.氧化还原反应产物的判断(1)题中没有特别说明时,氧化产物或还原产物一般优先考虑元素常见价态物质,注意:①一般情况下,元素价态越高,氧化性越强,但HCIO中CI的价态不是最高,氧化性却比CI的其他含氧酸强。
②同种物质浓度越大,氧化性(或还原性)越强。
③同种物质,所处环境酸(碱)性越强,其氧化性(还原性)越强,(2)判断产物时要遵循价态归中规律,即“价态相邻能共存,价态相间可归中,归中价态仅靠拢不交叉”。
若元素处于中间价态,则可能发生歧化反应,即同一物质同一价态的同一元素,一部分价态升高,一部分价态降低,即“中间价→高价+低价”。
(3)判断产物时也可根据价态变化规律,即处于最高价态的元素只具有氧化性,处最低价态的元素只具有还原性,进而判断出氧化剂、还原剂、氧化产物和还原产物。
2.氧化还原反应方程式的配平(1)正向配平法适用范围:简单氧化还原反应、归中反应等。
技巧:根据得失电子守恒,直接确定反应物中氧化剂、还原剂的化学计量数,然后再根据质量守恒配平其他物质。
实例:MnO42-+H++CI-→Mn2++Cl2↑+H20,Mn由+7价降为+2价,得5e-,Cl由-1价升至Cl2中的0价,失2xe-,根据得失电子守恒,MnO42-和CI-的化学计量数分别为2、10,然后配平其他物质的化学计量数,得2MnO42-+16H++10CI-=====2Mn2++5Cl2↑+8H2(2)逆向配平法适用范围:反应物中同一元素的化合价部分发生变化或同一元素的化合价发生多变化的反应。
技巧:根据得失电子守恒,直接确定生成物中氧化产物与还原产物的化学计量数,然后再根据质量守恒配平其他物质。
实例:Cu+HNO3(浓)→Cu(NO3)2+NO2↑+H20,N由+5价降为+4价,得e-Cu由0价升至+2价,失2e-,根据得失电子守恒,Cu(NO3)2和NO2的化学计量数分别1、2,然后配平其他物质的化学计量数,得Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2(3)设价配平法适用范围:复杂氧化还原反应,如一种反应物中有多种元素化合价发生变化,或物质中的不同元素经化合价变化后存在于同一种产物中。





无机化学氧化还原反应的实验计算与平衡探究无机化学中,氧化还原反应是一类重要的反应类型。
它涉及原子或离子的电子转移过程,常常伴随着物质的氧化和还原状态的变化。
本实验旨在通过一系列实验,探究氧化还原反应的计算与平衡的相关问题。
一、实验目的本实验的目的是通过探究各种氧化还原反应,了解其反应类型、计算反应物质的物质量以及平衡状态的相关知识。
二、实验原理1. 氧化还原反应氧化还原反应指的是在反应中,氧化剂得到电子而被还原,而还原剂失去电子而被氧化的反应过程。
氧化剂是电子受体,而还原剂是电子供体。
2. 氧化还原反应的计算针对氧化还原反应的计算中,通常需要计算反应物质的物质量和平衡状态。
其中,反应物质量的计算可通过化学方程式和摩尔比的关系来求解;平衡状态则是指在反应过程中反应物质的摩尔比达到一定比例时,反应停止的状态。
三、实验步骤1. 根据实验所需,准备相应的实验器材和试剂,如电容量瓶、分析天平、试管、试剂溶液等。
2. 针对氧化还原反应的计算与平衡探究,选择合适的实验模型和反应物质进行实验。
根据实验结果,确定反应物质量和平衡状态。
3. 根据实验计算所得的数据,进行相应的数据处理和分析。
比较不同实验条件下的结果差异,探究氧化还原反应的规律和影响因素。
四、实验结果及讨论1. 分析实验数据,计算不同实验条件下反应物质的物质量和平衡状态。
比较各实验组的数据差异,得出相应结论。
2. 探究不同氧化还原反应的特点和规律。
比如,某些反应中氧化剂和还原剂的摩尔比保持不变,而反应物质量有所改变;而另一些反应中,摩尔比和物质量均有变化。
3. 分析实验中存在的误差和不确定性。
如实验操作的不准确、仪器误差等。
通过引入适当的实验控制组,减小误差和提高实验的可靠性。
五、实验结论通过本实验,我们得出以下结论:1. 氧化还原反应是一种涉及电子转移的反应类型。
2. 氧化剂是电子受体,还原剂是电子供体。
3. 氧化还原反应的计算可通过化学方程式和摩尔比的关系来求解。

第4章 氧化还原反应 习题参考答案1.解:S 的氧化数分别为-2、0、2、4、5、6。
2.解:(1)3Cu + 8HNO 3(稀) → 3Cu(NO 3)2+2 NO ↑ + 4H 2O(2)4Zn + 5H 2SO 4(浓) →4ZnSO 4 +H 2S ↑ + 4H 2O(3)KClO 3 + 6 FeSO 4 + 3H 2SO 4 → KCl +3 Fe 2 (SO 4)3 + 3H 2O(4)Cu 2S + 22HNO 3 → 6Cu (NO 3)2 + 3H 2SO 4 + 10NO↑ +8 H 2O3.解:(1) 12I - 2e → I 2--+) 1H 2O 2+ 2H + + 2e → 2H 2O -2I + H 2O 2+ 2H + → I 2+2H 2O -(2) 1Cr 2O + 14H + + 6e → 2Cr 3+ + 7H 2O 27--+) 3H 2S - 2e → S + 2H +-Cr 2O + 3H 2S + 8H + → 2Cr 3+ + 3S↓ + 7H 2O27-(3) 1ClO + 6H + + 6e → Cl - + 3H 2O 3--+) 6Fe 2+-e →Fe 3+-ClO + 6Fe 2++ 6H + → Cl - +6Fe 3+3H 2O3-(4)1/2Cl 2+ 2e →2Cl - -+) 1/2Cl 2 + 4OH - 2e →2ClO -+ 2H 2O --Cl 2 + 2OH →Cl -+ClO -+ H 2O -(5)1Zn + 4OH - 2e →[Zn (OH)4]2---+) 1ClO -+ H 2O +2e →Cl -+ 2OH --Zn + ClO -+2OH + H 2O→[Zn (OH)4]2- + Cl --(6)2MnO + e → MnO 4--24- +) 1SO + OH - 2e →SO + H 2O 23---24- 2MnO +SO + 2OH →2 MnO +SO + H 2O4-23--24-24-4.解:(1)(-)Pt ,I 2(s)∣I (c 1)‖Cl -(c 2)∣Cl 2(P ), Pt (+)- (2)(-)Pt ∣Fe 2+, Fe 3+ (c 3)‖MnO (c 3), Mn 2+(c 4),H +(c 5)∣Pt (+)4-(3)(-)Zn ∣ZnSO 4 (c 1)‖CdSO 4 (c 2)∣Cd (+)5.解:由于E (F 2/HF)>E (S 2O /SO 42-)>E (H 2O 2/H 2O)>E (MnO /Mn 2+)>E (PbO 2/Pb 2+) 28- 4- >E (Cl 2/Cl -)>E (Br 2/Br -)>E (Ag +/Ag)>E (Fe 3+/Fe 2+)>E (I 2/I -) 故氧化能力顺序为F 2 >S 2O > H 2O 2> MnO >PbO 2>Cl 2 >Br 2 > Ag +>Fe 3+>I 2。
《无机化学》学习笔记四第四章氧化还原反应与应用电化学1.了解氧化数的概念,初步会用氧化数法和离子电子法配平氧化还原反应式。
2.了解原电池的构成及表示方法。
熟悉氧化还原平衡和理解电极电势的概念,能通过计算说明分压、浓度(含酸度)对电极电势的影响。
3.会用电极电势来判断氧化剂(或还原剂)的相对强弱,计算原电池的电动势。
会用∆r G m、E判断氧化还原反应进行的方向。
4.熟悉元素的标准电极电势图的应用。
知识点:1.氧化还原反应参加反应的物质之间有电子转移的化学反应−−称为氧化还原反应。
电化学是研究化学能与电能之间相互转换的一门科学,这些转换也是通过氧化还原反应实现的。
氧化还原反应中的电子转移包括电子得失或电子偏移。
2.氧化数1970年国际纯粹和应用化学联合会(IUPAC)定义,元素的氧化数是元素的一个原子的形式荷电数,这个荷电数可由假设把每个键中的电子指定给电负性较大的原子而求得。
氧化数可以是正数、负数、整数、分数、零。
3.氧化还原的概念一个氧化还原反应包含氧化和还原两个半反应(两个过程)。
氧化数升高的过程叫氧化,氧化数降低的过程叫还原。
氧化数升高的物质被氧化,氧化数降低的物质被还原。
氧化数升高的物质叫还原剂,氧化数降低的物质叫氧化剂。
在一个氧化还原反应中,氧化和还原两个过程总是同时发生,4.氧化还原电对同种元素的不同氧化数的两种物质均可构成一个氧化还原电对,简称电对。
电对的写法:高氧化数(态)物质在前,低氧化数(态)物质在后,中间划一左斜线。
如:Cu2+/Cu,Cr2O72-/Cr3+,Fe3+/Fe2+,Fe2+/Fe。
高氧化数(态)物质叫氧化型物质,低氧化数(态)物质叫还原型物质。
5.氧化还原反应方程式的配平用氧化数法和离子电子法配平氧化还原反应方程式。
6.原电池一种把化学能转变成电能的装置。
7.原电池符号用原电池符号表示原电池。
原电池符号写法的一些规定: 1.负极写在左边,并注明(-);正极写在右边,并注明(+);盐桥在中间,用“||”表示;用“|”表示相与相之间的界面。