大学无机化学第七章氧化还原反应电化学基础课件
- 格式:ppt
- 大小:2.36 MB
- 文档页数:108



![[工学]07第七章 氧化还原反应 电化学基础](https://uimg.taocdn.com/df19b60427d3240c8447efcb.webp)



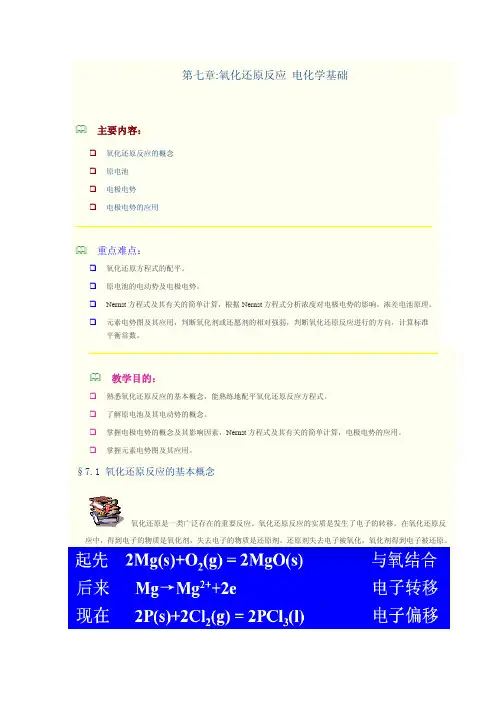
第七章:氧化还原反应 电化学基础主要内容:氧化还原反应的概念原电池 电极电势电极电势的应用重点难点:氧化还原方程式的配平。
原电池的电动势及电极电势。
Nernst 方程式及其有关的简单计算,根据Nernst 方程式分析浓度对电极电势的影响。
浓差电池原理。
元素电势图及其应用,判断氧化剂或还愿剂的相对强弱,判断氧化还原反应进行的方向,计算标准平衡常数。
教学目的:熟悉氧化还原反应的基本概念,能熟练地配平氧化还原反应方程式。
了解原电池及其电动势的概念。
掌握电极电势的概念及其影响因素,Nernst 方程式及其有关的简单计算,电极电势的应用。
掌握元素电势图及其应用。
§7.1 氧化还原反应的基本概念应中,得到电子的物质是氧化剂,失去电子的物质是还原剂。
还原剂失去电子被氧化,氧化剂得到电子被还原。
7.1.1 氧化值在氧化还原反应中,由于发生了电子转移,导致某些元素带电状态发生变化。
为了描述元素原子带电状态的不同,人们提出了氧化值的概念。
氧化值也叫做氧化数。
氧化:氧化数增加的过程;还原:氧化数降低的过程1970年,国际纯粹与应用化学联合会(IUPAC)对氧化值的定义是:氧化值是某元素一个原子的荷电数,这个荷电数是假设把每个化学键的电子指定给电负性更大的原子而求得的。
例如,在NaCl中,钠的氧化值为+1,氯的氧化值为-1。
在SO2中,硫的氧化值为+4,氧的氧化值为-2。
由此可见,氧化值是元素在化合状态时人为规定的形式电荷数。
确定氧化值的规则:★在单质中,元素的氧化值为零。
★在单原子离子中,元素的氧化值等于离子所带的电荷数。
★在大多数化合物中,氢的氧化值为+1,只有在活泼金属的氢化物(如NaH,CaH2)中,氢的氧化值为-1。
★通常,在化合物中氧的氧化值为-2;但在过氧化物(如H2O2,Na2O2,BaO2)中氧的氧化值为-1;而在OF2和O2F2中,氧的氧化值分别为+2和+1。
★在所有氟化物中,氟的氧化值为-1。


