大学无机化学第7章 氧化还原反应 电化学基础(大连理工版)
- 格式:ppt
- 大小:2.01 MB
- 文档页数:69

无机化学课程教学大纲课程名称:无机化学英文名称:Inorganic Chemistry课程编号:x2030471学时数:56其中实践学时数:0 课外学时数:0学分数:3.5适用专业:化学工程一、课程简介本课程是化学工程专业学生的专业基础课。
本课程讲授了化学反应原理、物质结构的基础理论、元素、单质及无机化合物的基本知识;是后续化学课程及相关专业课程学习的基础。
通过对本课程的学习,学生掌握化学反应原理、物质结构的基础理论、元素、单质及化合物的基本知识;培养学生自学能力,使之具有自学无机化学书刊的能力;培养学生学以致用的能力,使之具有解决一般无机化学问题的能力。
二、课程目标与毕业要求关系表三、课程教学内容、基本要求、重点和难点(一)气体及热化学基础1.要求学生熟练掌握理想气体状态方程式及其应用、气体分压定律及其应用、盖斯定律及其应用;了解分压、体系、环境、状态、功、热及热力学能等概念;理解热力学第一定律,理解焓、焓变的概念,掌握状态函数和标准摩尔生成焓的概念。
2.重点:状态函数的概念及特点,标准生成焓的概念,理想气体状态方程式和分压定律的应用,运用盖斯定律和标准生成焓计算反应热。
3.难点:状态函数、焓及标准生成焓的理解。
(二)化学反应速率和化学平衡1.要求学生了解化学反应速率,基元反应和反应级数的概念,理解浓度对反应速率的影响和温度对反应速率的影响,熟练掌握质量作用定律,了解速率理论,并能用活化能和活化分子的概念说明浓度、温度和催化剂对反应速率的影响,了解影响反应速率的因素。
要求学生理解可逆反应与化学平衡的概念,掌握标准平衡常数ΘK 及其应用,掌握化学平衡的移动的规律,掌握热力学第二定律及热力学第三定律,掌握有关化学平衡组成的计算。
要求学生熟练掌握标准摩尔反应焓变、标准摩尔反应熵变和标准摩尔反应吉布斯函数变的关系,熟练掌握ΘK 与Θ∆m r G 的关系,熟练掌握Θ∆mr G 和m r G ∆的计算方法,熟练掌握转变温度的计算方法,熟练掌握吉布斯函数判据,熟练掌握通过计算判断反应方向和反应程度的方法。


大连理工大学2024年硕士研究生入学考试大纲科目代码:630 科目名称:无机化学及无机化学实验具体复习大纲如下:一、气体和溶液1、理想气体的概念、理想气体状态方程、理想气体状态方程的应用.2、混合气体中组分气体、分压的概念,分压定律、分体积定律.3、真实气体与理想气体的差别.4、液体的蒸发及饱和蒸汽压.5、稀溶液的依数性.二、热化学1、系统、环境、相、热、功、热力学能和焓等概念.2、热力学第一定律.3、热化学方程式、化学反应的标准摩尔焓变(Δr H mӨ).4、物质的标准摩尔生成焓(Δf H mӨ)、物质的标准摩尔燃烧焓(Δc H mӨ).5、Hess定律及有关计算.三、化学反应速率1、化学反应速率、(基)元反应、复合反应等概念.2、反应速率方程、速率系数、反应级数的确定.3、活化分子、活化能等概念、阿伦尼乌斯方程.4、用碰撞理论和活化络合物理论说明浓度、温度和催化剂对反应速率的影响.四、化学平衡熵和Gibbs函数1、化学平衡、标准平衡常数、平衡组成的计算、多重平衡规则.2、反应商判据、Le Chaterlier原理.3、浓度、压力、温度对化学平衡移动的影响及相关计算.4、熵的概念、吉布斯函数的概念,物质的标准摩尔熵S mӨ、物质的标准摩尔生成Gibbs函数、反应的Δr S mӨ和Δr G mӨ的简单计算,Δr G mӨ与Δr H mӨ和Δr S mӨ的关系、Δr G mӨ与KӨ的关系.5、介绍反应的Δr G m,用Δr G m和Δr G mӨ判断反应进行的方向和程度.五、酸碱平衡1、酸碱质子理论、水的解离平衡、水的离子积常数、常见酸碱指示剂的变色范围.2、强酸、强碱溶液有关离子浓度和pH的计算.3、一元(多元)弱酸(碱)的解离平衡、解离常数和平衡组成的计算.4、一元弱酸强碱盐和一元强酸弱碱盐的水解平衡、水解常数和平衡组成的计算.5、多元弱酸强碱盐的分步水解及其平衡组成的计算、酸式盐溶液pH的近似计算.6、同离子效应、缓冲溶液、缓冲能力、缓冲溶液pH的计算.7、酸碱电子理论、配合物的基本概念、配合物的命名、配合物的不稳定常数和稳定常数、配体过量时配位平衡组成的计算、酸碱反应与配合反应共存时溶液平衡组成的计算.六、沉淀-溶解平衡1、难溶电解质的沉淀-溶解平衡、标准溶度积常数、标准溶度积常数与溶解度之间的关系和有关计算.2、溶度积规则、用溶度积规则判断沉淀的生成和溶解.3、pH对难溶金属氢氧化物沉淀-溶解平衡的影响及有关计算、沉淀的配位溶解及其简单计算.4、分步沉淀和两种沉淀间的转化及有关计算.七、氧化还原反应电化学基础1、氧化还原反应的基本概念、氧化反应方程式的配平.2、原电池的基本概念、电池电动势的概念.3、电极电势的概念及其影响因素、Nernst方程式及其相关计算、电极电势的应用.4、元素电势图及其应用.八、原子结构和元素周期律1、氢原子光谱、Bohr原子结构理论、电子的波粒二象性、量子化和能级、原子轨道、概率密度、概率、电子云.2、四个量子数的名称、符号、取值和意义.3、s、p、d原子轨道与电子云的形状和空间伸展方向.4、多电子原子轨道能级图和核外电子排布的规律、写出常见元素原子的核外电子排布、根据核外电子排布确定它们在周期表中的位置.5、周期表中元素的分区、结构特征.6、原子半径、电离能、电子亲和能和电负性的变化规律.九、分子结构1、化学键的分类、共价键价键理论的基本要点、共价键的特征和类型.2、杂化轨道理论的概念和类型、用杂化轨道理论解释简单分子和离子的几何构型.3、价层电子对互斥理论的要点、用价层电子对互斥理论推测简单分子或离子的几何构型.4、分子轨道的概念、第二周期同核双原子分子的能级图、电子在分子轨道中的分布、推测第二周期同核双原子分子(离子)的磁性和稳定性(键级).5、键级、键能、键长、键角等概念.十、晶体结构1、晶体的类型、特征和组成晶体的微粒间的作用力.2、金属晶体的三种密堆积结构及其特征、金属键的形成和特征.3、三种典型离子晶体的结构特征、晶格能的概念、离子电荷和半径对晶格能的影响、晶格能对离子化合物熔点、硬度的影响、晶格能的热化学计算方法.4、离子极化及其对键型、晶格类型、溶解度、熔点、颜色的影响.5、键的极性和分子的极性、分子的偶极矩和变形性及其变化规律、分子间力的产生及其对物质性质的影响.6、氢键形成的条件、特点及对物质某些性质的影响.7、过渡性晶体结构(如:层状晶体).十一、配合物结构1、配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系、内轨型和外轨型配合物的概念、中心离子价电子排布与配离子稳定性和磁性的关系.2、配合物晶体场理论的基本要点、八面体场中d电子的分布、高自旋和低自旋配合物、推测配合物的稳定性和磁性、配合物的颜色与d-d跃迁的关系.十二、s区元素1、碱金属和碱土金属的通性、单质的重要物理性质和化学性质.2、碱金属和碱土金属的重要氢化物、氧化物、过氧化物、超氧化物的生成和基本性质.3、碱金属和碱土金属氢氧化物碱性强弱的变化规律、重要盐类的溶解性和稳定性.4、锂和铍的特殊性、对角线规则.十三、p区元素(一)1、硼族元素的通性、缺电子原子和缺电子化合物的概念、乙硼烷的结构和重要性质、硼酸的晶体结构和性质、硼砂的结构和性质、硼的卤化物的结构和水解.2、铝及其重要化合物的性质.3、碳族元素的通性、碳单质的结构、碳的氧化物、碳酸及其盐的重要性质、用离子极化理论说明碳酸盐的热稳定性.4、硅单质、硅的氢化物、硅的氧化物、硅酸及其盐的重要性质.5、硅的卤化物的结构和水解.6、锡和铅的氧化物和氢氧化物的酸碱性及其变化规律、Sn(Ⅱ)的还原性、Pb(Ⅳ)的氧化性、锡和铅硫化物的颜色、生成和溶解性.十四、p区元素(二)1、氮族元素的通性、氮分子的结构和特殊稳定性、铵盐的性质、氮的氧化物的结构、硝酸的结构和性质、硝酸盐和亚硝酸盐的性质.2、磷的单质、氢化物、氧化物、卤化物的结构和性质.3、磷酸及其盐的性质、亚磷酸、次磷酸、焦磷酸、聚磷酸、聚偏磷酸的结构和性质.4、砷、锑、铋氧化物及其水合物的酸碱性及其变化规律.5、砷、锑、铋化合物氧化还原性的变化规律和重要反应.6、砷、锑、铋硫化物的颜色、生成和溶解性及砷、锑的硫代酸盐.7、氧族元素的通性、氧单质的结构和性质、过氧化氢的结构和性质及其重要反应.8、硫单质的结构和性质、硫化氢的性质、金属硫化物的溶解性、多硫化物的性质、二氧化硫和三氧化硫的结构、亚硫酸及其盐的性质、硫酸及其盐的性质、硫代硫酸盐的结构和性质、过二硫酸盐的结构和性质、焦硫酸盐和连二亚硫酸盐的性质.十五、p区元素(三)1、卤素的通性、卤素单质的制备和性质、卤化氢的制备及其性质(还原性、酸性、稳定性)的变化规律、氯的含氧酸及其盐的性质及其变化规律、溴和碘的含氧酸的基本性质.2、稀有气体的重要性质及其变化规律、稀有气体化合物及其几何构型.3、p区元素的氢化物、氧化物及其水合物性质的递变规律.4、p区元素化合物的氧化还原性递变规律、p区元素含氧酸盐的热稳定性递变规律.十六、d区元素(一)1、过渡元素的原子结构特征和通性.2、钛单质的性质和用途.3、铬单质的性质、Cr(Ⅲ)和Cr(Ⅵ)化合物的酸碱性和氧化还原性及其相互转化,杂多酸盐磷钼酸铵.4、Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质.5、Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律.6、Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律.7、铁、钴、镍的重要配合物.十七、d区元素(二)1、铜族元素的通性.2、铜的氧化物、氢氧化物、重要铜盐的性质.3、Cu(Ⅰ)和Cu(Ⅱ)相互转化、铜的重要配合物、水溶液中Cu2+的重要反应.4、银的氧化物和氢氧化物的性质、银的重要配合物、水溶液中Ag+的重要反应.5、锌族元素的通性、氢氧化锌的性质、水溶液中Zn2+的重要反应、锌的重要配合物.6、镉的重要化合物的性质.7、汞的重要化合物的性质、Hg(Ⅰ)和Hg(Ⅱ)间的相互转化、水溶液中Hg2+和Hg22+的重要反应.十八、无机化学实验1.实验基本操作:加热、洗涤、过滤等无机化学实验操作。

材料综合复试大纲(复试分为三部分内容,考生可以选择其中任一部分作答。
)第一部分无机化学参考书目:《无机化学》,大连理工大学无机化学教研室编,高等教育出版社。
第三章化学动力学基础掌握活化分子和活化能的概念,并能用其说明浓度、温度、催化剂对化学反应速率的影响;掌握化学反应速率、反应速率方程、反应级数等概念;熟悉Arrhenius 方程。
第五章酸碱平衡掌握酸碱质子理论基本要点;掌握同离子效应和缓冲溶液的概念、一元强弱酸、Lewis酸碱的相关内容;掌握配位化合物的基本概念。
第六章沉淀溶解平衡掌握相关理论并解释沉淀析出的实验现象。
第七章氧化还原反应电化学基础掌握电极电势的基本概念及应用;熟悉氧化还原反应的基本概念。
第八章原子结构掌握核外电子排布的基本原理;掌握周期表中元素的分区、结构特征;熟悉原子半径、电离能、电子亲和能和电负性的变化规律。
第十章固体结构熟悉晶体的类型、特征和组成晶体的微粒间的作用力;能用相关知识点解释结构对物性的影响。
元素部分(s、p、d区元素),掌握性质递变规律。
第二部分物理学参考书目:《物理学》上、下册,东南大学等七所工科院校编,马文尉改编,高等教育出版社。
第五章静电场理解电场强度,掌握场强叠加原理,了解电荷连续分布的带电体的场强,理解电场线、电通量,掌握高斯定理,理解环路定理,了解电势,电势差及电势叠加原理。
第六章静电场中的导体与电介质了解静电场中加入导体和电解质后电场发生的变化,了解电容器的概念。
第七章恒定磁场理解磁感应强度,掌握毕奥-萨伐尔定律,理解磁感线、磁通量,掌握磁场中的高斯定理和安培环路定理;理解洛沦兹力,了解霍尔效应。
第八章电磁感应电磁场理解电动势的概念,掌握法拉第电磁感应定律,理解动生电动势、感生电动势的本质。
第十一章光学理解光的相干条件及获得相干光的基本原理和一般方法;了解光程概念以及光程差与相位差的关系,了解反射时产生半波损失的条件;了解杨氏双缝干涉的基本装置和实验规律;了解干涉条纹的分布特点及其应用;了解薄膜干涉原理在实际中的应用。

第一章气体1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:(1)气体没有固定的体积和形状。
(2)不同的气体能以任意比例相互均匀地混合。
(3)气体是最容易被压缩的一种聚集状态。
气体的密度比液体和固体的密度小很多。
2、理想气态方程:pV=nRT,其中p、V、T分别为一定量气体的体积、压力和热力学温度。
R为摩尔气体常数。
在国际单位制中,p以Pa、V以m3、T以K为单位,则R=8.314J·mol-1·K-1。
3、理想气体是一种假想的模型,它忽略了气体本身的体积和分子之间的相互作用。
对于真实气体,只有在低压高温下,分子间作用力比较小,分子间平均距离比较大,分子自身的体积与气体体积相比,完全微不足道,才能把它近似地看成理想气体。
4、理想气体混合物:当两种或两种以上的气体在同一容器中混合时,相互间不发生化学反应,分子本身的体积和它们相互间的作用力都可以忽略不计,这就是理想气体混合物。
其中每一种气体都称为该混合气体的组分气体。
5、混合气体中某组分气体对器壁所施加的压力叫做该组分气体的分压。
对于理想气体来说,某组分气体的分压力等于在相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
6、Dalton分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
7、Amage分体积定律:混合气体中组分B的分体积V B是该组分单独存在并具有与混合气体相同温度和压力时占有的体积。
8、气体分子动理论的基本要点:(1)气体是由分子组成的,分子是很小的粒子,彼此间的距离比分子的直径大许多,分子体积与气体体积相比可以略而不计。
(2)气体分子以不同的速度在各个方向上处于永恒地无规则运动之中。
(3)除了在相互碰撞时,气体分子间相互作用是很弱的,甚至是可以忽略的。
(4)气体分子相互碰撞或对器壁的碰撞都是弹性碰撞。
碰撞时总动能保持不变,没有能量损失。
(5)分子的平均动能与热力学温度成正比。
9、气体的压力是由气体分子对器壁的弹性碰撞而产生的,是“分子群”对器壁碰撞作用的统计平均的结果。

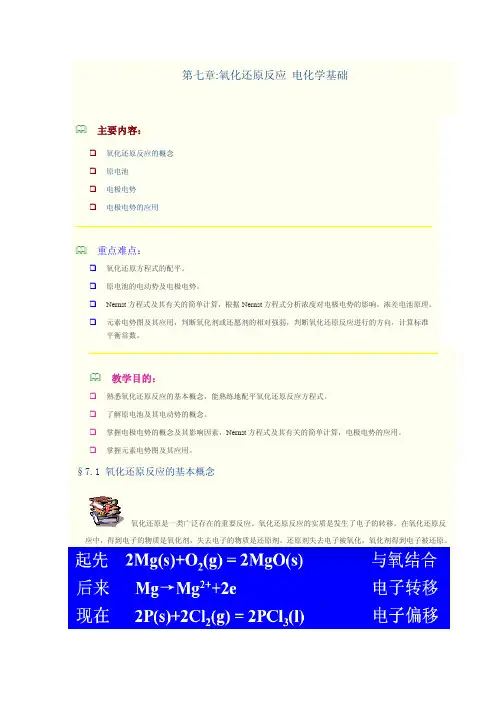
第七章:氧化还原反应 电化学基础主要内容:氧化还原反应的概念原电池 电极电势电极电势的应用重点难点:氧化还原方程式的配平。
原电池的电动势及电极电势。
Nernst 方程式及其有关的简单计算,根据Nernst 方程式分析浓度对电极电势的影响。
浓差电池原理。
元素电势图及其应用,判断氧化剂或还愿剂的相对强弱,判断氧化还原反应进行的方向,计算标准平衡常数。
教学目的:熟悉氧化还原反应的基本概念,能熟练地配平氧化还原反应方程式。
了解原电池及其电动势的概念。
掌握电极电势的概念及其影响因素,Nernst 方程式及其有关的简单计算,电极电势的应用。
掌握元素电势图及其应用。
§7.1 氧化还原反应的基本概念应中,得到电子的物质是氧化剂,失去电子的物质是还原剂。
还原剂失去电子被氧化,氧化剂得到电子被还原。
7.1.1 氧化值在氧化还原反应中,由于发生了电子转移,导致某些元素带电状态发生变化。
为了描述元素原子带电状态的不同,人们提出了氧化值的概念。
氧化值也叫做氧化数。
氧化:氧化数增加的过程;还原:氧化数降低的过程1970年,国际纯粹与应用化学联合会(IUPAC)对氧化值的定义是:氧化值是某元素一个原子的荷电数,这个荷电数是假设把每个化学键的电子指定给电负性更大的原子而求得的。
例如,在NaCl中,钠的氧化值为+1,氯的氧化值为-1。
在SO2中,硫的氧化值为+4,氧的氧化值为-2。
由此可见,氧化值是元素在化合状态时人为规定的形式电荷数。
确定氧化值的规则:★在单质中,元素的氧化值为零。
★在单原子离子中,元素的氧化值等于离子所带的电荷数。
★在大多数化合物中,氢的氧化值为+1,只有在活泼金属的氢化物(如NaH,CaH2)中,氢的氧化值为-1。
★通常,在化合物中氧的氧化值为-2;但在过氧化物(如H2O2,Na2O2,BaO2)中氧的氧化值为-1;而在OF2和O2F2中,氧的氧化值分别为+2和+1。
★在所有氟化物中,氟的氧化值为-1。


第七章 氧化还原反应和电极电势一、填空题 1,电对的标准电极电势是该电对为______极,与标准______组成的原电池的标准电动势。
2,在测定溶液的pH 时,通常采用的氢离子指示电极是______,采用的参比电极是_______。
3,K 2Cr 2O 7中Cr 3的氧化值是______,Cr 3(SO 4)中Cr 的氧化值是______。
4,Mn 2O 3中Mn 的氧化值是______,K 2MnO 4中Mn 的氧化值是______。
5,KMnO 4中Mn 的氧化值是______,MnSO 4中Mn 的氧化值是______。
6,对于氧化还原反应K 2Cr 2O 7 + 3Na 2SO 3 + 4H 2SO 4 K 2SO 4 + Cr 2(SO 4)3 + 3Na 2SO 4 + 4H 2ONa 2SO 3是______,K 2Cr 2O 7是______。
7,将两个电对组成氧化还原反应时,氧化剂应是电极电势较_______电对中的______型物质。
二、是非题1,从公式 ln =可以看出,氧化还原反应的标准平衡常数 与温度有关,但与反应物和产物的浓度或分压力无关。
2,氧化还原反应的标准平衡常数与该反应组成的原电池的标准电动势之间的关系为=RTzF ln 。
由于标准平衡常数 与反应方程式有关,因此标准电动势 也与氧化还原反应方程式有关。
3,在氧化还原反应中,两个电对的电极电势相差越大,化学反应速率就越快。
4,在O 2中,O 的氧化值和化合价均为2。
5,H 2O 2既可以做氧化剂,也可以做还原剂。
6,同一元素所形成的化合物中,通常氧化值越高,其得电子能力就越强;氧化值越低,其失去电子的趋势就越大。
7,反应 Cl 2 + 2NaOH NaClO + NaCl + H 2O 是氧化还原反应,也是歧化反应。
8,电对的电极电势越大,该电对中的氧化型物质是越强的氧化剂,而相应的还原型物质是越弱的还原剂。


《无机化学》考试大纲一考试要求1、初步掌握元素周期律,化学动力学,化学热力学,近代物质结构,化学平衡以及基础电化学等基本原理。
2、利用无机化学原理去掌握有关无机化学中元素和化合物的基本知识,并具有对一般无机化学问题进行理论分析和计算的能力。
二考试内容第一章气体(1)掌握理想气体状态方程式及其应用。
(2)掌握道尔顿分压定律。
第二章热化学(1)热力学第一定律及相关概念(2)化学反应热效应,等容化学反应热和等压反应热的概念及关系。
(3)热化学方程式;反应热、反应焓变的计算;盖斯定律及有关计算;第三章化学动力学基础(1)化学反应速率、催化剂、反应机理等相关概念。
(2)各种动力学方程:速率方程和Arrhenius方程。
第四章化学平衡熵和Gibbs函数(1)化学反应的可逆性,掌握化学平衡和平衡常数的概念。
(2)标准平衡常数和吉布斯自由能变,反应商、标准平衡常数及其有关计算;利用反应商和标准平衡常数判断反应进行的方向。
(3)浓度、压力、温度对化学平衡移动的影响;(4)吉布斯自由能和化学反应的方向,吉布斯-姆霍兹公式:ΔG=ΔH-TΔS公式。
了解从热力学和动力学等方面来选择合理的生产条件。
第五章酸碱平衡(1)酸碱质子理论。
(2)掌握一元弱酸、弱碱在水溶液中的质子转移平衡和近似计算;熟悉多元酸、多元碱、两性物质的质子转移平衡和近似计算。
(3)掌握同离子效应的概念。
(4)掌握缓冲溶液的作用和组成、缓冲作用机制、能熟悉地计算缓冲溶液pH值。
(5)掌握配位化合物的基本概念,组成,命名,分类。
(6)掌握配位平衡,配合物的稳定常数和不稳定常数的概念以及配合物的有关计算。
第六章沉淀溶解平衡(1)熟悉难溶电解质溶液的沉淀溶解平衡、掌握溶度积原理与溶解度的关系。
(2)掌握溶度积规则,能用溶度积规则判断沉淀的生成和沉淀的溶解,了解两种沉淀间的转化、分步沉淀。
(3)熟悉pH值对难溶金属氢氧化物和金属硫化物沉淀溶解平衡的影响及有关计算。
大连理工大学《无机化学》自测练习题第一章气体一、判断1、氨的沸点是-33℃,可将100kPa、-20℃时的氨气看作理想气体。
... ...... ...()2、在相同温度和压力下,气体的物质的量与它的体积成反比。
... ..... ... ..........()3、质量相同的N2和O2,在同温同压下,它们的体积比为7:8。
..... ... ..........()4、在一定温度和压力下,混合气体中某组分的摩尔分数与体积分数不相等。
... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ... ......()5、混合气体中,某组分气体的分体积是指与混合气体具有相同温度、相同压力时该组分气体单独存在所占有的体积。
... ... ... ... ... ... ... ... ... ... ... ......................()二、单选题1、理想气体状态方程用于真实气体的条件是. ... ... ... . ... ... ... ... ... ... ...............()(A)低温、高压(B)高温、高压(C)低温、低压(D)高温、低压。
2、在温度相同、容积相等的两个密闭容器中,分别充有气体A和B。
若气体A的质量为气体B的二倍,气体A的相对分子质量为气体B的0.5倍,则p(A):p(B) =................................................................................................()(A) 1/4;(B) 1/2;(C) 2;(D) 4。
3、对下列各种烃来说,使其在充有足量氧的密闭容器中完全燃烧,生成CO2和H2O。
《无机化学H1》课程教学大纲课程代码:080331029课程英文名称:Inorganic chemistry (H1)课程总学时:56 讲课:40 实验:16 上机:0适用专业:应用化学大纲编写(修订)时间:2017.7一、大纲使用说明(一)课程的地位及教学目标无机化学课程是应用化学专业的专业基础必修课。
化学科学中早期的最重要的概念和规律多数是在无机化学基础上发现的。
无机化学在化学科学中处于基础和母体地位,其它学科都是由此分化出去并成长起来的。
本课程是从化学反应的基本原理出发,学习无机化学的中心内容元素部分,并进一步了解物质结构基本知识。
培养学生具有初步的分析问题和解决问题的能力并为后续专业课打下必要的化学基础。
(二)知识、能力及技能方面的基本要求通过以讲授为主的教学环节与引导学生课后自学的有机结合,使学生掌握有关化学反应原理和物质的结构以及元素周期表中各区元素的基本特征,并掌握基本的无机化学实验方法,并具有独立做无机化学实验能力。
(三)实施说明突出重点,逐步深入。
在讲授课本内容的同时适时补充本学科的新内容。
(四)对先修课的要求在讲授本课前,学生必须具有“高等数学”方面的知识。
(五)对习题课、实验环节的要求1.在课堂知识要点讲授的基础上,适当安排习题课,例题的选择以培养学生消化和巩固所学知识。
课后作业要少而精,内容可以多样化,可以涉及基本概念、基本理论、计算方法和技巧,使学生提高分析问题、解决问题能力。
对作业中的重点、难点,课上应做必要的提示,并可适当安排课内讲评作业。
学生应独立、按时完成课外习题和作业,作业的完成情况应作为评定课程成绩的一部分。
2.开设无机实验课,学生要完成大纲中规定的必修实验,通过实验环节,学生掌握本课程的基本实验方法,获得实验操作的基本训练,提高学生对所学知识的感性认识和动手能力。
实验成绩作为评定课程成绩的一部分。
具体要求参见相应的实验教学大纲。
(六)课程考核方式1.考核方式:考试2.考核目标:主要考核学生对无机化学的基本知识、基本概念、基本理论理解及其应用。
第7章氧化还原反应电化学基础第7章氧化还原反应电化学基础⼀、单选题1. 下列电对中,Eθ值最⼩的是:A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag2. Eθ(Cu2+/Cu+)=0.158V,Eθ(Cu+/Cu)=0.522V,则反应2 Cu+Cu2+ + Cu的Kθ为:A: 6.93×10-7;B: 1.98×1012;C:1.4×106; D: 4.8×10-133. 已知Eθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是:A: Cl2+2e- = 2Cl- B: 2 Cl- - 2e- = Cl2C: 1/2 Cl2+e- = Cl- D: 都是4. 下列都是常见的氧化剂,其中氧化能⼒与溶液pH 值的⼤⼩⽆关的是:A: K2Cr2O7 B: PbO2C: O2 D: FeCl35. 下列电极反应中,有关离⼦浓度减⼩时,电极电势增⼤的是:A: Sn4+ + 2e- = Sn2+B: Cl2+2e- = 2Cl-C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H26. 为防⽌配制的SnCl2 溶液中Sn2+被完全氧化,最好的⽅法是:A: 加⼊Sn 粒B:. 加Fe 屑C: 通⼊H2D: 均可7. 反应Zn (s) + 2H+→ Zn 2++ H2 (g)的平衡常数是多少?A: 2×10-33 B: 1×10-13 C: 7×10-12 D: 5×10 26⼆、是⾮题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1. 在氧化还原反应中,如果两个电对的电极电势相差越⼤,反应就进⾏得越快2.由于Eθ(Cu+/Cu)= +0.52V , Eθ(I2/ I-)= +0.536V , 故Cu+ 和I2不能发⽣氧化还原反应。