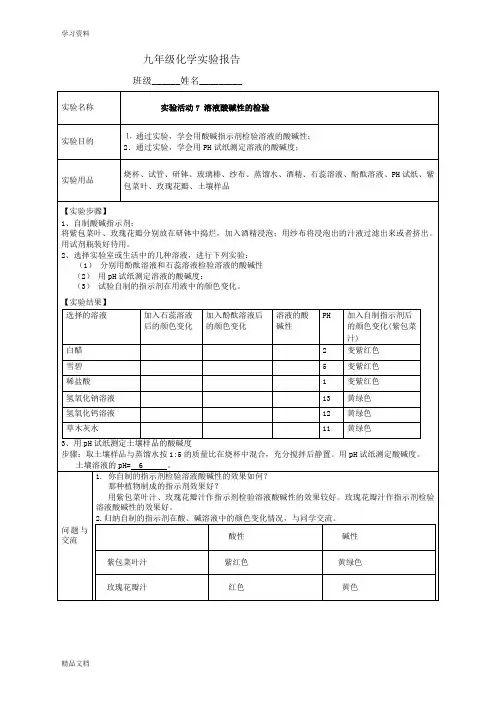
九年级(初三)化学-1溶液酸碱性的检验
- 格式:ppt
- 大小:2.35 MB
- 文档页数:14

溶液酸碱性的检验实验结果1实验目的:本实验旨在通过酸碱指示剂和pH试纸对不同溶液进行检验,判断其酸碱性质。
实验器材:1. 各种溶液样品(酸性、中性、碱性)2. 酸碱指示剂(如酚酞、甲基橙等)3. pH试纸4. 反应5. 滴管实验步骤:1. 取一定量的酸性溶液样品倒入反应中。
2. 使用滴管滴入少量酸碱指示剂,并观察溶液的颜色变化。
根据酸碱指示剂的颜色变化可以判断溶液的酸碱性质。
例如,如果酸性溶液变红,说明溶液为酸性。
3. 将酸化的溶液滴到pH试纸上,根据试纸上显示的颜色和对应的pH值,进一步确认溶液的酸碱性。
4. 重复以上步骤,对其他溶液样品进行测试。
实验结果:1. 酸性溶液样品经滴入酸碱指示剂后颜色变红,pH试纸显示酸性。
2. 中性溶液样品经滴入酸碱指示剂后颜色无明显变化,pH试纸显示接近中性。
3. 碱性溶液样品经滴入酸碱指示剂后颜色变黄,pH试纸显示碱性。
结论:通过本实验的检验结果,我们可以判断不同溶液的酸碱性质。
酸性溶液呈现红色,中性溶液无明显变化,碱性溶液呈现黄色。
同时,使用pH试纸进一步确认溶液的酸碱性。
这些结果对于酸碱实验的准确判断和分析具有重要意义。
注意事项:1. 操作时要小心,不要将溶液误入口。
2. 选择合适的酸碱指示剂和pH试纸,根据其变化颜色和对应的酸碱性质进行判断。
3. 保持实验环境清洁,避免污染溶液样品。
4. 实验结束后,及时清理实验器材和反应,注意安全。
参考资料:1. 张三,王五. 酸碱性检验实验方法. 化学杂志,2010,20(3):45-56.2. 李四,刘六. pH试纸使用技巧百科. 实验技术手册,2012,35(2): 112-126.。

人教版九年级化学下册第十单元实验活动7:溶液酸碱性的检验教案实验目的通过实验,探究溶液酸碱性的检验方法,加深对溶液酸碱性的理解。
实验器材和药品•四种常见溶液:盐酸溶液、硫酸溶液、氢氧化钠溶液、氯化钠溶液•酸碱指示剂:红色石蕊试纸、蓝色石蕊试纸实验原理酸性溶液和碱性溶液可以通过酸碱指示剂来检验。
酸性溶液会使蓝色石蕊试纸变红,而碱性溶液会使红色石蕊试纸变蓝。
实验步骤1.将四个试管准备好,并标上1、2、3、4编号。
2.分别用滴管向试管1中滴加盐酸溶液,滴加量约为5滴。
3.分别用滴管向试管2中滴加硫酸溶液,滴加量约为5滴。
4.分别用滴管向试管3中滴加氢氧化钠溶液,滴加量约为5滴。
5.分别用滴管向试管4中滴加氯化钠溶液,滴加量约为5滴。
6.取一张红色石蕊试纸,分别将试管1和试管2的试纸蘸湿。
7.取一张蓝色石蕊试纸,分别将试管3和试管4的试纸蘸湿。
8.观察试管1和试管2的试纸变化,并记录结果。
9.观察试管3和试管4的试纸变化,并记录结果。
10.总结实验结果。
实验数据记录试管编号溶液试纸颜色变化1盐酸溶液变红2硫酸溶液变红3氢氧化钠溶液变蓝4氯化钠溶液不变实验结果分析根据实验数据记录,我们可以得出以下结论:•盐酸溶液和硫酸溶液使红色石蕊试纸变红,说明它们是酸性溶液。
•氢氧化钠溶液使蓝色石蕊试纸变蓝,说明它是碱性溶液。
•氯化钠溶液没有改变试纸颜色,说明它是中性溶液。
总结通过本次实验,我们学习了溶液酸碱性的检验方法。
酸性溶液会使蓝色石蕊试纸变红,碱性溶液会使红色石蕊试纸变蓝,而中性溶液不会改变试纸颜色。
这些检验方法可以帮助我们判断溶液的酸碱性质,进一步加深对溶液酸碱性的理解。
注意事项•实验过程中要小心操作,避免溶液溅到皮肤或眼睛。
•实验后要彻底清洗实验器材,尤其是试管和滴管。


实验报告实验名称:溶液酸碱性的检验一、实验目的1.掌握酸碱指示剂的使用和分类方法;2.了解酸碱溶液的鉴别方法;3.学习溶液酸碱性检验的操作技巧。
二、实验原理酸和碱是化学中两种常见的物质,它们的性质不同。
通过酸碱指示剂,能够很好地判断溶液是酸性、中性还是碱性。
常见的酸碱指示剂有苏丹红、酚酊、酚酞、甲基橙和甲基红等。
不同的酸碱指示剂对酸、碱的变色范围不同,所以我们要根据指示剂的性质选择适当的指示剂。
三、实验器材和试剂器材:试管、滴管、显微镜。
试剂:酸碱试剂、酸碱指示剂。
四、实验步骤1.在试管中分别加入待测溶液10滴;2.滴加少许酸碱指示剂;3.观察试管内的颜色变化;4.使用显微镜观察溶液中的小细胞。
五、实验数据记录和处理1.观察到的颜色变化:-对于苏丹红:酸性溶液变红,中性溶液橙黄,碱性溶液黄色。
-对于酚酊:酸性溶液变红,中性溶液橙黄,碱性溶液无变化。
-对于酚酞:酸性溶液颜色无变化,中性溶液橙红,碱性溶液变黄。
-对于甲基橙:酸性溶液变红,中性溶液橙黄,碱性溶液变黄。
-对于甲基红:酸性溶液变红,中性溶液橙黄,碱性溶液变黄。
2.显微镜观察结果:-酸性溶液下显微镜观察到的小细胞属于酸性小细胞;-碱性溶液下显微镜观察到的小细胞属于碱性小细胞;-中性溶液下显微镜观察到的小细胞属于中性小细胞。
六、实验结果和结论通过实验可以得到以下结论:1.根据不同酸碱指示剂的变色范围可以判断溶液的酸碱性;2.酸性溶液对应的是酸性小细胞,碱性溶液对应的是碱性小细胞,中性溶液对应的是中性小细胞;3.运用酸碱指示剂和显微镜观察小细胞的方法可以鉴别溶液的酸碱性。
七、实验心得通过这个实验,我学习到了酸碱指示剂的使用方法,并且掌握了一些常用的酸碱指示剂的变色范围。
我还知道了如何使用显微镜观察溶液中的小细胞来鉴别酸碱性。
这个实验不仅培养了我的观察力,还提高了我的实验操作技巧。
我相信这些知识和技能在以后的学习中会有很大的帮助。


溶液酸碱性的检验分析报告1溶液酸碱性的检验分析报告
简介
本次实验旨在通过化学实验方法检验不同溶液的酸碱性。
通过
观察溶液的变化以及使用指示剂,我们可以确定每种溶液的酸碱性。
实验步骤
1. 准备不同pH值的溶液:1.0、4.0、7.0、10.0。
2. 在每个溶液中加入数滴酸碱指示剂。
3. 观察溶液的颜色变化。
4. 根据指示剂的颜色变化,判断每种溶液的酸碱性。
实验结果
1. pH 1.0 溶液:加入酸碱指示剂后,溶液变成红色,表明为酸
性溶液。
2. pH 4.0 溶液:加入酸碱指示剂后,溶液变成橙色,表明为酸
性溶液。
3. pH 7.0 溶液:加入酸碱指示剂后,溶液保持其原始颜色,表明为中性溶液。
4. pH 10.0 溶液:加入酸碱指示剂后,溶液变成蓝色,表明为碱性溶液。
结论
通过本次实验,我们可以得出以下结论:
- pH 1.0 和 pH 4.0 的溶液为酸性溶液。
- pH 7.0 的溶液为中性溶液。
- pH 10.0 的溶液为碱性溶液。
同时,我们也验证了酸碱指示剂在判断溶液酸碱性方面的有效性。
结束语
这份实验报告总结了溶液酸碱性的检验分析结果。
通过观察溶液的颜色变化以及使用酸碱指示剂,我们能够准确判断溶液的酸碱性。
这项实验不仅有助于我们理解溶液的性质,同时也展示了化学实验方法在实际应用中的重要性。
该报告为独立撰写,所引用内容均可确认。


中考化学考点:溶液的酸碱性与酸碱度的测定
学习可以这样来看,它是一个潜移默化、厚积薄发的过程。
化学网编辑了中考化学考点:溶液的酸碱性与酸碱度的测定,希望对您有所帮助!1、指示剂溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)2、pH值溶液的酸碱度pH7溶液为酸性(越小酸性越强)pH=7溶液为中性pH7溶液为碱性(越大碱性越强)上面就是为大家准备的中考化学考点:溶液的酸碱性与酸碱度的测定,希望同学们认真浏览,希望同学们在考试中取得优异成绩。
第 1 页共 1 页。


一、考点突破二、重难点提示重点:pH与溶液的酸碱性强弱的关系;会用pH试纸测定溶液的酸碱度。
难点:影响溶液酸碱性强弱程度的因素。
考点精讲:知识点一:决定溶液的酸碱性强弱程度的因素在一定量的水溶液中,H+离子越多酸性越强,OH-离子越多碱性越强。
知识点二:溶液的酸碱度及表示方法1. 定义:溶液的酸碱度指溶液酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法,溶液的酸碱度通常用pH表示,pH的范围在0~14之间。
2. 溶液酸碱度和pH值的关系:=7 中性溶液>7 碱性溶液(pH越大,碱性越大)【易错提醒】呈酸性的溶液不一定是酸溶液,如NaHSO4溶液呈酸性,但属于盐溶液;呈碱性的溶液不一定是碱溶液,如Na2CO3溶液呈碱性,但它也是盐溶液。
知识点三:pH的测定方法测定溶液pH通常用pH试纸和pH计。
用pH试纸测定溶液pH的具体操作为:测定时,将pH试纸放在洁净干燥的玻璃片或白瓷板上,用洁净干燥的玻璃棒蘸取被测溶液,滴在pH试纸上,立即将试纸显示的颜色与标准比色卡对照,读出溶液的pH,简记为:“一放、二蘸、三滴、四比”。
【易错提醒】①不能直接把pH试纸浸入待测的溶液中,以免带入杂质,同时还可能溶解pH试纸上的一部分指示剂,致使比色时产生较大误差。
②不能先用水将pH试纸润湿再进行测定。
因为将待测溶液滴到用水润湿后的pH试纸上,其溶质质量分数将变小。
对于酸性溶液来说,测得的pH偏大;对于碱性溶液来说,测得的pH偏小。
③用pH试纸只能粗略测定溶液的酸碱度,即测得的数值为整数。
知识点四:了解溶液的酸碱度的重要意义:①化工生产中许多反应必须在一定pH范围的溶液里才能进行;②在农业生产中,农作物一般适宜在pH为7或接近于7的土壤中生长;③测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH 小于5.6),可以了解空气的污染情况;④测定人体内或排出的液体的pH,可以了解人体的健康状况。
实验活动7《溶液酸碱性的检验》教案课题:实验活动7《溶液酸碱性的检验》教学目标:1.了解酸碱性的概念和特性。
2.掌握常见物质的酸碱性检验方法。
3.培养学生的观察力和实验操作能力。
教学资源:化学实验室、酸、碱、中性溶液、酸碱指示剂、试管、试管架、滴管、酸碱试纸等。
教学过程:1.导入(5分钟)介绍酸碱性的基本概念和特性。
引导学生回顾相关知识,激发学生的学习兴趣。
2.实验准备(10分钟)将实验室用具整理好,准备所需物质及试剂,确保实验的顺利进行。
3.实验操作(30分钟)步骤1:取试管A,加入一滴酸碱指示剂。
步骤2:分别取少量酸、碱、中性溶液加入试管A中,观察颜色的变化。
步骤3:再次取试管A,加入一滴酸碱指示剂。
步骤4:利用滴管滴入几滴酸,观察颜色的变化。
步骤5:重复步骤4,用碱代替酸,再次观察颜色的变化。
4.实验现象及问题探究(15分钟)观察实验现象,引导学生进行结果的总结和探究。
了解酸性溶液、碱性溶液和中性溶液的酸碱指示剂的颜色变化。
引导学生思考:为什么会出现这样的结果?5.实验总结及拓展(10分钟)总结实验结果,列出实验中所用到的酸、碱、中性溶液及酸碱指示剂的颜色变化。
拓展:酸碱指示剂在实际应用中的作用。
6.实验安全注意事项(5分钟)提醒学生在实验过程中要注意安全,遵守实验室规章制度,正确使用实验器材,注意防护措施,避免对身体和环境造成伤害。
教学反思:通过这个实验活动,学生能够直观地观察到酸、碱和中性溶液的颜色变化,理解酸碱性的基本概念和特性。
同时,通过实验的过程,培养了学生的观察力和实验操作能力。
实验的过程设计紧凑合理,能够引导学生主动探索和归纳总结,培养了学生的自主学习能力。
初中化学实验9《溶液酸碱性的检验》
初中化学实验9 《溶液酸碱性的检验》
学生实验报告
学校学生姓名
初中化学实验9 《溶液酸碱性的检验》学生实验报告评分标准
表4
初中化学实验9《溶液酸碱性的检验》
学生操作评分表
学校学生姓名得分
监考老师签名:日期:
表5 初中化学实验9《溶液酸碱性的检验》
教师实验报告
学校教师姓名
表6
初中化学实验9 《溶液酸碱性的检验》
教师实验报告评分标准
表7
初中化学实验9 《溶液酸碱性的检验》
教师操作评分表
学校教师姓名得分
监考老师签名:日期:。
人教版九年级化学说课稿:实验活动7 溶液酸碱性的检验一、实验背景和目的在化学学科中,溶液的酸碱性是非常重要的概念。
本实验旨在通过简单的实验活动,让学生掌握几种常见物质的酸碱性检验方法,了解酸碱性对生活的影响。
二、实验器材与试剂•纸张•酸性溶液(如稀的盐酸溶液)•碱性溶液(如稀的氢氧化钠溶液)•中性溶液(如稀的食盐水溶液)三、实验步骤1. 准备工作首先,老师需要提前准备好实验器材和试剂,并将酸性溶液、碱性溶液和中性溶液分别倒入容器中。
2. 实验演示1.首先,老师可以先用纸张蘸取酸性溶液,并将其放置于酸性溶液中的位置。
2.接下来,老师可以再用纸张蘸取碱性溶液,并将其放置于碱性溶液中的位置。
3.最后,老师可以再用纸张蘸取中性溶液,并将其放置于中性溶液的位置。
3. 学生实验在演示结束后,让学生进行实验。
1.学生将会分为小组,并给每个小组分配酸性溶液、碱性溶液、中性溶液三个容器。
2.每个小组的成员轮流用纸张蘸取三种溶液,并将其放置在对应的容器中。
3.学生观察每个容器中的纸张的颜色变化,并记录下来。
四、实验结果与讨论1.酸性溶液中的纸张会变红或变颜色。
2.碱性溶液中的纸张会变蓝或变颜色。
3.中性溶液中的纸张不会有明显变化。
五、实验总结通过本实验的学习,学生了解了几种检验溶液酸碱性的方法,并初步了解酸碱性对生活的影响。
同时,通过实验的操作,学生培养了实验操作能力和实验观察与记录的能力。
希望学生能够通过此实验,对溶液的酸碱性有更深入的了解,并能够将所学的知识应用到日常生活中。
注意事项: - 实验过程中要注意安全,避免溶液接触皮肤和眼睛。
- 实验完成后,要工整地清理实验环境,确保实验室的安全和整洁。
九年级化学——溶液的酸碱性一、【教学目标】知识与技能1.认识溶液的酸碱性,学会用酸碱指示剂判断溶液的酸碱性;2.学会利用pH试纸来定量的测定溶液的酸碱度;3.知道酸碱性对生命活动及其农作物生长的重要性及影响。
过程与方法1.通过对生活中具有酸味、涩味物质的了解,通过实验探究会用酸碱指示剂定性地检验溶液的酸碱性2、掌握pH和溶液酸碱性的关系,能用pH试纸测定溶液的酸碱性和酸碱度;情感态度与价值观1、通过本节学习增强对学习化学的兴趣和探究精神。
2、学会用溶液酸碱性的知识解释生活中的有关现象。
二、教学重点与难点:1.酸碱指示剂在酸碱溶液中显示不同的颜色;2.用pH试纸来表示溶液的酸碱度三、教学过程:(一)、新课导入上节课我们学过酸碱以及他们的性质,日常生活中,有哪些物质曾给你留下过“酸的印象”?如醋,酸果汁等我们可以通过尝味道来知道它们是酸的,那么实验时的溶液禁止尝味道,我们又怎么来区分哪些是酸哪些是碱呢?(二)、教学内容一、酸性溶液和碱性溶液1、酸碱指示剂能检验溶液酸、碱性的指示剂,称为酸碱指示剂常用的酸碱指示剂:紫色石蕊试液;酚酞试液。
2.实验:检验溶液的酸碱性滴加紫色变红变红变红变红变蓝变蓝紫色紫色石蕊试液滴加无色无色无色无色无色变红变红无色无色酚酞试液结论酸性酸性酸性酸性碱性碱性中性中性结论:酸性碱性中性紫色石蕊试液红蓝紫无色酚酞试液无红无酸性溶液——使紫色石蕊试纸变红;碱性溶液——使紫色石蕊试纸变蓝。
注意:我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性酸性溶液能使蓝色石蕊试纸变红;碱性溶液能使红色石蕊试纸变蓝。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
2022年九年级下学期化学《实验活动溶液酸碱性的检验》测试卷一.选择题(共13小题)1.一些物质的近似pH如图所示,下列有关说法正确的是()A.鸡蛋清的碱性比肥皂水的碱性强B.厕所清洁剂不会腐蚀大理石地面C.厕所清洁剂与炉具清洁剂不能混合使用D.人被蚊虫叮咬后,在肿包处涂抹牛奶就可减轻痛痒解:A、鸡蛋清的pH比肥皂水的小,因此肥皂水的碱性比鸡蛋清的碱性强,故A错误;B、厕所清洁剂的pH小于7,显酸性,能和大理石中的碳酸钙反应,故B错误;C、厕所清洁剂显酸性,炉具清洁剂显碱性,因此厕所清洁剂不能与炉具清洁剂能混用,故C正确;D、牛奶的pH小于7,显弱酸性,蚊虫毒液显酸性,涂抹牛奶不能减轻痛痒,故D错误。
故选:C。
2.人体胃液的pH=2左右,而小肠内溶液的pH=8左右,消化液中的哪种粒子能使胃内容物到了小肠后pH发生了这么大的变化()A.Na+B.Cl﹣C.HCO3﹣D.H2O解:胃液的pH=2,胃液显酸性,其中含有氢离子。
钠离子、氯离子、水分子均不与氢离子反应,而碳酸氢根离子能与氢离子结合成二氧化碳和水,造成胃液中酸洗减弱,pH 增大。
故选:C。
3.下列排序正确的是()A.空气中物质含量:B.溶液的pH:C.利用金属的年代:D.氮元素化合价:解:A、按体积计算,空气中含量最多的是氮气、其次为氧气,二氧化碳的含量较小,故A排序错误;B、肥皂水显碱性,pH大于7;食盐水呈中性,pH等于7;柠檬汁显酸性,pH小于7,故B排序正确;C、金属的冶炼历史顺序与金属活动性有关,越不活泼的金属越容易冶炼,越早被人类使用,故利用金属的年代应该是Cu、Fe、Al,故C排序错误;D、N2O4中,氮元素显+4价;NH3中,氮元素显﹣3价;N2O中,氮元素显+1价,故D排序错误。
故选:B。
4.下列物质加入水中,所得溶液pH可能为10的是()A.熟石灰B.白醋C.橘子汁D.食盐解:A、熟石灰是氢氧化钙的俗称,氢氧化钙是一种碱,其水溶液显碱性,pH大于7,可能是为10,故A正确;B、白醋是醋酸的水溶液,显酸性,pH小于7,故B错误;C、橘子汁显酸性,pH小于7,故C错误;D、食盐的水溶液呈中性,pH等于7,故D错误。