初三化学溶液的酸碱性讲义练习
- 格式:docx
- 大小:73.89 KB
- 文档页数:8


2018-2019学年九年级化学下册第八章常见的酸、碱、盐8.1 溶液的酸碱性同步练习(新版)粤教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018-2019学年九年级化学下册第八章常见的酸、碱、盐8.1 溶液的酸碱性同步练习(新版)粤教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018-2019学年九年级化学下册第八章常见的酸、碱、盐8.1 溶液的酸碱性同步练习(新版)粤教版的全部内容。
8.1 溶液的酸碱性核心·易错图8-1-1是实验室两瓶没有标签的溶液,回答下列问题。
图8-1-1(1)为了明确两种溶液的酸碱性,可以使用________________,如使用紫色石蕊溶液,若溶液显酸性,则能使紫色石蕊溶液变________;若溶液显碱性,则能使紫色石蕊溶液变________;若溶液为中性,则紫色石蕊溶液为________色.(2)也可以通过测定溶液的pH来确定它们的酸碱性。
测定pH用pH试纸,方法为___________________________________________________________。
若pH >7,则溶液呈______性;pH=7,溶液呈______性;pH<7,溶液呈______性。
[核心知识]1.石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝,遇中性溶液不变色。
酚酞溶液遇酸性或中性溶液不变色,遇碱性溶液变红。
2.溶液酸碱性的强弱程度用pH表示。
pH=7的溶液呈中性,pH>7的溶液呈碱性,pH<7的溶液呈酸性。
[易错点拨]1.发生变色的是指示剂,不是酸性或碱性溶液。
2.用pH试纸测定溶液的酸碱度时,pH试纸不能润湿,也不能直接浸入待测液中,且测定结果为整数.1.将紫色石蕊溶液分别滴加到肥皂水、蒸馏水和食醋中,它们显示的颜色依次是()A. 蓝色、紫色、红色 B.红色、紫色、蓝色C.红色、无色、蓝色 D.蓝色、无色、红色2.向某溶液中滴入无色酚酞溶液后不显色,向该溶液中滴入紫色石蕊溶液,则( )A。


化学练习题溶液的酸碱性与pH计算化学练习题:溶液的酸碱性与pH计算化学中的酸碱性是一个重要的概念,而pH是用来描述溶液酸碱性强弱的指标。
本文将通过一些化学练习题,来深入了解如何计算溶液的酸碱性及pH值。
题一:求解酸碱性1. 已知溶液A的氢氧化钠(NaOH)浓度为0.1 mol/L,试判断该溶液属于酸性、中性还是碱性?解析:氢氧化钠是一种强碱,当其浓度大于水的离子积时,溶液呈碱性。
水的离子积为1×10^-14,由此可计算出NaOH溶液的氢氧离子浓度为0.1 mol/L,大于水的离子积。
因此,溶液A属于碱性溶液。
题二:求解pH值2. 已知溶液B的强酸硫酸(H2SO4)浓度为0.01 mol/L,试计算该溶液的pH值。
解析:硫酸是一种强酸,根据强酸的性质,溶液中的H+离子浓度等于硫酸的浓度。
因此,溶液B的H+离子浓度为0.01 mol/L。
pH值的定义为pH = -log[H+],带入数据可得pH = -log(0.01) ≈ 2。
题三:酸碱度的比较3. 已知溶液C的酸度为pH=3,溶液D的酸度为pH=6,请判断溶液C和溶液D的酸碱性。
解析:根据pH值的定义,pH越小表示溶液越酸性,pH越大表示溶液越碱性。
因此,溶液C的酸度更高,属于酸性溶液;溶液D的酸度较低,属于中性溶液。
题四:酸碱性的计算4. 已知溶液E中的氢离子(H+)浓度为10^-8 mol/L,试计算该溶液的pH值。
解析:溶液E的H+离子浓度为10^-8 mol/L。
pH值的计算公式为pH = -log[H+],带入数据可得pH = -log(10^-8) ≈ 8。
综上所述,化学练习题中的溶液的酸碱性与pH计算可以通过简单的分析与计算得出。
正确理解酸碱性的概念以及pH的计算方法,能够帮助我们更好地理解和应用化学知识。

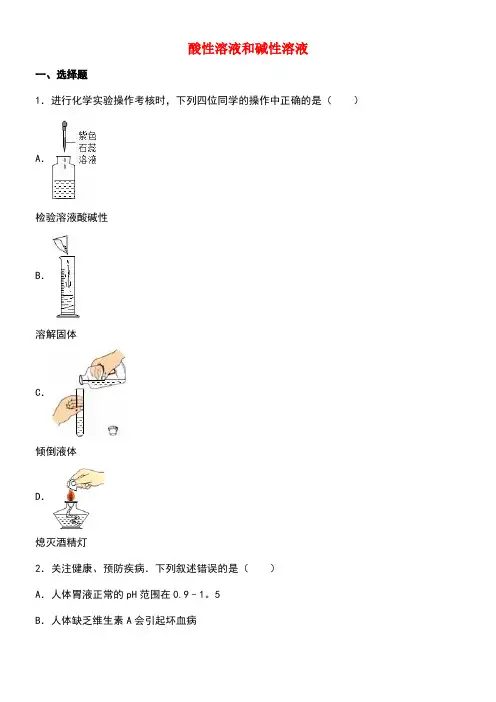
酸性溶液和碱性溶液一、选择题1.进行化学实验操作考核时,下列四位同学的操作中正确的是()A.检验溶液酸碱性B.溶解固体C.倾倒液体D.熄灭酒精灯2.关注健康、预防疾病.下列叙述错误的是()A.人体胃液正常的pH范围在0.9﹣1。
5B.人体缺乏维生素A会引起坏血病C.香烟的烟气中含多种对人体有害的物质D.人体缺碘会引起甲状腺肿大,碘过量也会引起甲状腺肿大3.猪肉的新鲜度可以通过测试pH来判断.有资料显示,pH与肉类新鲜度的关系为:名称新鲜肉次鲜肉变质肉pH 5.8~6。
2 6.3~6。
6>6.7根据上表判断,肉类变质过程中酸碱性的变化趋势是()A.酸性变弱B.酸性变强C.酸性不变D.碱性变弱4.下列物质加入水中,所得溶液pH可能为10的是()A.生石灰B.醋酸C.水杨酸D.食盐5.下表是生活中一些物质的pH:物质种类厕所清洁剂桔子汁牛奶草木灰水厨房清洁剂pH136。
51112。
5有关它们的说法中正确的是()A.牛奶的酸性比桔子汁强B.用湿润的pH试纸蘸取厕所清洁剂测其pHC.草木灰水显酸性D.胃酸过多的人不宜多吃桔子6.已知生活中一些食物的pH如下,其中显碱性的是( )食物豆浆牛奶葡萄汁柠檬汁pH7。
4~7.9 6.3~6.63。
5~4。
5 2.4~3。
0A.豆浆B.牛奶C.葡萄汁D.柠檬汁7.以下物质显酸性的是()A.肥皂水pH=10 B.食盐水pH=7C.草木灰水pH=ll D.苹果汁pH=38.溶液的酸碱度常用PH表示,下列物质中碱性最强的是( )A.牛奶B.草木灰水C.牙膏D.肥皂9.某些常见物质的pH值如图,某些分析不合理的是()A.橘子汁能使紫色石蕊试液变红B.校园土壤适合于大多数植物的生长C.农业上经常用氢氧化钠溶液改良酸性土壤D.洁厕剂会腐蚀大理石(主要成分CaCO3)10.下列物质呈中性的是()A.食盐水pH=7 B.炉具清洁剂pH=12C.酱油pH=4 D.柠檬汁pH=311.心血管疾病患者大多属于酸性体质,根据以下表中信息:食物苹果葡萄牛奶豆制品pH 2.9~3。



溶液的酸碱性一、选择题1.下列溶液,能使无色酚酞试液变红的是()A.石灰水B.食盐水C.食醋 D.汽水2.酸溶液能使紫色石蕊试剂变红,是因为酸溶液中含有()A.氢离子B.氢分子C.酸根离子 D.酸分子3.柠檬汁能使石蕊试液变红色,由此可知柠檬汁()A.显酸性B.显碱性C.显中性D.无法确定4.向某一未知溶液中滴加几滴酚酞试液,酚酞试液变为红色,则该溶液()A.呈中性B.呈酸性C.呈碱性D.是碱溶液5.人体内的一些液体的正常pHX围如下表,正常情况下,这些液体中一定呈酸性的是()血浆乳汁唾液胆汁胰液胃液pHX围~~~~~~A.胃液 B.血浆 C.乳汁 D.唾液6.大致测定某溶液是酸性还是碱性,要采取()①石蕊试液②酚酞试液③石蕊试纸④pH试纸.A.只有①② B.只有①②③C.只有①④ D.以上都可以7.下列物质放入或通入水中,能使pH增大的是()A.NaCl B.白醋 C.干冰 D.生石灰8.下列物质溶于水,所得溶液的pH大于7的是()A.CO2B.HCl C.NaCl D.Ca(OH)2二、填空题9.酸碱指示剂只能指示溶液的而不能测定溶液的,溶液的酸碱度用来表示,其X围一般在之间.测溶液酸碱性的强弱程度可用.pH值越小,其酸性越;pH越大,碱性越.测定溶液pH的方法是.10.测定pH值最简单的方法是使用.测定时,用蘸取待测溶液,滴在上,然后再与对照,便可测出溶液的pH值.若用此法测得土壤的pH值小于5,可以施用适量的来改良土壤.溶液的酸碱性参考答案与试题解析一、选择题1.下列溶液,能使无色酚酞试液变红的是()A.石灰水B.食盐水C.食醋 D.汽水【考点】酸碱指示剂及其性质.【专题】常见的碱碱的通性.【分析】根据已有的知识进行分析,能使酚酞试液变红的溶液呈碱性.【解答】解:使酚酞变红的是碱性的物质的溶液.A.石灰水呈碱性,故正确;B.石灰水呈中性,故错误;C.食醋呈酸性,故错误;D.汽水中含有碳酸,呈酸性,故错误.故选A.【点评】本题考查了酸碱指示剂的性质,完成此题,可以依据已有的课本知识进行,要求同学们加强基础知识的储备,以便灵活应用.2.酸溶液能使紫色石蕊试剂变红,是因为酸溶液中含有()A.氢离子B.氢分子C.酸根离子 D.酸分子【考点】物质的微粒性;酸的化学性质.【专题】结合课本知识的信息.【分析】可以根据酸的概念进行分析、考虑,从而得出正确的结论.【解答】解:电离时生成的阳离子全部是氢离子的化合物是酸.酸溶液能使紫色石蕊试剂变红,是因为酸溶液中含有氢离子.观察选项,故选A.【点评】本题主要考查了酸具有酸性的实质,完成此题,可以依据酸的定义进行.3.柠檬汁能使石蕊试液变红色,由此可知柠檬汁()A.显酸性B.显碱性C.显中性D.无法确定【考点】酸碱指示剂及其性质;溶液的酸碱性与pH值的关系.【专题】物质的变化与性质.【分析】根据已有的知识进行分析,石蕊试液遇酸变红.【解答】解:石蕊试液遇酸变红,观察选项,故选A.【点评】根据石蕊试液的变色进行.4.向某一未知溶液中滴加几滴酚酞试液,酚酞试液变为红色,则该溶液()A.呈中性B.呈酸性C.呈碱性D.是碱溶液【考点】酸碱指示剂及其性质.【专题】常见的酸酸的通性.【分析】根据已有的知识进行分析,酚酞试液在酸性和中性溶液中不变色,在碱性溶液中变红,据此解答.【解答】解:碱性溶液能使无色的酚酞试液变红色,但是该溶液不一定是碱的溶液,如碳酸钠溶液能使无色酚酞变红色,但是不是碱溶液.故选:C.【点评】本题考查了溶液的酸碱性与指示剂的变色的知识,完成此题,可以依据已有的知识进行.5.人体内的一些液体的正常pHX围如下表,正常情况下,这些液体中一定呈酸性的是()血浆乳汁唾液胆汁胰液胃液pHX围~~~~~~A.胃液 B.血浆 C.乳汁 D.唾液【考点】溶液的酸碱性与pH值的关系.【专题】结合课本知识的信息.【分析】根据已有的知识进行分析,酸性溶液的pH小于7,据此解答.~1.5,小于7,呈酸性,故A正确;~7.45,大于7,呈碱性,故B错误;~7.6,接近中性,故C错误;~7.1,接近中性,故D错误;故选A.【点评】本题考查了溶液的酸碱性与pH的关系,完成此题,可以依据已有的知识进行.6.大致测定某溶液是酸性还是碱性,要采取()①石蕊试液②酚酞试液③石蕊试纸④pH试纸.A.只有①② B.只有①②③C.只有①④ D.以上都可以【考点】探究酸碱的主要性质.【专题】课本知识同类信息.【分析】做好此题要了解紫色石蕊试液和无色酚酞试液遇酸碱后的不同变化;以及石蕊试纸和PH试纸遇酸碱的变化.【解答】解:紫色石蕊试液遇酸性溶液变红,遇碱性溶液变蓝;无色的酚酞试液遇酸性溶液不变色,遇碱性溶液变红;酸性溶液使蓝色石蕊试纸变红,碱性溶液使红色石蕊试纸变蓝;PH试纸遇到酸性溶液呈红色,遇到碱性溶液呈蓝色.也就是说①②③④都可用来检验溶液的酸碱性.故选D.【点评】本题考查常用的酸碱指示剂及其使用,使学生了解酸碱指示剂的正确使用.7.下列物质放入或通入水中,能使pH增大的是()A.NaCl B.白醋 C.干冰 D.生石灰【考点】溶液的酸碱性与pH值的关系;二氧化碳的化学性质;碳酸钙、生石灰、熟石灰之间的转化.【专题】物质的变化与性质.【分析】根据溶液的pH值与溶液的酸碱性的关系来判断,当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性.【解答】解:A、氯化钠是中性的物质其pH值为7,和水的相等,故A错B、白醋是酸性的物质,其pH小于7,加入水中后会使pH降低,故B错C、干冰是二氧化碳的固态,能够溶于水,生成碳酸,pH小于7,从而使pH降低,故C错D、生石灰可以和水反应生成氢氧化钙,氢氧化钙溶于水后使溶液pH大于7,使溶液的pH增大,故D对故选D【点评】掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论.8.下列物质溶于水,所得溶液的pH大于7的是()A.CO2B.HCl C.NaCl D.Ca(OH)2【考点】溶液的酸碱性与pH值的关系.【专题】常见的酸酸的通性.【分析】当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此结合常见化学物质的酸碱性进行分析判断即可.【解答】解:A、CO2与水反应生成碳酸,碳酸显酸性,pH小于7,故选项错误.B、HCl溶于水形成盐酸,盐酸显酸性,pH小于7,故选项错误.C、NaCl溶于水形成氯化钠溶液,氯化钠溶液显中性,pH等小于7,故选项错误.D、Ca(OH)2溶于水形成氢氧化钙溶液,氢氧化钙溶液显碱性,pH等大于7,故选项正确.故选:D.【点评】本题难度不大,掌握常见化学物质的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键.二、填空题9.酸碱指示剂只能指示溶液的酸碱性而不能测定溶液的酸碱度,溶液的酸碱度用pH 来表示,其X围一般在0~14 之间.测溶液酸碱性的强弱程度可用pH试纸.pH值越小,其酸性越强;pH越大,碱性越强.测定溶液pH的方法是用玻璃棒蘸取溶液滴在pH试纸上,再与标准比色卡对照即可测出溶液的pH .【考点】酸碱指示剂及其性质;溶液的酸碱度测定;溶液的酸碱性与pH值的关系.【专题】结合课本知识的信息.【分析】可以根据溶液的酸碱性、酸碱度、测定溶液酸碱度的方法等方面进行分析、判断,从而得出正确的结论.【解答】解:酸碱指示剂只能指示溶液的酸碱性而不能测定溶液的酸碱度.故填:酸碱性;酸碱度.溶液的酸碱度用PH来表示,其X围一般在 0~14之间.测溶液酸碱性的强弱程度可用PH试纸.pH 值越小,其酸性越强;pH越大,碱性越强.故填:PH;0~14;PH试纸;强;强.测定溶液pH的方法是:用玻璃棒蘸取溶液滴在pH试纸上,再与标准比色卡对照即可测出溶液的pH.【点评】解答本题时要掌握溶液酸碱性、酸碱度的含义和测定溶液酸碱度方面的知识,只有这样才能对问题做出正确的判断.10.测定pH值最简单的方法是使用pH试纸.测定时,用玻璃棒蘸取待测溶液,滴在pH 试纸上,然后再与标准比色卡对照,便可测出溶液的pH值.若用此法测得土壤的pH值小于5,可以施用适量的熟石灰或消石灰Ca(OH)2来改良土壤.【考点】溶液的酸碱性测定;中和反应及其应用.【专题】实验性简答题.【分析】依据正确的测定溶液pH的方法解题;pH<7溶液呈酸性,可用加弱碱性物质(如熟石灰)的方法改良.【解答】解:测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值;pH值小于5的溶液显酸性,这样的土壤可用加熟石灰的方法改良.答案:pH试纸;玻璃棒;pH试纸;标准比色卡;熟石灰或消石灰Ca(OH)2【点评】本题考查pH的测定方法,掌握正确的测定pH的操作方法是解题的关键.。

九年级化学下册第八章常见的酸、碱、盐8.1 溶液的酸碱性同步练习(新版)粤教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(九年级化学下册第八章常见的酸、碱、盐8.1 溶液的酸碱性同步练习(新版)粤教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为九年级化学下册第八章常见的酸、碱、盐8.1 溶液的酸碱性同步练习(新版)粤教版的全部内容。
8。
1 溶液的酸碱性小试身手1[基础题]下列是人体几种体液的正常pH,其中酸性最强的是() A.胆汁(6.8~7。
4) B.唾液(6。
6~7。
1)C.血液(7。
35~7。
45)D.胃液(0.8~1。
5)2[基础题]图8-1—6是X、Y、Z、W四种液体的近似pH。
下列判断中不正确的是()A.X一定显酸性B.Y一定是水C.Z一定显碱性D.W的碱性一定比Z的强3[基础题]向pH=11的溶液中滴加石蕊溶液,溶液呈()A.无色B.紫色C.红色D.蓝色4[基础题]化学课上,李老师在滤纸上用酚酞溶液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图像(如图8-1—7),则X可能是() A.稀盐酸B.蒸馏水C.石灰水D.食盐水5[基础题]“测土选种"是现代农业常用的科学方法,取某村土壤浸出的溶液,加入无色酚酞溶液后显红色。
下表为四种农作物适宜生长的pH范围,你认为该村土壤比较适宜种植的农作物是()A.玉米B.茶树C.水稻D.马铃薯6[提高题]某化学兴趣小组想探究某一温度下氯化钠饱和溶液的酸碱度。
探究过程如下:[猜想或假设]溶液的pH可能为:①pH<7,②,③。
[设计和实验]要测定该溶液的酸碱度,除有正确的操作步骤外,不能采用下列物质中的(填序号)来进行实验。

2017年中考化学专题练习溶液的酸碱性2(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017年中考化学专题练习溶液的酸碱性2(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017年中考化学专题练习溶液的酸碱性2(含解析)的全部内容。
溶液的酸碱性一、选择题1.日常生活里的下列溶液中加入紫色石蕊无明显变化的是()A.雪碧B.纯碱溶液C.纯净水 D.柠檬汁2.现有石灰水、食醋、蒸馏水,若将它们一次鉴别出来,可选用的试剂是()A.无色酚酞试液B.紫色石蕊试液C.稀盐酸 D.食盐溶液3.向某溶液中滴入无色酚酞溶液后不显色,向该溶液中滴入紫色石蕊溶液,则()A.一定显红色B.可能仍为紫色,也可能显红色C.可能显蓝色D.一定显无色4.下列物质的水溶液中,既能使紫色石蕊试液变蓝,又能使无色的酚酞试液变红的是() A.肥皂水 B.蔗糖水 C.番茄汁 D.水5.某溶液的pH=0,滴入紫色石蕊试液,石蕊试液会()A.变蓝色 B.变红色 C.变无色 D.不变色6.下列说法中正确的是( )A.pH<7的雨水叫酸雨B.pH<7的溶液,pH越小,酸性越弱C.使酚酞溶液变红的溶液是碱性溶液D.使用pH试纸应先用蒸馏水润湿7.下列溶液的酸性最强的是()A.pH=0的溶液B.pH=1的溶液C.pH=7的溶液D.pH=14的溶液8.“雪碧”等碳酸型饮料的pH小于7,晃动后打开瓶盖,其pH将()A.变大B.变小C.不变D.无法判断9.小明同学取生活中的四种物质,测得其pH如下表所示,其中酸性最强的是()物质矿泉水雨水橙汁蔗糖水PH7。
35。
本次课课堂教学内容一、要点复习1.酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液。
例如:碳酸钠(Na2CO3)属于盐类但其溶液显碱性,硫酸铜(CuSO4)属于盐类,但其溶液显酸性。
2.酸性、碱性溶液使酸碱指示剂变色,变色的是指示剂而不是酸性、碱性溶液。
二、内容讲解知识点1 酸性溶液和碱性溶液1,酸性:能使紫色石蕊试液变红的溶液,表现为酸性2,碱性:能使紫色石蕊试液变蓝的溶液,表现为碱性3,中性:不能使紫色石蕊试液变色,呈中性知识点2 酸碱指示剂1.酸碱指示剂(简称:指示剂):能跟酸或碱的溶液起作用而显示不同的颜色。
常见的有:石蕊溶液、酚酞溶液。
2.变色规律:石蕊溶液遇酸性溶液变成红色,遇碱性溶液变成蓝色。
酚酞溶液遇酸性溶液不变色,遇碱性溶液变成红色。
3.二氧化碳通入紫色的石蕊试液中,(1)溶液由紫色变成红色。
(2)二氧化碳溶于水生成了碳酸,是碳酸改变了溶液的颜色。
4.用酸碱指示剂检验溶液的酸碱性的方法:(1)取少量该溶液,滴入几滴石蕊试液,若溶液呈现红色,则说明该溶液为酸性溶液。
(2)取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;或者滴入几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液。
典例分析1.二氧化碳的水溶液(含碳酸)、白醋、酸果汁等物质能使紫色石蕊试液变红,表现出酸性;2.纯碱溶液、肥皂水、石灰水、氨水等溶液能使紫色石蕊试液变蓝,这些溶液显碱性3.食盐水、蔗糖水等溶液不能使紫色石蕊试液变色,既不具有酸性,也不具有碱性,显中性。
知识点3溶液酸碱性强弱1.溶液的酸碱度常用pH来表示,pH范围通常在0~14之间。
pH<7 溶液呈酸性;pH>7 溶液呈碱性;pH=7 溶液呈中性。
PH越小酸性越强,pH越大碱性越强。
2. pH的测定:用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)【典型例题】1.下列“水”能使无色酚酞试液变红的是( )A.氨水B.汽水C.冰水D.糖水2.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )A.食盐B.味精C.食醋D.香油3.下列物质能使紫色石蕊试液变红的是( )A.肥皂水B.氨水C.酸果汁D.食盐水4.把生石灰、二氧化碳、食盐分别溶于水,往它们的溶液里分别滴入紫色石蕊试液,试液呈现的颜色依次是( )A.蓝色、红色、紫色B.红色、无色、蓝色C.无色、蓝色、紫色D.紫色、蓝色、红色5.小明在一次晚会上表演了一个小魔术:他向事先做好的白花上喷一种无色试液后,白花变成了鲜艳的红花。
请你判断小明所喷的试液可能是( )A.紫色石蕊试液B.无色酚酞试液C.无色稀硫酸D.水6.向某溶液中滴入无色酚酞试液后不显色,向该溶液中滴入紫色石蕊试液则( )A.一定显红色B.可能显紫色,也可能显红色C.可能显蓝色D.一定显无色7.某同学在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系。
图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确的是( )A.紫色B.蓝色C.红色D.无色三、知识提升知识点1酸碱盐定义酸、碱、盐的组成酸是由氢离子和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属离子和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属离子(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶液中有大量自由移动的阴、阳离子)知识点2常见的酸1.盐酸:是HCl(气体)的水溶液,无色、有刺激性气味的液体。
纯净的浓盐酸是无色。
盐酸具有挥发性,浓盐酸在空气里会形成白雾,这是因为从浓盐酸里挥发出来的氯化氢气体跟空气里的水蒸气接触,形成盐酸小液滴的缘故。
2.浓硫酸:无色无味油状液体,但稀硫酸为无色透明溶液(1)有吸水性,在实验室中常用它作干燥剂。
(2)浓硫酸具有强腐蚀性(脱水性),使用时必须十分小心。
它能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。
(3)稀释浓硫酸的正确操作:将浓硫酸沿着烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动。
(4)如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
3.浓硝酸分子式为HNO3,纯HNO3是无色有刺激性气味的液体,易挥发。
注:浓硝酸在光照下会分解出二氧化氮而呈黄色,所以常将浓硝酸盛放在棕色试剂瓶中,且放置于阴暗处。
知识点3常见的碱1.氢氧化钠(1)氢氧化钠有强烈的腐蚀性,俗名叫做苛性钠、火碱、烧碱使用时要十分小心。
(2)潮解:氢氧化钠暴露在空气中时容易吸收水分,表面潮湿并逐渐溶解,这种现象叫做潮解(物理变化)。
溶解时放热、固体可用作气体的干燥剂(3)变质:吸收空气中的2NaOH+CO2====Na2CO3+H2O(化学变化)。
所以氢氧化钠必须密封保存。
(4)若不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
(5)检验氢氧化钠是否变质:变质的氢氧化钠中有碳酸钠,所以只要检验是否有碳酸钠就可以了。
加稀盐酸,将产生的气体通入澄清石灰水中,变浑浊,则说明变质了。
2.氢氧化钙生石灰与水发生化学反应:CaO+H2O===Ca(OH)2,反应放出大量的热,这些热量可以将鸡蛋煮熟氢氧化钙俗称:熟石灰或消石灰,对皮肤、衣服等也有腐蚀作用,使用时应注意安全。
(1)碱有腐蚀性,使用时应十分小心。
(2)氢氧化钙能与空气中的二氧化碳反应,生成坚硬的碳酸钙。
将氢氧化钙、粘土和沙子混合,用来作建筑材料,就是利用氢氧化钙的这一性质。
Ca(OH)2+CO2====CaCO3↓+H2O (3)用途:①工业:制漂白粉②农业:改良酸性土壤、配波尔多液③建筑【典型例题】1.下列关于酸、碱的元素组成说法中,正确的是()A.酸、碱可能含有氧元素B.碱一定含有金属元素C.酸、碱一定含有氢元素D.酸、碱一定含有氧元素2.在日常生活中常遇到各种酸,属于有机酸的是()A.胃酸中的盐酸B.汽水中的碳酸C.酸牛奶中的乳酸D.蓄电池里的硫酸3.向滴有酚酞的NaOH溶液中,逐渐滴入稀硫酸至过量,下面叙述正确的是()A.溶液由红色变为无色,PH逐渐减小B.溶液由无色变为红色,PH逐渐减小C.溶液由红色变为无色,PH逐渐增大D.溶液颜色不变,PH逐渐增大4.下列药品中,不需要密封保存的是()A.石灰水B.食盐C.浓盐酸D.浓硫酸5.盐酸是一种主要的工业用酸,下列关于盐酸的叙述中,错误的是()A.盐酸是氯化氢气体的水溶液B.纯净的浓盐酸是黄色有刺激性气味的液体C.人的胃液里含少量的盐酸,可以帮助消化D.浓盐酸具有挥发性,在空气中会形成白雾6.硫酸的用途很广,下列叙述的硫酸性质中,属于物理性质的是()A.浓硫酸具有脱水性B.硫酸能使紫色石蕊溶液变红C.稀硫酸能溶解镁、锌等金属D.浓硫酸难挥发7.浓盐酸、浓硫酸敞口放置一段时间后,共同变化是()A.溶质的质量减小B.溶剂的质量减小C.溶液的质量减小D.溶质质量分数减小8.下列质量增加的变化有一种与其它三种存在本质的区别,这种变化是()A.长期放置在空气中的氢氧化钠质量增加B.长期敞口放置的浓硫酸质量增加C.久置的生石灰质量增加D.久置的铁钉生锈质量增加本节课课后练习1.下列物质中可以用金属与酸直接反应制得的是()A.FeCl3B.MgSO4C.AgClD.CuCl22.要完成下列变化,不能通过盐酸经一步反应实现的是()A.CaO CaCl2B.Fe2O3 FeCl3C.Cu CuCl2D.Fe FeCl23.鱼味道鲜美,但剖鱼时弄破胆汁沾在鱼肉上有苦味,产生苦味的是胆汁酸(PH=6且难溶于水),沾有胆汁的地方涂上下列哪种物质可除去苦味()A.碳酸钠(纯碱)B.食醋C.食盐水D.自来水4.下列家庭小实验,不能成功的是()A.用过滤的方法把硬水变成软水B.用食醋除去水瓶胆中的水垢C.用闻气味的方法区分白酒和白醋D.用洁厕精(主要成分是盐酸)除去铁锈5.下列各溶液中,能跟石灰水反应,但没有明显现象的是()A.稀盐酸B.石蕊溶液C.氯化钠D.酚酞试液6.下列物质露置空气中一段时间,溶液中溶质的种类和质量分数均会发生变化的是()A.浓盐酸B.浓硫酸C.氢氧化钠溶液D.食盐溶液7.只用一种试剂就能区分稀盐酸、食盐溶液、澄清石灰水,这种试剂是()A.无色酚酞试液B.石蕊试液C.二氧化碳D.氢氧化钠溶液8.下列关于氢氧化钠的叙述不正确的是()A.固体氢氧化钠要密封保存,因为氢氧化钠在空气中易潮解但不变质B.氢氧化钠溶液能使紫色石蕊试液变蓝C.固体氢氧化钠可作氢气、氧气、一氧化碳这些气体的干燥剂D.氢氧化钠溶液对皮肤、纸张、织物有强腐蚀性9.下列关于氧化钙的叙述不正确的是()A.俗称熟石灰B.与水反应放热C.白色粉末D.生成物微溶于水10.氢氧化钠和氢氧化钙都是常见的碱。
下列关于它们的说法中,正确的是()A.都能用作建筑材料B.都能用作某些气体的干燥剂C.它们的溶液都能用于检验二氧化碳气体D.它们的溶液都能用于吸收二氧化硫气体,但前者吸收效果好。
11.氢氧化钠、氢氧化钙都是实验室常用的碱。
要鉴别氢氧化钠稀溶液和饱和氢氧化钙溶液,下列方法能够达到目的的是()A.分别滴加石蕊溶液B.分别通入二氧化碳C.分别滴加稀盐酸D.分别滴加酚酞试剂12.下列现象可用同一化学原理解释的是()①久置的石灰水,液面出现白膜②通过吸管向澄清石灰水中吹气,石灰水变浑浊③为使刚刷过石灰浆的墙壁快点干燥,在室内生一盆炭火,开始时墙壁反而更潮湿④向紫色石蕊试液中通入二氧化碳气体,试液变红⑤蘸过石灰水的鸡蛋更易保存⑥生石灰放入水中使水沸腾;⑦干冰撒到天空产生云雾、降雨;⑧改良酸性土壤。
A.①②③⑤B.①②④⑧C.②③⑦⑧D.②④⑤⑥13.熟石灰在工农业生产上用途很广,下列有关熟石灰用途的叙述中,不切实际的是()A.可用作建筑材料B.可改良酸性土壤C.可除去水壶中的水垢D.可除去硫酸厂污水中的硫酸14.某NaOH固体样品,可能含有固体KOH和不溶于酸的杂质A,取5.6g该样品与100g一定质量分数的稀盐酸反应,两者恰好完全反应,生成m g水。
下列说法正确的是()A.若样品不含任何杂质,则m<1.8B.若m=1.8,则样品中一定含有杂质A,可能含有固体KOHC.若m=1.8,则样品中至少含有杂质A或固体KOH的一种D.若样品中不含A,则盐酸的溶质质量分数不小于7.3%15.下列框图中是某品牌“洁厕灵”标签上的部分文字.(1)请推测该洁厕灵呈(填“酸”或“碱”)性. 要在家中验证此结论, 可采用的一种方法是。