苏教版化学必修二专题一第二单元复习
- 格式:ppt
- 大小:311.00 KB
- 文档页数:16

第二单元微粒之间的相互作用力离子键教学目标知识与技能:使学生了解化学键的概念和化学反应的本质。
理解离子键的概念,能用电子式表示离子化合物。
过程与方法:培养学生对微观粒子运动的想象力。
培养学生分析问题、解决问题的能力。
情感态度与价值观:通过对离子键形成过程的分析,培养学牛求实精神。
培养学牛由个别到一般的研究问题的方法。
从宏观到微观,从现象到本质的认识事物的科学方法。
教学重点:离子键。
教学难点:化学键概念、化学反应的本质。
教学方法:启发、诱导、阅读、归纳等教学过程:从前面所学知识我们知道,元素的化学性质主要决定于该元素的原子的结构。
而化学反应的实质就是原子的重新组合,那么,是不是任意两个或多个原子相遇就都能形成新物质的分子或物质呢?不是!如氢原子和氟原子在常温下相遇能形成氟化氢分子,而氢原子和氨原子在同一条件下就不发生化学反应。
原子和原子相遇时,有的能进行组合,有的不能,这说明在能组合的原子和原子之间,一定有某种作用的存在,才能使原子和原子相互结合成新的分子和新的物质。
而原子和原子组合时,相邻的原子之间所存在的强烈的相互作用,我们又称其为化学键,这也是我们本节课所要讲的内容。
化学键:直接相邻的原子或离子之间存在的强烈的相互作用根据原子和原子相互作用的实质不同,我们可以把化学键分为离子键、共价键、金属键等不同的类型。
首先我们来学习离子键。
离子键你知道吗?P122Na+Cl2====2NaCl Mg + Cl2 == MgCl2从宏观上看,钠和氯气发生了化学反应,生成了新物质氯化钠。
如若从微观的角度,又应该怎样理解上述反应呢?在上述条件下,氯气分子先被破坏成氯原子,氯原子和钠原子重新组合,生成新的氯化钠分子。
我们从氯原子和钠原子的结构上入手分析。
原子在参加化学反应时,都有使自己的结构变成什么样的结构的倾向?稳定结构。
什么是稳定结构?最外层电子数是8的结构,K层为最外层时是2个电子。
它们通常通过什么方式来得到稳定结构?通过得失电子或形成共用电子对。

苏教版高一化学必修二全书复习纲要Revised by Jack on December 14,2020苏教版高一化学必修2复习纲要专题1 微观结构与物质的多样性复习纲要一、原子结构与元素原子核外电子排布规律 (一)、原子结构:原子的表示方法:X A Z ,其中X 是原子符号,A 表示质量数,Z 表示质子数。
原子:核电荷数= = =原子序数 质量数= + ≈相对原子质量阳离子:(a A m+)核外电子数=质子数 - 所带电荷数,即核外电子数=a-m 阴离子:(b B n-)核外电子数=质子数 + 所带电荷数,即核外电子数=b+n (二)、同位素: 叫同位素。
(要点)两同:质子数相同,同种元素;两不同:中子数不同,不同原子. (三)、核外电子排布规律在含有多个电子的原子中,能量低的电子通常在离核较 的区域内运动,能量高的电子通常在离核较 的区域内运动。
据此可以认为:电子在原子核外距核由 到 ,能量是由低到高的方式进行排布。
通常把能量最 、离核最 的电子层叫第一层,由里往外以此类推,共有 个电子层,分别用字母 、 、 、 、 、 、 表示,每层最多容纳的电子数为 个。
而最外层电子数不得超过 个(K 层为最外层时,电子数不超过2个),次外层不得超过18个。
(四)、画出1-20号元素的原子结构示意图和离子结构示意图 请画出以下粒子的结构示意图二、原子结构、元素周期律、元素周期表的关系(一)、原子结构与元素周期表的关系核电荷数===原子序数周期序数=;最高正价+|最低负价|=8主族序数=最外层电子数=最高正价(O、F除外)周期表结构现行元素周期表的编排原则与特点:周期:每个横行称为周期;同周期,最外层电子数从1增加到8。
(第一周期除外)族:每个纵行称为族;同主族,最外层电子数相同。
注意:一定要记住主族的表示方法。
(二)、元素周期律:随着原子序数的递增,元素的原子半径(除稀有气体元素外)、元素的金属性和非金属性、元素的主要化合价(最高化合价与最低化合价)都呈现周期性变化。



第一章物质结构元素周期律1.原子结构: 如: 的质子数与质量数, 中子数, 电子数之间的关系2.元素周期表和周期律(1)元素周期表的结构A.周期序数=电子层数B.原子序数=质子数C.主族序数=最外层电子数=元素的最高正价数D.主族非金属元素的负化合价数=8-主族序数E.周期表结构(2)元素周期律(重点)A.元素的金属性和非金属性强弱的比较(难点)a.单质与水或酸反应置换氢的难易或与氢化合的难易与气态氢化物的稳定性b.最高价氧化物的水化物的碱性或酸性强弱c.单质的还原性或氧化性的强弱(注意: 单质与相应离子的性质的变化规律相反)B.元素性质随周期和族的变化规律a.同一周期, 从左到右, 元素的金属性逐渐变弱b.同一周期, 从左到右, 元素的非金属性逐渐增强c.同一主族, 从上到下, 元素的金属性逐渐增强d.同一主族, 从上到下, 元素的非金属性逐渐减弱C.第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)D.微粒半径大小的比较规律:a.原子与原子b.原子与其离子c.电子层结构相同的离子(3)元素周期律的应用(重难点)A.“位, 构, 性”三者之间的关系a.原子结构决定元素在元素周期表中的位置b.原子结构决定元素的化学性质c.以位置推测原子结构和元素性质B.预测新元素与其性质3.化学键(重点)(1)离子键:A.相关概念:B.离子化合物: 大多数盐、强碱、典型金属氧化物C.离子化合物形成过程的电子式的表示(难点)(AB, A2B, AB2, NaOH, Na2O2, NH4Cl, O22-, NH4+)(2)共价键:A.相关概念:B.共价化合物: 只有非金属的化合物(除了铵盐)C.共价化合物形成过程的电子式的表示(难点)(NH3, CH4, CO2, HClO, H2O2)D 极性键与非极性键(3)化学键的概念和化学反应的本质:第二章化学反应与能量1.化学能与热能(1)化学反应中能量变化的主要原因: 化学键的断裂和形成(2)化学反应吸收能量或放出能量的决定因素: 反应物和生成物的总能量的相对大小a.吸热反应: 反应物的总能量小于生成物的总能量b.放热反应: 反应物的总能量大于生成物的总能量(3)化学反应的一大特征:化学反应的过程中总是伴随着能量变化, 通常表现为热量变化练习:氢气在氧气中燃烧产生蓝色火焰, 在反应中, 破坏1molH-H键消耗的能量为Q1kJ, 破坏1molO = O键消耗的能量为Q2kJ, 形成1molH-O键释放的能量为Q3kJ。

高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.X 原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
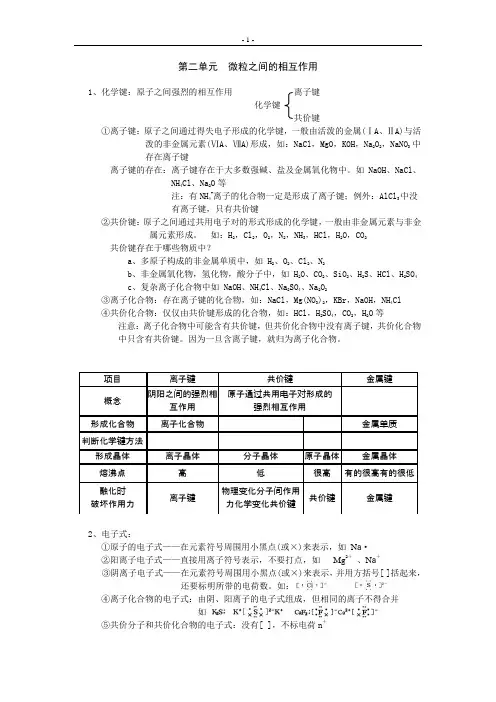
第二单元 微粒之间的相互作用1、化学键:原子之间强烈的相互作用离子键化学键共价键①离子键:原子之间通过得失电子形成的化学键,一般由活泼的金属(ⅠA 、ⅡA)与活泼的非金属元素(ⅥA 、ⅦA)形成,如:NaCl ,MgO ,KOH ,Na 2O 2,NaNO 3中存在离子键离子键的存在:离子键存在于大多数强碱、盐及金属氧化物中。
如NaOH 、NaCl 、NH 4Cl 、Na 2O 等注:有NH 4+离子的化合物一定是形成了离子键;例外:AlCl 3中没有离子键,只有共价键②共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元素形成。
如:H 2,Cl 2,O 2,N 2,NH 3,HCl ,H 2O ,CO 2共价键存在于哪些物质中?a 、多原子构成的非金属单质中,如 H 2、O 2、Cl 2、N 2b 、非金属氧化物,氢化物,酸分子中,如 H 2O 、CO 2、SiO 2、H 2S 、HCl 、H 2SO 4c 、复杂离子化合物中如 NaOH 、NH 4Cl 、Na 2SO 4、Na 2O 2③离子化合物:存在离子键的化合物,如:NaCl ,Mg(NO 3)2,KBr ,NaOH ,NH 4Cl ④共价化合物:仅仅由共价键形成的化合物,如:HCl ,H 2SO 4,CO 2,H 2O 等注意:离子化合物中可能含有共价键,但共价化合物中没有离子键,共价化合物中只含有共价键。
因为一旦含离子键,就归为离子化合物。
2、电子式:①原子的电子式——在元素符号周围用小黑点(或×)来表示,如 N a ·②阳离子电子式——直接用离子符号表示,不要打点,如 Mg 2+ 、N a +③阴离子电子式——在元素符号周围用小黑点(或×)来表示,并用方括号[ ]括起来,还要标明所带的电荷数。
如:④离子化合物的电子式:由阴、阳离子的电子式组成,但相同的离子不得合并如⑤共价分子和共价化合物的电子式:没有[ ],不标电荷n +注:只有共价分子和共价化合物才有结构式,离子化合物没有结构式练习:写出下列物质的电子式:⑴、离子化合物:阴、阳离子的电子式结合即为离子化合物的电子式。

苏教版化学必修2复习纲要(专题1、3、4)专题1 微观结构与物质的多样性一、核外电子排布与周期性 (1).原子结构1、原子的质量主要集中在原子核上。
2、质子和中子的相对质量都近似为1,电子的质量可忽略。
3、原子序数 = 核电核数 = 质子数 = 核外电子数4、质量数(A )=质子数(Z )+中子数(N )5、在化学上,我们用符号AZ X 来表示一个质量数为A ,质子数为Z 的具体的X 原子。
如:的质子数与质量数,中子数,电子数之间的关系6、核素:把具有一定数目的质子和一定数目的中子的一种原子称为核素。
一种原子即为一种核素。
7、同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
或:同一种元素的不同核间互称为同位素。
①两 同:质子数相同、同一元素 ②两不同:中子数不同、质量数不同 ③属于同一种元素的不同种原子 (2).原子核外电子的排布1、在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布。
电子总是尽先排布在能量最低的电子层里。
2、核外电子的排布规律①各电子层最多容纳的电子数是2n 2(n 表示电子层)②最外层电子数不超过8个(K 层是最外层时,最多不超过2个);次外层电子数目不超过18个;倒数第三层不超过32个。
③核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
二.、元素周期律 (1)元素周期律(重点) 1.核外电子层排布:随着原子序数的递增,每隔一定数目的元素,会重复出现原子“最外层电子从_______个递增到_________个的情况(K 层由1-2)而达到结构的变化规律。
2.最高正化合价和最低负化合价:随着原子序数的递增,每隔一定数目的元素,会重复出现原子最高价由+1 +7,中部出现负价,由-4 -1 的变化规律。
①O 、F 无正价,金属无负价②最高正化合价:+1→+7 最低负化合价:-4→-1→0 ③最高正化合价=最外层电子数=主族序数 ④最高正化合价+∣最低负化合价∣=________ 3.元素金属性和非金属性的递变A. 元素的金属性和非金属性强弱的的判断依据(难点)a. 单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性b. 最高价氧化物的水化物的碱性或酸性强弱原子AZ X原子核质子 Z 个中子 N 个=(A -Z )个核外电子 ZZAn Rc. 单质的还原性或氧化性的强弱(注意:单质与相应离子的性质的变化规律相反)B. 第三周期元素的变化规律和碱金属族元素的变化规律(包括物理、化学性质)1.2Na + 2H2O =2NaOH + H2↑(容易) Mg + 2 H2O 2Mg(OH)2 + H2↑(较难)金属性:Na > Mg2.Mg + 2HCl =MgCl2+ H2↑(容易) 2Al + 6 HCl =2AlCl3 +3H2↑(较难)金属性:Mg > Al 根据1、2得出:金属性Na > Mg > Al3.碱性 NaOH > Mg(OH)2> Al(OH)3 金属性:金属性Na > Mg > AlNa Mg Al金属性逐渐减弱4.结论:Si P S Cl单质与H2的反应越来越容易生成的氢化物越来越稳定最高价氧化物对应水化物的酸性逐渐增强故:非金属性逐渐增强。

苏教版⾼⼀化学必修⼆专题⼀第⼆单元第⼀课时离⼦键(夯实基础)苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏苏⼀、单选题(本⼤题共17⼩题)1.下列物质属于离⼦化合物的是()A. Cl2B. Na2OC. CO2D. H2O2.活泼⾦属与活泼⾮⾦属化合形成的物质通常含有离⼦键,下列物质含有离⼦键的是()A. NOB. COC. CO2D. KCl3.下列物质中只含有离⼦键的是A. H2OB. NH4ClC. Na2SD. Na2O24.下列过程仅克服离⼦键的是()A. NaHSO4溶于⽔B. HCl溶于⽔C. 氯化钠熔化D. 碘升华5.下列不是离⼦化合物的是()A. B.C. D.6.下列有关离⼦键和离⼦化合物的说法正确的是()A. 凡含离⼦键的化合物,⼀定含⾦属元素B. 在化合物MgCl2中,两个氯离⼦之间也存在离⼦键C. 离⼦化合物⼀定能导电D. 原⼦序数为11与9的元素能够形成离⼦化合物,该化合物中存在离⼦键7.氯化钠是⽇常⽣活中⼈们常⽤的调味品.是下列事实中,可以证明NaCl中⼀定存在离⼦键的是()A. ⽔溶液能导电B. 易溶于⽔C. 熔化时能导电D. 有较⾼的熔点8.下列关于离⼦化合物和共价化合物的说法正确的是()A. 共价化合物中可能含离⼦键B. 离⼦化合物中可能不含⾦属元素C. 共价化合物溶于⽔不能导电D. 第ⅠA族元素与第ⅦA族元素形成的化合物⼀定是离⼦化合物9.下列说法正确的是()A. ⾦属元素与⾮⾦属元素形成的化学键⼀定是离⼦键B. ⅠA族和ⅦA族原⼦化合时,⼀定⽣成离⼦键C. 仅⾮⾦属元素形成的化合物中⼀定不是离⼦键D. 活泼⾦属与活泼⾮⾦属化合时,能形成离⼦键10.MgF2在灯光下能发出荧光,不溶于⽔和⼄醇,可⽤于⽣产印刷纸币的光变⾊防伪油墨。
下列有关MgF2的说法正确的是()A. F?和Mg2+的电⼦层结构不同B. 电⼦式为C. 只含有离⼦键的离⼦化合物D. ⽔溶液具有强导电性11.全氮类物质具有⾼密度、超⾼能量及爆轰产物⽆污染等优点。

元素周期律与元素周期表【双基盘点】1.原子序数与元素的原子结构之间存在着好下关系:原子序数= == 。
2.核素是指 ; 互称同位素,即之间的互称。
3.表示特定原子的符号为X AZ ,该原子中质子数是 ,质量数是 ,中子数是 ,核外电子数是 。
4.元素周期表的结构(1)周期①具有 的横行,叫做一个周期;② 周期有分类:短周期(第 周期) ,长周期(第 周期)和不完全周期(第周期)(2)族:在元素周期表中,共有 个纵行, 族,其中 个主族, 个副族, 个0族, 个第VIII 族。
5.随着原子序数的递增, 都呈现周期性变化。
人们把 这一规律叫做元素周期律。
6.元素的化学性质主要取决 。
同一周期自左向右,元素的金属性逐渐 ,非金属性逐渐 ;同一主族自上而下,元素的金属性逐渐 ,非金属性逐渐 。
7.周期序数= ;主族序数=画出1~18号元素在周期表中的相对位置图:画出1~18号元素原子结构示意图:AB C8.如何比较元素的金属性、非金属性?(1)比较元素金属性强弱的方法(2)比较元素非金属性强弱的方法例1A、B、C为短周期元素,在周期表中所处位置如下图所示。
A、C两元素的原子核外电子数之和等于B原子的质子数。
B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称、、。
(2)B位于元素周期表第周期,第族。
(3)C的原子结构示意图为。
(4)比较B、C的的原子半径,B C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式。
例2下列各组元素性质的递变情况错误的是()A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正价依次升高C.N、O、F原子半径依次增大D.Na、K、Rb的电子层数依次增多例3 下列叙述中能肯定说明金属A比金属B的活泼性强的是()A.A原子的最外层电子数比B原子的最外层电子数少B.A原子电子层数比B原子电子层数多C.1mol A从酸中置换出的H2比1molB从酸中置换的H2多D.常温时,A能从酸中置换出氢,而B不能练习巩固1.下列元素中金属性最强的是()A.K B.Na C.Al D.Mg2.常用于测定动植物标本的年龄。

(N1.原子数z X核外电子层元素种1 2 3 4 5 67高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律注意:质量数(A )=质子数(Z )+中子数(N )原了序数=核电荷数=质了数=原了的核外电了核外电了(Z 个)★熟背前20号元素,熟悉1〜20号元素原了核外电了的排布:H He Li Be B C N 0 F Ne Na Mg Al Si P S Cl Ar K Ca 2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电了数是2nL ③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超 过18个,倒数第三层电了数不超过32个。
电子层:一(能量最低) 二三 四五 六 七 对应表示符号:K LMN 0 PQ3.元素、核素、同位素元素:具有相同核电荷数的同一类原了的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 二、元素周期表 1.编排原则:%1 按原子序数递增的顺序从左到右排列%1 将电了层数袒回的各元素从左到右排成一模彳了。
(周期序数=原子的电子层数) %1 把最多层电于数祖回的元素按电子层数递增的顺序从上到下排成一纵行。
主族序数=原子最外层电子数2种元素 8种元素 8种元素 18种元素 18种元素32种元素未填满(已有26种元素)表「主族:IA 〜VDA 共7个主族I 族 J 副族:IIIB 〜VDB 、IB-IIB,共7个副族(18个纵行)[第VI 族:三个纵行,位于VDB 和IB 之间 (16个族)〔零族:稀有气体 三、元素周期律 1.元素周期律:元素的性质(核外电了排布、原了半径、主要化合价、金属性、非金属性)一、原子结构「质了 (Z个)「第一周期<短周期Y第二周期r 周期 1第三周期 元 (7个横行>「第四周期 素 (7个周期) J 第五周期周< 1长周期第六周期 期1第七周期2.结构特随着核电荷数的递增而呈周期性变化的规律。
高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.X 原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
苏教版高中化学必修二专题一第二单元《微粒之间的相互作用力》单元测试试题(解析版)第二单元《微粒之间的相互作用力》单元测试题一、单选题(每小题只有一个正确答案)1.下图中白球代表氢原子.黑球代表氦原子,方框代表容器(有一个可左右滑动的隔板,忽略隔板质量和摩擦力)。
其中能表示在相同条件下,等质量的氢气与氦气示意图是(He—4 ) ( )A. B. C. D.2.下列表示不正确的是A.KOH的电子式:B.二氧化碳的结构式:O=C=OC.CH4的球棍模型:D.S2ˉ的离子结构示意图:3.某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键( ) A.一定是离子键B.一定是共价键C.可能是离子键也可能是共价键D.以上说法都不正确4.下列各组物质中化学键的类型相同的是 ( )A.CaCl2MgCl2Na2O B.H2O Na2O CO2 C.CaCl2 NaOH H2SO4 D.NH4Cl H2O CO2 5.下列分子内部都存在着极性键的一组物质是( )A.H2S、NH3、SO3 B.CO2、NH4Cl、Na2O2 C.N2、CS2、NO D.CaO、H2O2、CH4 6.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是( )A.10与19 B.6与16 C.11与17 D.14与87.下列有关物质结构的说法正确的是( )A.78 g Na2O2晶体中所含阴、阳离子个数均为2N AB.3.4 g H2O2中含有0.3 mol化学键C.CO2的结构式为O-C-OD.PCl3邗BCl3分子中所有原子最外层均达到8电子稳定结构8.下列固体分类中正确的一组是( )1 / 18A .AB .BC .CD .D9.下列分子中所有原子都满足最外层为8电子结构的是( )①BeCl 2 ②NCl 3 ③PCl 5 ④COCl 2 ⑤SF 6 ⑥XeF 2 ⑦CS 2 ⑧CH 4 ⑨CF 2Cl 2A .②④⑦⑧⑨B .②④⑦⑨C .③④⑦D .④⑤⑦⑨10.X 、Y 、Z 三种元素都是短周期元素,在元素周期表中位置如图,X 和Z 原子核内的质子数之和等于Y 原子核内质子数,下列推断正确的是A .原子半径:X >Y >ZB .气态氢化物稳定性:X <Y <ZC .元素的非金属性强弱:Y <X <ZD .Y 和Z 形成的是分子晶体11.二氯化二硫(S 2Cl 2)是广泛用于橡胶工业的硫化剂;其分子结构中如右图所示:.常温下,S 2Cl 2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S 2Cl 2+2H 2O=SO 2↑+3S↓+4HCl.下列说法中错误的是( )A .S 2Cl 2的结构式为Cl-S-S-ClB .S 2Cl 2分子中既有有极性键又有非极性键C .反应中SO 2是还原产物,S 是氧化产物D .反应中,生成 1molSO 2,转移电子为3mol二、填空题12.(1)下列原子:C 、N 、Na 、H 、U 、K 、U 中共有_________种元素,苏教版高中化学必修二专题一第二单元《微粒之间的相互作用力》单元测试试题(解析版)_________种核素,____________互为同位素。
苏教版高一化学必修二专题复习 专题1 微观结构与物质的多样性复习纲要一、原子结构与元素原子核外电子排布规律 (一)、原子结构:原子的表示方法:X AZ ,其中X 是________,A 表示___________,Z 表示__________ 原子:核电荷数= = =原子序数质量数 = + ≈相对原子质量=阳离子:(a A m+) 核外电子数=质子数 - 所带电荷数,即核外电子数= 阴离子:(b B n-) 核外电子数=质子数 + 所带电荷数,即核外电子数=(二)、同位素:(要点)两同:质子数相同,同种元素;两不同:中子数不同,不同原子如:氢元素的同位素有 ,碳元素的同位素有 ,氧元素的同位素有 。
(三)、核外电子排布规律在含有多个电子的原子中,能量低的电子通常在离核较 的区域内运动,能量高的电子通常在离核较 的区域内运动。
据此可以认为:电子在原子核外距核由 到 ,能量是由 到 的方式进行排布。
通常把能量最 、离核最 的电子层叫第一层,由里往外以此类推,共有 个电子层,分别用字母 表示,每层最多容纳的电子数为 个,而最外层电子数不得超过 个(第一层为最外层时,电子数不超过 个),次外层不得超过 个 (四)、画出1-18号元素的原子结构示意图和离子结构示意图 元素(原子)符号 NaMgAlHCOSFCl原子结构示意图离子符号 ――离子结构示意图―― ――二、原子结构、元素周期律、元素周期表的关系(一)、原子结构与元素周期表的关系原子序数= = =周期系数= ;主族系数= =最高正价(O 、F 除外) 最高正价+|负价|= 周期表结构现行元素周期表的编排原则与特点:周期: 族 :(二)、元素周期律:1.随着原子序数的递增,元素的 (除稀有气体元素外)、 、 ( )都呈现 变化。
3.元素周期律是 随着元素核电荷数的递增发生周期性变化的必然结果。
(三)A. 元素的金属性和非金属性强弱的比较(重点、难点)同周期与同主族的变化规律以第三周期、第IA 、ⅦA 族为例:第三周期: O S 钠镁铝最高价氧化物的水化物碱性由强到弱的顺序为 > > 钠镁铝金属性: > >Si P S Cl 气态氢化物的稳定性顺序为 > > > ,O 和S 呢? Si P S Cl 最高价氧化物的水化物酸性由强到弱的顺序为 > > > C 和Si , > N 和P >Si P S Cl 非金属性: > > > C 和Si , > N 和P > 三、微粒间的相互作用力 (化学键 和 分子间作用力)离子键判断方法:,举例共价键判断方法:,举例分子间作用力:定义分子间作用力仅存在于由构成的物质,它的作用力比化学键(“强”或“弱”),分子间作用力是影响物质的和重要因素之一。
苏教版高中化学必修二第一专题知识点总结苏教版高中化学必修二第一专题知识点总结硇洲中学学案苏教版高中化学必修2知识点归纳总结第一单元原子核外电子排布与元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)A1.原子数ZX原子序数=核电荷数=质子数=原子的核外电子核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:HHeLiBeBCNOFNeNaMgAlSiPSClArKCa2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多2容纳的电子数是2n;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号:KLMNOPQ3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同的各元素从左到右排成一横行。
(周期序数=原子的电子层数)........③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
..........主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期12种元素短周期第二周期28种元素周期第三周期38种元素元(7个横行)第四周期418种元素素(7个周期)长周期第五周期518种元素周第六周期632种元素期不完全周期第七周期7未填满(已有26种元素)表主族:ⅠA~ⅦA 共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。