高一化学必修二《专题1微观结构和物质多样性》复习讲义
- 格式:ppt
- 大小:1.11 MB
- 文档页数:67








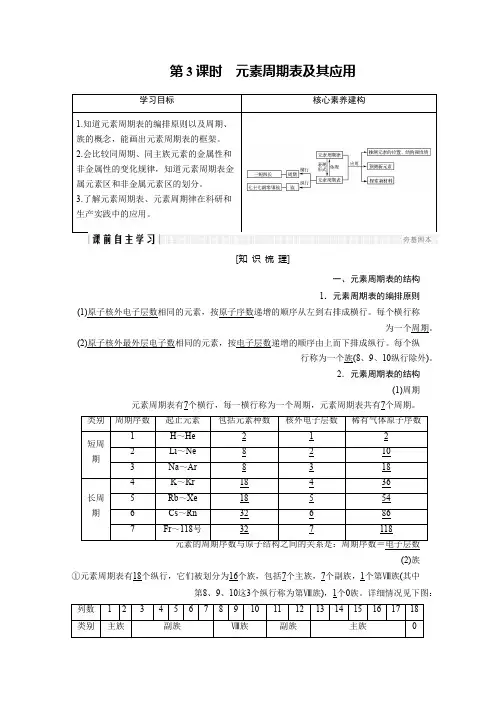
第3课时 元素周期表及其应用[知 识 梳 理]一、元素周期表的结构1.元素周期表的编排原则递增的顺序从左到右排成横行。
每个横行称原子序数相同的元素,按原子核外电子层数(1)。
周期为一个递增的顺序由上而下排成纵行。
每个纵电子层数相同的元素,按原子核外最外层电子数(2)(8、9、10纵行除外)。
族行称为一个2.元素周期表的结构(1)周期个周期。
7个横行,每一横行称为一个周期,元素周期表共有7元素周期表有电子层数元素的周期序数与原子结构之间的关系是:周期序数=(2)族族(其中Ⅷ个第1个副族,7个主族,7个族,包括16个纵行,它们被划分为18元素周期表有①个0族。
详细情况见下图:1族),Ⅷ第8、9、10这3个纵行称为第主族元素的族序数与原子结构之间的关系是:主族序数=最外层电子数【自主思考】1.硫元素在周期表中的位置是哪周期哪族?提示第3周期,ⅥA族。
2.元素周期表中所含元素种类最多的族是ⅠA族吗?说明理由。
提示不是,是ⅢB族。
因为第3列第6周期和第7周期包括镧系和锕系各15种元素。
3.原子序数为x的元素位于元素周期表中的第ⅡA族,则原子序数为x+1的元素位于元素周期表的哪一族?提示ⅢA族或ⅢB族。
原子序数为x+1的元素应位于ⅡA族右侧相邻的族,在短周期中为ⅢA族,在长周期中为ⅢB族。
二、主族元素性质的递变规律1.元素金属性与非金属性递变规律(1)同一周期元素(稀有气体元素除外)(2)同一主族元素2.元素周期表的金属区和非金属区B、Si、As、Te、At(1)分界线的划分:沿着周期表中Al、Ge、Sb、Po之间画一条斜线,跟金属斜线的左面是元素,右面是非元素。
金属金属性(2)分界线附近的元素,既能表现出一定的非金属性,又能表现出一定的,故元素的金属性和之间没有严格的界线。
非金属性【自主思考】4.根据元素周期表推断第1~6周期中最活泼的金属元素和非金属元素分别是什么?判断的依据是什么?提示铯、氟。
按照周期表的位置及元素周期律,非金属性最强的元素应该在元素周期表右上方的主族;金属性最强的元素应该在元素周期表的左下方。

高一化学必修2 专题一第三单元从微观结构看物质的多样性苏教版【本讲教育信息】一、教学内容第三单元从微观结构看物质的多样性二、考点清单1. 以金刚石、石墨、C60等碳的同素异形体为例认识由于物质微观结构的不同导致的同素异形体现象;2. 以正丁烷和异丁烷、乙醇和二甲醚为例认识同分异构现象;3. 认识不同的物质可以形成不同的晶体,了解不同类型晶体的结构,构成微粒及微粒之间的相互作用力和不同类型晶体的形成及性质差异。
三、全面突破知识点1:同素异形现象、同素异形体(1)概念:一种元素形成几种单质的现象,叫同素异形现象。
(2)表现:同素异形现象表现为一种元素具有几种单质,这几种单质都是这种元素的同素异形体.(3)同素异形体的性质:①构成同素异形体的原子数目和成键方式都不同,所以表现出的物理性质有很大的差别。
如氧气和臭氧:氧气是无色、无味的气体,而臭氧是淡蓝色有鱼腥味的气体;②同素异形体在一定条件下能互相转化,这是化学变化,如氧气转化为臭氧,石墨转化为金刚石,红磷转化为白磷等等。
(4)常见的同素异形体:①碳元素的同素异形体:金刚石、石墨和富勒烯(包括C60、C70和单层或多层的纳米碳管等)都是碳元素的重要单质;②氧元素的同素异形体:氧气和臭氧都是氧元素的单质;③磷元素的同素异形体:磷元素可以形成多种单质,白磷和红磷是磷元素常见的两种单质④硫元素的同素异形体:硫元素可以形成多种单质,S2、S4、S6、S8等,S6和S8是硫元素常见的同素异形体。
特别说明:同素异形体是一种元素形成的不同单质,既不是由相同元素组成的不同化合物,也不是同种元素形成的几种原子,更不是形态不同的同一物质。
例如:①都由碳氧两种元素组成的CO和CO2;②都由SiO2组成的石英和水晶;③都由氢元素形成的三种原子氕、氘,氚等;④气态氢和液态氢,二氧化碳和干冰;⑤冰和水等都不是同素异形体。
【典型例题】例1. 以下各组物质中互为同素异形体的是()A. 金刚石与石墨B. 氕、氘和氚C. 二氧化碳和干冰D. 石灰石和生石灰【解析】A 点拨:本题主要考查同素异形体的概念以及对同素异形体的理解,同素异形体是同一元素形成的不同单质,为单质,应该与同一物质、同位素和同分异构体区分开来。

《从微观结构看物质的多样性》讲义在我们生活的这个世界里,物质的种类繁多,从微小的原子到巨大的星球,从无形的气体到有形的固体,每一种物质都有着独特的性质和特点。
那么,是什么造就了物质的多样性呢?答案就藏在物质的微观结构之中。
首先,让我们来了解一下什么是微观结构。
微观结构指的是物质在原子、分子层面的组成和排列方式。
原子是构成物质的基本单位,就像一个个小小的积木。
不同的原子具有不同的性质,比如氢原子、氧原子、碳原子等。
而分子则是由原子通过一定的化学键结合而成的,例如水分子(H₂O)是由两个氢原子和一个氧原子组成的。
原子的结构对于物质的性质有着至关重要的影响。
原子由原子核和核外电子组成,原子核又包含质子和中子。
质子的数量决定了原子的种类,也就是元素的种类。
而核外电子的分布和运动状态则决定了原子的化学性质。
比如,最外层电子数较少的金属原子容易失去电子,表现出金属的性质;而最外层电子数较多的非金属原子则容易获得电子,形成稳定的结构。
分子的结构和类型也是导致物质多样性的重要因素。
分子可以分为单质分子和化合物分子。
单质分子如氧气(O₂)、氮气(N₂)等,它们由同种原子组成。
化合物分子则是由不同种原子通过化学键结合而成,像二氧化碳(CO₂)、甲烷(CH₄)等。
分子的形状、大小以及原子之间的键长、键角等都会影响物质的物理和化学性质。
晶体结构是物质微观结构的另一个重要方面。
晶体具有规则的几何外形和固定的熔点,这是由于其内部原子、分子或离子的有序排列。
常见的晶体类型有离子晶体、原子晶体、分子晶体和金属晶体。
离子晶体是由阴阳离子通过离子键结合而成的,如氯化钠(NaCl)。
离子晶体具有较高的熔点和沸点,在熔融状态或水溶液中能够导电。
原子晶体中,原子之间通过共价键形成空间网状结构,典型的例子是金刚石和二氧化硅。
原子晶体具有很高的硬度和熔点。
分子晶体中,分子间通过较弱的分子间作用力结合,像冰、干冰等。
分子晶体的熔点和沸点通常较低。
第二单元微粒之间的相互作用力第1课时离子键[知识梳理]一、离子键及离子化合物1.化学键直接相邻的原子或离子之间存在的(1)概念:物质中叫做化学键。
强烈相互作用的离子键(2)类型:和是两种常见的化学键。
共价键2.离子键(1)形成过程:NaCl的形成过程如图所示,利用原子结构知识解析NaCl的形成过程。
Na原子和Cl原子最外层电子数分别为1和7,均不稳定,它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质NaCl。
(2)概念:使带相反电荷的结合的相互作用。
阴、阳离子(3)构成离子键的粒子是阳离子和阴离子(4)离子键的实质是静电作用。
3.离子化合物(1)概念:由离子键构成的化合物。
(2)常见的离子化合物的类型:O 、MgO 2Na 活泼金属氧化物: 3、CaCO 4SO 2NaCl 、K 绝大多数盐:2NaOH 、Ba(OH)强碱:【自主思考】1.如何理解化学键的概念?提示2.常见的哪些元素易形成离子键?形成的过程是什么?提示 活泼金属与活泼非金属元素原子易形成离子键,一般位于周期表中为ⅠA 、ⅡA 族的金属元素与ⅥA 、ⅦA 族的非金属元素。
形成过程为:⎭⎪⎬⎪⎫活泼金属活泼非金属――→化合⎩⎨⎧⎭⎬⎫M ――→-ne -Mn +N ――→+me -Nm -――→吸引、排斥达到平衡离子键3.如何理解离子键中的静电作用?提示 静电作用包括静电吸引和静电排斥。
静电吸引即阴、阳离子之间的相互吸引;静电排斥即原子核与原子核、核外电子与核外电子的排斥作用。
二、电子式1.概念:·“发生变化,为了方便,我们在元素符号周围用最外层电子由于在化学反应中,一般是原子的的式子叫做电子式。
最外层电子(叉号)表示原子或离子的“×”(小黑点)或”2.电子式的书写。
、氯原子(1)原子的电子式:氢原子H·、钠原子Na·、氮原子(2)简单阳离子的电子式:简单阳离子是原子失去最外层电子后形成的,其电子式就是其阳离子符号,如Na +、Mg 2+等。